奥马珠单抗治疗61例慢性自发性荨麻疹的回顾分析
2023-05-11欧珊珊陈教全唐奕王雪吴伟鸿邹荟林天一李华平陈荃朱慧兰
欧珊珊, 陈教全, 唐奕,3, 王雪, 吴伟鸿, 邹荟, 林天一,李华平, 陈荃, 朱慧兰
1.广州医科大学,广东 广州 511436;2.广州市皮肤病防治所,广东 广州 510095;3.广州市第一人民医院,广东 广州 510180
慢性自发性荨麻疹(chronic spontaneous urticaria,CSU)是一种以自发性发作的风团和/或血管性水肿为特征,持续时间大于6周的常见炎症免疫性皮肤病。其反复发作,迁延不愈,严重影响了患者的学习、工作等。治疗上,2021版国际指南推荐使用常规剂量的第二代H1抗组胺药作为CSU的一线治疗,对于常规剂量疗效欠佳者,可增加剂量至4倍。对于4倍剂量仍不能控制症状者,可联合奥马珠单抗作为二线治疗唯一方案[1]。奥马珠单抗是目前唯一获批用于抗组胺药控制不佳CSU的抗IgE单抗生物制剂药物。国内外多项Ⅲ期临床研究均表明奥马珠单抗治疗CSU具有良好的疗效和安全性[2-6]。但目前国内有关临床研究报道有限[7-10],本研究旨在回顾性分析接受奥马珠单抗治疗的CSU患者的临床数据,为临床治疗提供参考。
1 对象与方法
1.1 研究对象
回顾性收集2020年9月至2022年11月在广州市皮肤病防治所门诊接受奥马珠单抗治疗的CSU患者。纳入标准:①符合《中国荨麻疹诊疗指南(2018版)》中CSU的诊断标准[11];②年龄≥12周岁,能配合医师完成调查问卷;③接受奥马珠单抗治疗至少12周,治疗时间以首次注射奥马珠单抗为第0周开始计算。排除标准:①同时合并慢性诱导性荨麻疹;②同时使用免疫抑制剂或奥马珠单抗之外的其他生物制剂。本研究经广州市皮肤病防治所医学伦理委员会批准(201712)。患者均签署知情同意书。
1.2 治疗方案
采用奥马珠单抗(瑞士诺华公司,批准文号2021B00994)治疗,初始剂量300 mg,每4周皮下注射1次。部分患者联合应用常规剂量的抗组胺药物,完全应答后逐渐停用抗组胺药物。
1.3 研究方法
1.3.1 资料收集 回顾性收集患者的临床信息、临床评分及实验室检查指标等。①临床信息包括患者性别、年龄、病程及治疗期间报告的不良事件;②临床评分为治疗前后7日荨麻疹活动度评分(urticaria activity score 7,UAS7)及皮肤病生活质量指数(dermatology life quality index,DLQI);③实验室检查指标包括:治疗前外周血C-反应蛋白(CRP)、红细胞沉降率(ESR)、总IgE、抗IgE抗体、抗IgE的高亲和力受体(FcεR Ⅰ)抗体、甲状腺自身抗体水平、抗核抗体谱、自体血清皮肤实验(autologous serum skin test,ASST)结果等。
血清总IgE测定采用化学发光法(总免疫球蛋白E测定试剂盒,英国Siemens Healthcare Diagnostics Products Limited),参考范围0~87 IU/L。血清抗IgE抗体、抗FcεR Ⅰ抗体测定采用ELISA法[人抗IgE抗体(Anti-IgE)ELISA试剂盒,人免疫球蛋白E fc段受体Ⅰ抗体(FcεRI Ab)ELISA试剂盒,上海蜜骏生物科技有限公司]。
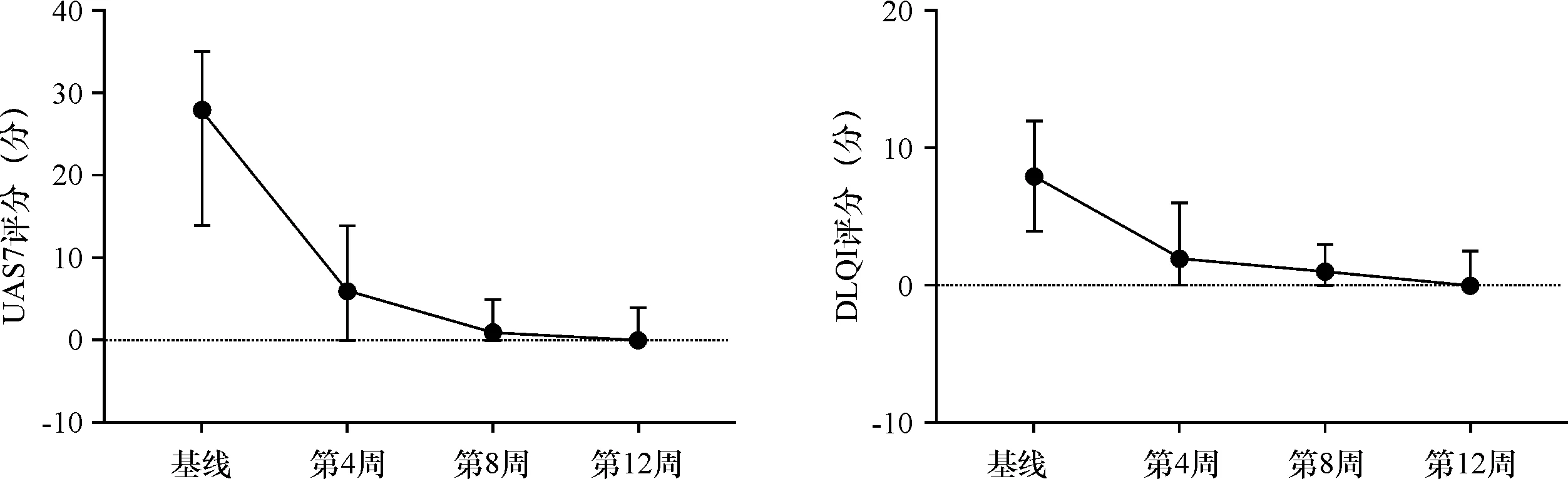
1.3.2 疗效评估及分析 所有患者均采用门诊随访形式,每4周随访1次。采用UAS7评估患者过去1周中疾病活动度,总分在0~42分之间,评分越高说明荨麻疹活动度越高,病情越严重。采用DLQI问卷对患者过去1周内皮肤疾病相关的生活质量进行回顾性评价,总分在 0~30 分之间,总分越高,表示皮肤疾病对患者的生活质量影响越严重。记录治疗前基线水平及治疗后第4、8、12周的UAS7、DLQI评分;分析患者奥马珠单抗治疗前后UAS7、DLQI评分随时间变化情况,评估奥马珠单抗治疗CSU的疗效。
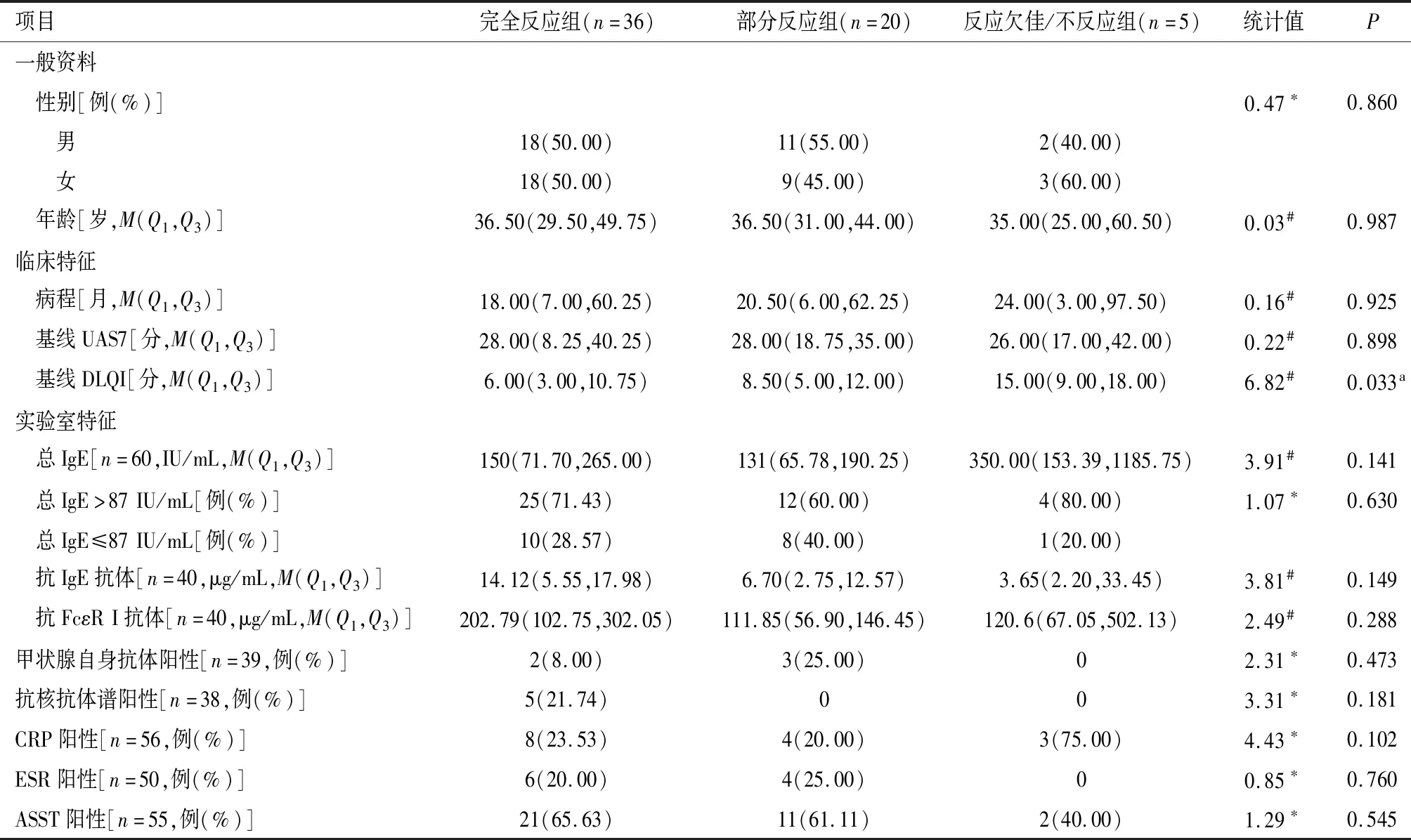
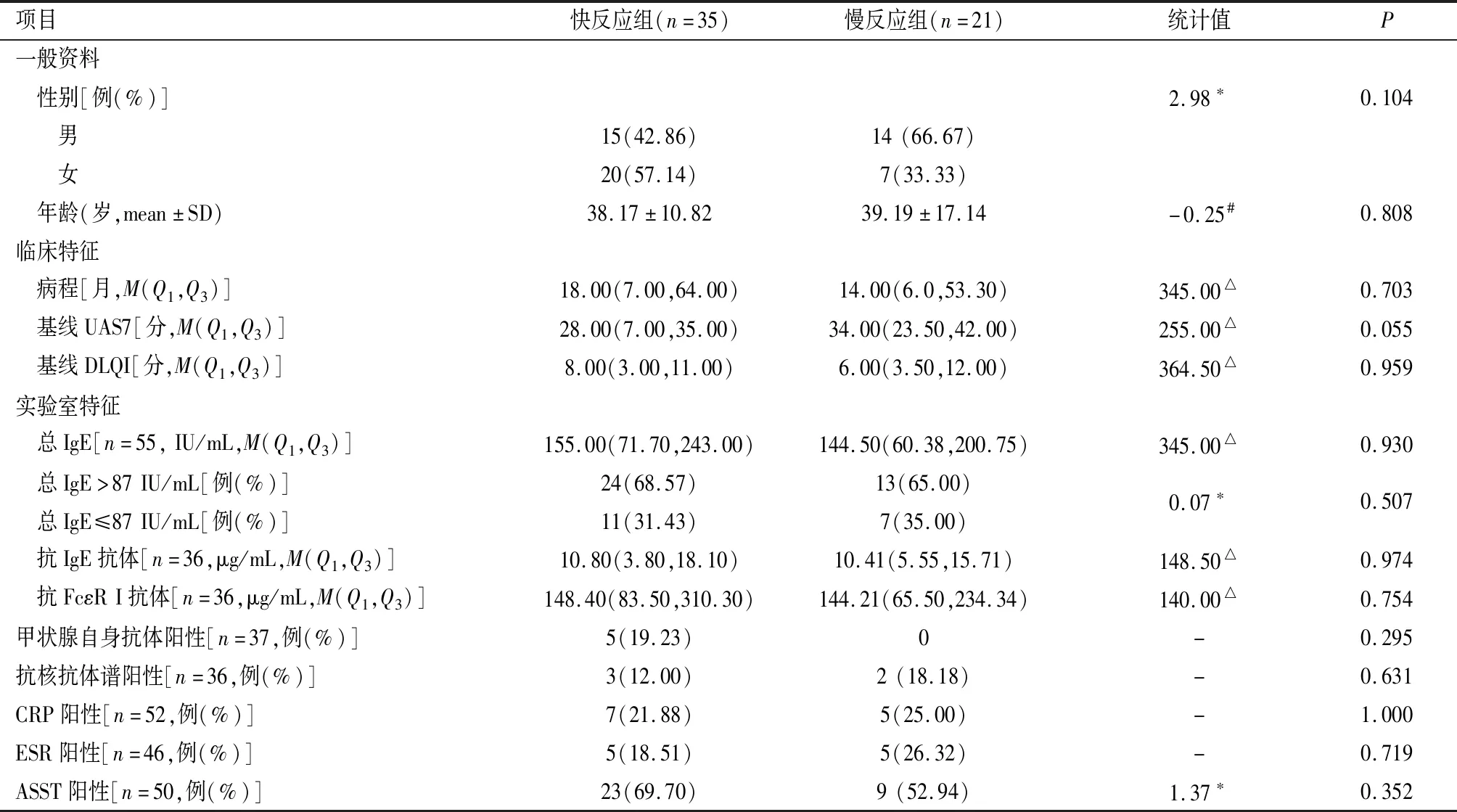
根据第12周UAS7分为完全反应(UAS7=0分)、部分反应(0分 采用SPSS 26.0软件对数据进行统计分析。计数资料使用n(%)表示,各组间计数资料的差异性分析均采用卡方检验或Fisher精确检验进行比较。各时间段的UAS7评分及DLQI评分采用M(Q1,Q3)表示,采用Mann-WhitneyU检验或t检验分析不同反应速度的CSU患者间各检测指标的差异,采用Kruskal-WallisH检验分析三组不同反应程度的CSU患者间各检测指标的差异性,采用Friedman检验分析治疗前与治疗后第4、8、12周多组评分变化的差异性,两两比较采用Bonferroni法调整显著性水平,P<0.05为差异有统计学意义。采用GraphPad Prism 9.5.1进行图形绘制。 共纳入61例患者,年龄13~72岁,平均(38.77±13.81)岁,其中男31例(50.82%),女30例(49.18%);病程2~388个月,中位数为18(6,59.5)个月。60例治疗前检测血清总IgE,平均为155.50(69.00,246.00) IU/mL,41例(68.33%)患者血清总IgE水平高于87 IU/mL。39例行甲状腺抗体检测,其中5例(12.82%)阳性。5例(13.16%)患者抗核抗体谱阳性,包括2例抗组蛋白抗体阳性、1例抗ds-DNA阳性、1例抗Jo-1抗体阳性、1例抗SS-A抗体弱阳性。55例患者治疗前进行ASST,其中34例(61.82%)阳性。 分别在患者使用奥马珠单抗治疗前(基线)及治疗后第4、8、12周记录UAS7、DLQI评分(图1)。经Shapiro-Wilk正态性检验,各时间段的UAS7评分及DLQI评分均不服从正态分布。 图1 慢性自发性荨麻疹患者UAS7评分、DLQI评分随治疗时间变化Figure 1 Changes in UAS7 and DLQI scores over the time following omalizumab treatment. UAS7在基线时为28.00(14.00,35.00)分,在奥马珠单抗治疗4周后降至6.00(0,14.0)分,第8周时为1.00(0,5.00)分,第12周达到0 (0,4.00)分。统计分析显示,奥马珠单抗治疗前(基线)及治疗后第4、8、12周患者UAS7评分的差异有统计学意义(2=110.03,P<0.001), Friedman检验的事后两两比较发现,治疗后第4、8、12周UAS7评分与基线相比,差异均有统计学意义(2=1.33、1.89、2.00,均P<0.001),而治疗后第4、8、12周UAS7评分各组间差异无统计学意义(P>0.05)。 DLQI在基线时为8.00(4.00,12.00)分,在奥马珠单抗治疗4周后降至2.00(0,6.50)分,第8周时为1.00(0,3.00)分,第12周达到0 (0,2.50)分。结果显示,治疗前(基线)及治疗后(第4、8、12周)患者DLQI评分的差异有统计学意义(2=77.02,P<0.001), Friedman检验的事后两两比较发现,治疗后第4、8、12周DLQI评分与基线相比,差异均有统计学意义(2=1.22、1.56、1.68,均P<0.001),而治疗后第4、8、12周DLQI评分各组间比较差异无统计学意义(P>0.05)。 2.3.1 基线指标与疗效 患者性别、年龄、病程、基线UAS7评分及基线血清总IgE、甲状腺自身抗体等指标在不同反应程度组间未见统计学差异(P>0.05,表1)。56例(91.80%)CSU患者对奥马珠单抗的治疗反应良好(图2),其中36例(59.02%)达到完全反应,20例(32.79%)为部分反应,5例(8.20%)对奥马珠单抗治疗反应欠佳/不反应。3组在基线DLQI评分上差异有统计学意义(H=6.82,P=0.033),采用Bonferroni法校正显著性水平(调整后P=0.016)后两两比较发现,DLQI基线评分仅在完全反应组与反应欠佳/不反应组的差异有统计学意义(H=-20.74,P=0.014),完全应答组与部分应答组(H=-6.84,P=0.166)、部分应答组与反应欠佳/不反应组(H=-13.90,P=0.116)之间的差异无统计学意义。 表1 对奥马珠单抗反应程度不同的CSU患者的基线特征Table 1 Baseline characteristics of CSU patients with different responses to omalizumab therapy 图2 奥马珠单抗治疗慢性自发性荨麻疹患者应答比例Figure 2 Response rates over the time. 2.3.2 基线指标与反应速度 在56例对奥马珠单抗治疗有效的患者中快反应组35例(62.50%),慢反应组21例(37.50%)。经统计分析,未发现与反应速度间有统计学差异的临床或实验室基线指标(表2)。 表2 对奥马珠单抗反应速度不同的CSU患者的基线特征Table 2 Baseline characteristics of CSU patients with different response time to omalizumab therapy 61例患者均未发现低血压、呼吸困难、过敏性休克等不良反应。1例患者于第2次注射奥马珠单抗治疗后局部注射部位出现水肿性红斑、瘙痒,持续约5 d自行消退,期间未出现恶心、呕吐、低血压、呼吸困难等系统症状;再次注射奥马珠单抗时未发现类似症状。 奥马珠单抗是一种人源化的抗IgE单克隆抗体,主要通过与游离IgE的结合直接抑制其与肥大细胞及嗜碱性粒细胞表面FcεR Ⅰ结合,从而抑制细胞的活化[12]。 本研究中,59.20%(36/61)在使用奥马珠单抗治疗12周后达到完全控制, 91.80%(56/61)症状得到明显改善,这与既往报道的真实世界研究数据接近[10-13]。Tharp等[13]对真实世界研究数据的系统综述中显示,在294例CSU患者接受奥马珠单抗治疗后UAS7评分平均降低了25.6分,84例CSU患者接受奥巴珠单抗治疗后DLQI评分平均降低了13.9分。国内一项研究中,CSU患者使用奥马珠单抗治疗后DLQI评分从基线到12周时降低了11.50(7.30~17.00)分[10]。本研究中,患者UAS7评分经12周治疗由基线的28(14.00,35.00)分降至0(0,4.00)分,DLQI评分则降低了8分,与既往研究结果相近。以上结果均提示奥马珠单抗可有效改善CSU的症状,提高患者生活质量。 DLQI评分越高提示患者日常生活等方面受CSU疾病影响程度越大,生活质量越低。本研究中,完全反应组与反应欠佳/不反应组在DLQI基线评分上的差异有统计学意义(H=-20.74,P=0.042),反应欠佳/不反应组的DLQI评分比完全反应组高。提示生活质量受CSU影响更大的患者可能对奥马珠单抗治疗的反应更差。 基线血清总IgE低可能提示患者对奥马珠单抗治疗反应欠佳[14-16]。Ertas等[14]研究认为,低IgE(<43 IU/mL)患者在治疗的前12周内对奥马珠单抗治疗无反应的风险为33%。Asero等[16]研究中发现绝大多数无反应者基线总IgE小于20 IU/mL,且该研究检测到奥马珠单抗反应的阈值IgE水平为18 IU/mL。然而,本研究中6例患者基线总IgE水平低于40 IU/mL(最低为9.10 IU/mL),均对奥马珠单抗反应良好,其中4例达到完全控制。研究结果与Wang等[9]和Salman等[17]研究结果一致。基线总IgE水平在不同反应程度的CSU患者间差异不具统计学意义(H=3.92,P=0.141),但由于本研究中反应欠佳/不反应患者相对较少,还需纳入更多的病例进行观察研究,以使结论更具科学性。此外,本研究未显示各反应组在人口统计学、病程、UAS7评分及各实验室特征上的差异。 高达45%的CSU被认为是由自身免疫机制所介导[18]。其中,对于IgG抗体介导的Ⅱb型自身免疫反应,奥马珠单抗的作用机制可能与游离IgE水平下降进而下调肥大细胞和嗜碱性粒细胞表面FcεRⅠ的表达相关[19]。因此,IgG介导的自身免疫标志物,如ASST、嗜碱性粒细胞组胺释放试验、抗甲状腺抗体、抗核抗体被认为与奥马珠单抗反应缓慢或无反应相关[20]。研究表明,ASST阳性患者可能表现出对奥马珠单抗治疗的缓慢反应[10,20]。然而,本研究中快反应组与慢反应组在人口统计学、临床及实验室基线特征上未发现显著差异。原因可能在于CSU发病机制复杂,奥马珠单抗可能通过多种途径发挥治疗作用,因此,难以用单一的生物标志物预测奥马珠单抗的疗效、应答等。 本研究中不良反应事件的发生率为1.64%(1/61),为轻度不良反应事件,且未发现呼吸困难、过敏性休克等严重不良反应。既往报道中常见的不良反应有注射部位局部反应、注射后荨麻疹皮损加重、上呼吸道感染等,绝大多数不良事件为轻度或中度[2, 5, 8-9]。Tharp等[13]对真实世界研究进行的meta分析显示奥马珠单抗治疗CSU的平均不良事件发生率为4.0%。国内一项纳入235例CSU患者的真实世界研究结果显示,奥马珠单抗治疗期间2.55%(6/235)的患者报告了不良事件,未发生严重不良反应事件[9]。因此,奥马珠单抗治疗CSU具有良好的安全性。 综上,本研究结果显示,奥马珠单抗治疗CSU具有显著的有效性及良好的安全性,但本研究纳入的病例有限,随访时间较短,仍需在今后纳入更多的病例对奥马珠单抗治疗CSU的有效性和安全性进行长期观察,并进行相关生物标志物等方面研究,以便更好地协助临床评估及治疗。1.4 统计学处理
2 结果
2.1 一般资料
2.2 评分变化情况
2.3 基线指标与疗效、反应速度等关系分析

2.4 安全性评估
3 讨论
