IL-17A 对卵巢癌进展的影响及机制研究
2023-05-11郑小燕郁春艳刘俊汝刘子璇陈思琦邓为民
郑小燕,郁春艳,刘俊汝,刘子璇,陈思琦,邓为民
(天津医科大学基础医学院免疫学系,国家教育部免疫微环境与疾病重点实验室,天津 300070)
卵巢癌(ovarian cancer,OvCa)是一种腹腔内肿瘤,具有向网膜转移的明显倾向性,临床数据显示有80%的OvCa 患者存在网膜转移[1]。脂肪细胞是OvCa 转移至网膜的主要介质,其分泌脂肪因子,如白细胞介素(IL)-6、IL-8、单核细胞趋化因子(MCP)1,促进肿瘤优先归巢至网膜;随后,脂肪细胞为肿瘤提供脂肪酸(FA)促进肿瘤快速增殖生长[1-3]。几类脂肪酸受体参与肿瘤细胞对FA 的摄取转运,在FA 易位至细胞膜内侧时,脂肪酸结合蛋白(fatty acidbinding protein,FABPs)与FA 结合并将其运送至细胞器进行代谢[4]。FABP4 是FABPs 家族最丰富成员之一,多项研究显示FABP4 参与OvCa 网膜转移,CRISPR 介导的FABP4 敲除或使用小分子抑制剂(BMS309403)可显著减轻小鼠肿瘤负担,并增强对铂类治疗的敏感性[3,5-6]。目前靶向FABP4 已成为延缓OvCa 进展的一个策略,但是影响FABP4 表达的因素还需进一步明确。
炎性微环境是肿瘤微环境的一个重要组成部分。Mukherjee 等[4]报道IL 诱导脂肪细胞中脂质分解,释放FA。IL-17A 属于多效性炎性因子,是IL-17 家族研究最多且最具代表性的细胞因子,其主要通过IL-17A 受体(IL-17RA)发挥作用[7]。多项研究显示IL-17A 在肿瘤中表达上调,通过促进血管生成[8];提高调节性T 细胞(Treg)免疫抑制活性加速肿瘤进展[9-10]。Bilska 等[11]研究显示在OvCa 患者血浆和腹膜液中IL-17A 水平显著高于良性肿瘤组及对照组;此外,IL-17A 在脂肪细胞中也扮演重要角色[12],基于此本课题组在OvCa 中探讨IL-17A 是否影响FABP4 表达进而促进OvCa 进展。前期的细胞实验表明外源性IL-17A 可通过其受体直接作用于卵巢癌细胞系A2780 和OVCAR3,通过激活信号转导与转录激活因子(SATA)3 信号促进FABP4 表达。在体外研究的基础上,本文旨在通过动物实验和临床标本探讨IL-17A 对OvCa 进展的影响并验证其相关机制。
1 材料与方法
1.1 材料 小鼠卵巢上皮乳头状浆液性腺癌细胞系ID8 由南开大学李鲁远教授惠赠;C57BL/6 遗传背景的野生型(WT)小鼠购自中国军事医学科学院实验动物中心,雌性,6~8 周龄,体重18~20 g;C57BL/6遗传背景的IL-17A 缺陷型(IL-17A-/-)小鼠由日本东京理科大学生物医学科学研究所Yoichiro Iwakura 教授惠赠,雌性,6~8 周龄,体重18~20 g;DMEM培养基购自南京凯基生物科技发展有限公司;胎牛血清(FBS)购自GIBCO 公司;IL-17A(DF6127)、FABP4(DF6035)、STAT3(AF6294)、磷酸化STAT3(p-STAT3)(Tyr705,AF3293)、GAPDH(AF7021)抗体购自Affinity 公司,以上抗体人鼠通用,用做后续的Western 印迹和免疫组化实验;30 例OvCa 患者的病理组织石蜡切片标本来自天津市中心妇产医院,同时收集患者的临床病理资料。这些标本及病理资料的使用均已获得天津市中心妇产医院伦理委员会批准。
1.2 方法
1.2.1 细胞培养 ID8 细胞用含有10% FBS 的DMEM 培养基培养,每1~2 天更换培养液并消化传代,培养箱条件为37℃,CO2浓度为5%。待ID8 细胞处于对数生长期,消化处理进行后续实验。
1.2.2 小鼠体内实验 腹腔注射氯胺酮麻醉小鼠,待角膜反射消失后将其固定,如Connolly 等[13]报道所述,将ID8 细胞以1×106/20 μL PBS/只的剂量原位注射于6~8 周雌性C57BL/6 遗传背景的WT 小鼠和IL-17A-/-小鼠卵巢囊内(每组6 只),通过观察卵巢囊膨胀来确定注射是否成功。每日测量小鼠体重观察小鼠状态。8 周后颈椎脱臼处死小鼠,打开腹腔观察小鼠卵巢囊内成瘤和腹腔转移情况,并使用佳能90D 单反相机进行拍照。
1.2.3 Western 印迹 用RIPA 裂解液(含蛋白酶抑制剂)充分裂解小鼠肿瘤组织提取总蛋白,BCA 测定蛋白含量。将蛋白等量上样于10%聚丙烯酰胺凝胶中电泳,PVDF 转膜,3%的牛血清白蛋白(BSA)封闭非特异性抗原后,添加一抗GAPDH(1∶1 000),STAT3(1∶1 000),p-STAT3(1∶1 000),FABP4(1∶1 000),4℃低速震荡孵育过夜,次日,加入二抗室温孵育2 h,化学发光成像仪扫描条带,Image J 软件分析蛋白条带。以GAPDH 为内参,目的条带与内参条带比值表示目的蛋白相对表达量。
1.2.4 免疫组织化学染色 石蜡切片标本厚度为5 μm。切片经常规脱蜡、脱水后,将其置于柠檬酸钠缓冲液中微波炉煮沸进行抗原修复,恢复至室温后去除内源性过氧化物酶,血清封闭,滴加一抗IL-17A(1∶200),FABP4(1∶200)于4℃孵育过夜。次日,进行二抗孵育,DAB 显色,复染,脱水透明封片。实验步骤按试剂盒说明书进行。
结果判定标准:采用Mattern 积分法对染色结果进行评分,每个标本在显微镜(400×)下随机选择10 个视野,结合阳性细胞百分比和染色强度综合判断。染色强度分4 级:无阳性着色0 分;浅棕褐色1分;棕褐色2 分;深棕褐色3 分。阳性细胞数占视野中总细胞数的百分比分4 级:无阳性细胞记0 分;1%~25%记1 分;26%~50% 记2 分;50%以上记3分。染色强度评分加阳性细胞百分比评分为最终得分。得分<3 分为阴性表达(-),≥3 分为阳性表达(+)。
1.3 统计学处理 采用GraphPad Prism 9 进行统计学分析并绘图。两组间比较采用t 检验,用四格表Fisher's 精确检验分析IL-17A、FABP4 表达与临床病理资料的关系。以P<0.05 为差异具有统计学意义。
2 结果
2.1 IL-17A 促进小鼠OvCa 原位成瘤和腹腔转移 由图1 可知,WT 小鼠造模部位卵巢明显肿大,与周围组织黏连,其表面可见若干瘤结节,分界不清(图1Aa);肿瘤广泛分布于腹腔,在网膜、肠系膜、肠管外壁和腹壁可见明显瘤结节[图1Ab(a)~(d)所示]。IL-17A-/-小鼠造模部位卵巢肿大,与周围组织无黏连,表面瘤结节较少(图1Ac)。与WT 小鼠相比,IL-17A-/-小鼠腹腔瘤结节显著减少(图1B,t=5.132,P<0.05)。
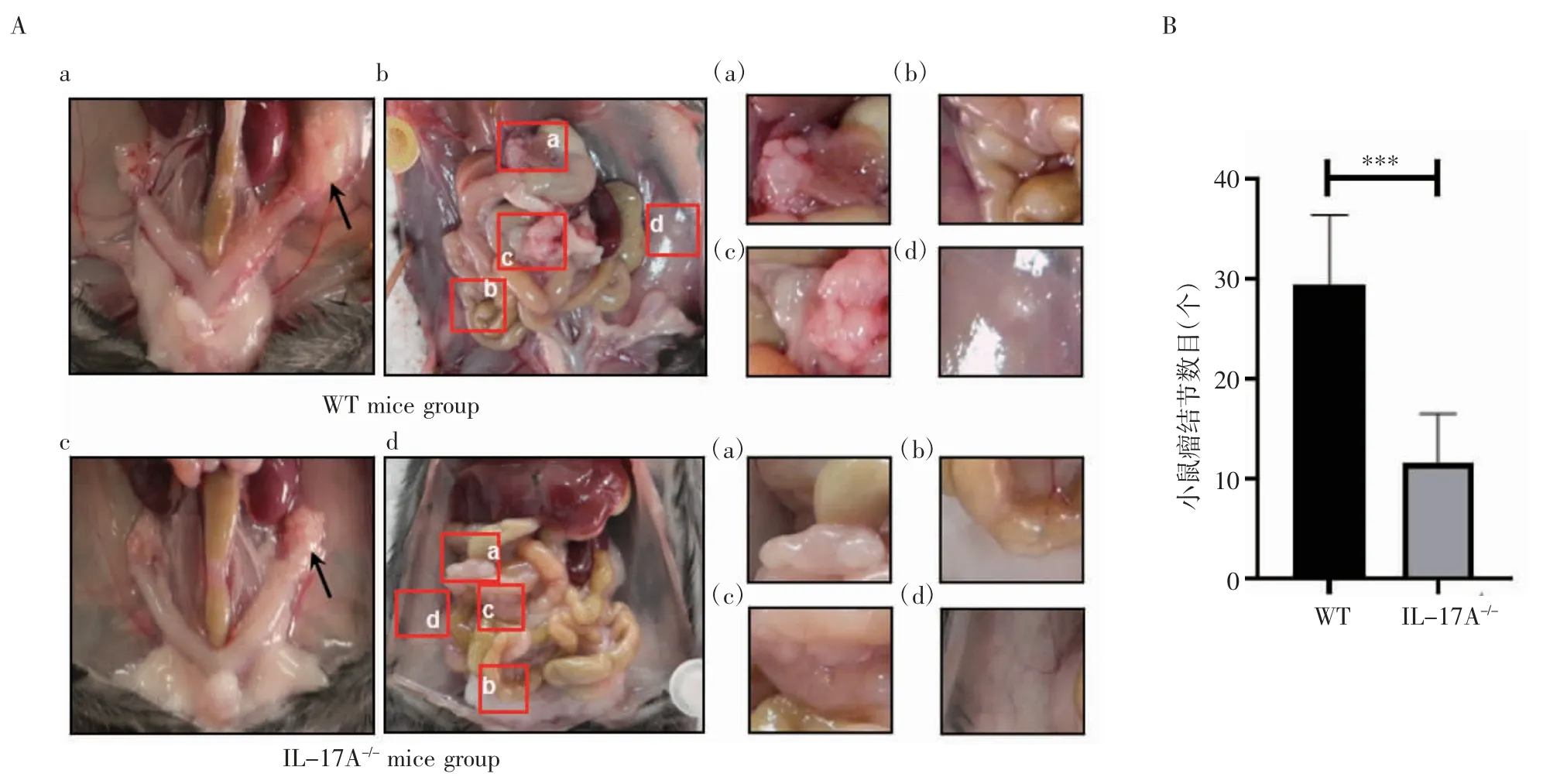
图1 IL-17A 促进小鼠OvCa 原位成瘤和腹腔转移Fig 1 IL-17A promoted orthotopic tumorigenesis and intraperitoneal metastasis of OvCa in mice
2.2 IL-17A 通过激活STAT3信号促进FABP4表达由图2 可知,与WT 小鼠相比,IL-17A-/-小鼠肿瘤组织中FABP4、p-STAT3 蛋白表达显著降低,差异具有统计学意义(图2B,t=11.347、8.180,均P<0.01);然而,两组之间STAT3 表达无统计学差异(图2B,t=0.110,P>0.05)。
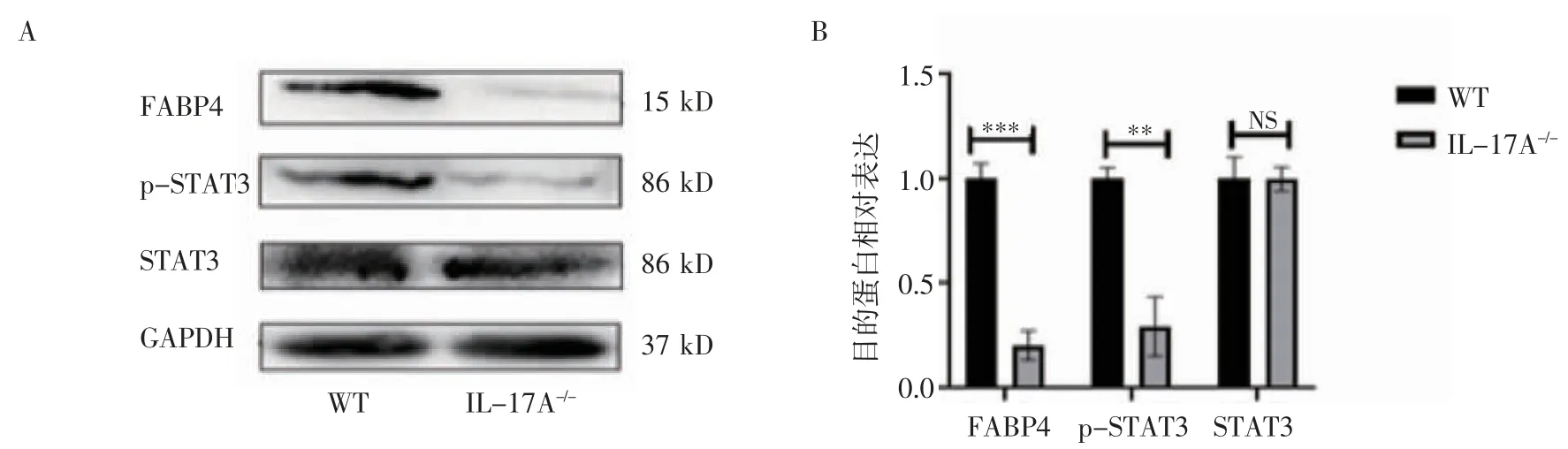
图2 小鼠肿瘤组织中FABP4、p-STAT3、STAT3 蛋白表达Fig 2 Expression of FABP4,p-STAT3 and STAT3 proteins in mouse tumor tissue
2.3 IL-17A 在OvCa 患者中的表达 收集30 例OvCa 患者石蜡切片标本进行免疫组织化学染色。有15 例患者(50%)IL-17A 呈阳性表达,13 例患者(43.3%)FABP4 呈阳性表达,染色结果如图3 所示。在IL-17A 阳性组中FABP4 阳性表达率为66.7%,在IL-17A 阴性组中FABP4 阳性表达率为20%,IL-17A 表达与FABP4 表达具有一定相关性,差异具有统计学意义(表1)。
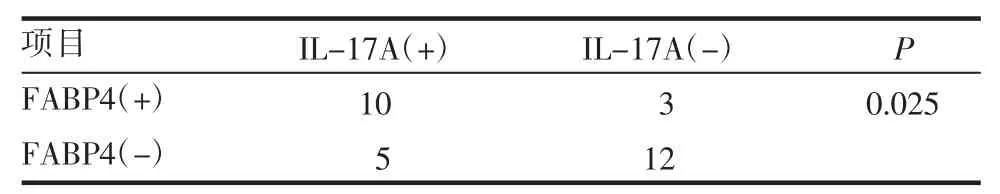
表1 IL-17A 与FABP4 的相关分析Tab 1 Correlation analysis between IL-17A and FABP4

图3 人卵巢癌组织中IL-17A、FABP4 表达情况(400×)Fig 3 Expression of IL-17A and FABP4 in human ovarian cancer tissues(400×)
使用Fisher's 精确检验分析IL-17A、FABP4 表达与OvCa 患者临床病理资料的关系。结果显示IL-17A、FABP4 表达与患者年龄无关(均P>0.05),与癌症FIGO 分期、转移有明显关系(均P<0.05),见表2、3。
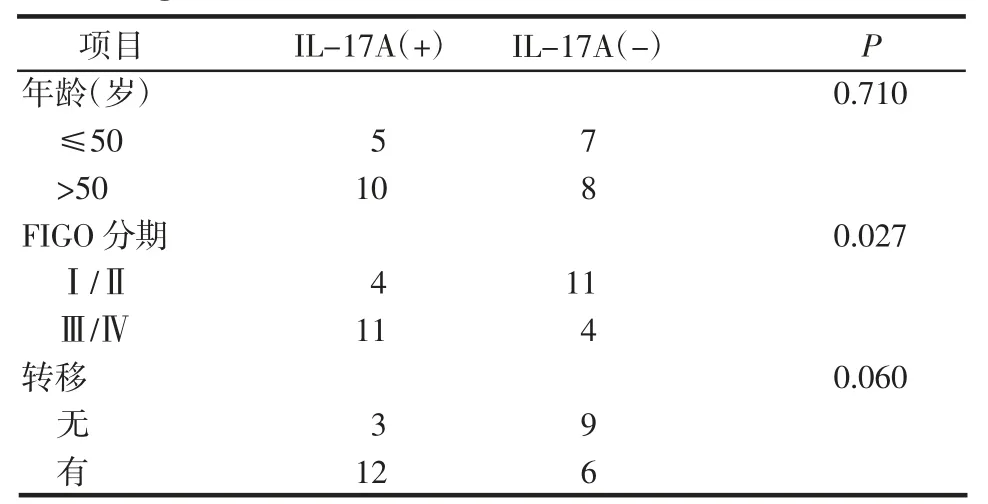
表2 IL-17A 与临床病理资料之间的关系Tab 2 Relationship between IL-17A expression and clinicopathological data
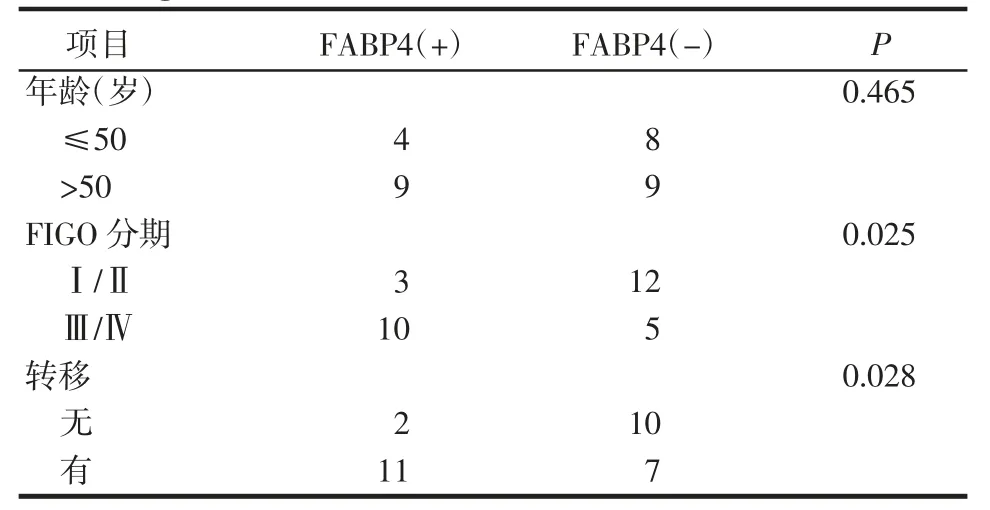
表3 FABP4 与临床病理资料之间的关系Tab 3 Relationship between FABP4 expression and clinicopathological data
3 讨论
OvCa 是最致命的妇科恶性肿瘤,其致死率高、预后较差[14]。由于该疾病隐匿,大多数患者在晚期确诊,表现为腹腔转移和腹水形成[15]。目前,手术加铂类/紫杉类为主的化疗是OvCa 患者主要治疗方案,但由于化疗耐药的出现,患者5 年生存率并没有显著提高[16-17]。
FABP4 是重要的脂质伴侣蛋白,通过结合和重新分配脂肪酸来协调细胞内脂质反应[3]。FABP4 主要在脂肪细胞和巨噬细胞表达,参与糖尿病胰岛素抵抗、炎症以及血管生成[18-20]。在前列腺癌和OvCa中,FABP4 是脂肪细胞参与癌症进展的关键介质[5]。研究显示FABP4 在OvCa 中高表达,通过摄取游离脂肪酸为癌细胞提供能量,促进癌细胞增殖和网膜转移[3,5]。FABP4 已成为治疗优先转移至脂肪组织的腹腔播散性肿瘤(如OvCa、胃癌和结肠癌)的极好靶点[1]。本研究通过动物实验和临床标本证实IL-17A可通过激活STAT3 信号通路上调FABP4 表达,进而促进OvCa 生长转移。
本课题组前期体外结果显示外源性IL-17A 可通过其受体直接作用于卵巢癌细胞系A2780 和OVCAR3,通过激活STAT3 信号促进FABP4 表达。棕榈酸(PA)是一种常用的长链脂肪酸,充当外源脂肪酸来源,体外研究表明在PA、IL-17A 存在的情况下,肿瘤细胞通过IL-17A/IL-17RA/p-STAT3/FABP4 轴增强对PA 的摄取,促进细胞增殖。
为了进一步探讨IL-17A 对OvCa 生长转移的影响,本研究以相同基因背景来源的IL-17A-/-小鼠和WT 小鼠为研究对象建立原位种植瘤模型,检测IL-17A 对OvCa 原位成瘤和腹腔转移的影响,结果显示IL-17A 显著促进小鼠OvCa 原位成瘤和腹腔转移。与WT 小鼠相比,IL-17A-/-小鼠肿瘤组织中p-STAT3、FABP4 蛋白表达显著降低,在动物实验中进一步证实IL-17A 可通过IL-17A/IL-17RA/p-STAT3/FABP4 轴促进OvCa 进展。OvCa 患者临床病理标本显示IL-17A、FABP4 表达与癌症FIGO 分期、转移相关,并且两者表达也存在一定相关性。本研究通过动物实验和临床标本证实IL-17A 可通过激活STAT3 信号上调FABP4 表达,进而促进OvCa生长转移。IL-17A/IL-17RA/p-STAT3/FABP4 轴可能只是IL-17A 促进肿瘤进展的原因之一,其他方面的影响也不容忽视。Coffelt 等[21]报道,IL-17A 可促进中性粒细胞扩增极化,进而抑制CD8+T 细胞活化,促进乳腺癌转移。Li 等[22]报道IL-17A 可通过激活酪氨酸蛋白激酶(JAK)、STAT 信号通路促进胃癌细胞上皮间质转化,导致肿瘤侵袭、转移。虽然IL-17A 可通过多种机制发挥促肿瘤作用,但本研究证明IL-17A 可通过IL-17A/IL-17RA/p-STAT3/FABP4 轴促进OvCa 生长转移,这至少是一个影响肿瘤生长的重要机制。
综上所述,本研究通过动物实验和临床标本证实IL-17A 可通过IL-17A/IL-17RA/p-STAT3/FABP4 轴促进OvCa 生长转移,为临床干预OvCa提供了新的思路和策略。
