一株适宜于Kefir发酵的优良酵母菌的筛选与鉴定
2023-05-10肖冉,惠明,2*,田青
肖 冉,惠 明,2*,田 青
1.河南工业大学 生物工程学院, 河南 郑州 450001 2.工业微生物菌种保藏与选育河南省工程实验室, 河南 郑州 450001
开菲尔(Kefir)最早起源于北高加索地区[1],是一种多菌种混合发酵的含酒精起泡的酸乳制品,由共生于开菲尔粒中的多种乳酸菌、酵母菌与醋酸菌发酵牛乳或羊奶制得[2-3]。Kefir除了具有一般酸奶所不具备的特有口感和风味外,还有抗毒素[4]、免疫调节[5]、抗肿瘤[6]等多种益生功能。我国对开菲尔的研究尚处于理论研究阶段。
甜瓜曲是酵子的一种,是酵母未工业化生产之前制作馒头的传统发酵剂[7]。它是由甜瓜瓤与面粉混匀成面团后用荷叶包裹经大自然发酵而成的天然发酵剂。酵子与单一干酵母粉不同,含有丰富的菌种资源(由酵母菌、乳酸菌及霉菌等形成的混菌体系)[8-9],其中占比最多的是酵母菌属。酵母菌在发酵中可形成酯类、醇类、醛类、酮类等风味物质,能够显著影响产品的风味品质[10-11]。
当前市面上存在的Kefir乳并不具有独特的沙口感及果酒风味。酵母菌作为开发Kefir乳的重要发酵剂之一,能贡献特殊风味。酵母菌产气的性质导致产品在包装及运输中可能会造成胀气、胀罐的问题。解决此类问题的文献较少,作者从菌种选育的角度尝试筛选一株产气适中,具有沙口感且风味独特的酵母菌用于开发Kefir发酵乳。从甜瓜曲中分离纯化出4株产香酵母菌,并对其初筛、复筛得到产香突出、适应性强、代谢旺盛的优良酵母菌株,为新型Kefir发酵剂资源的开发与利用奠定了基础。
1 材料与方法
1.1 材料与试剂
甜瓜曲:兰考县万恒食品有限公司;真菌基因组提取试剂盒:武汉纳磁生物科技有限公司;酵母膏、葡萄糖、蛋白胨: 北京奥博星生物技术公司;纯牛奶:内蒙古蒙牛乳业股份有限公司。
1.2 仪器与设备
酶标仪:美国伯腾仪器有限公司;DYY-8C电泳仪:北京六一仪器厂;手动固相微萃取进样器(SPME手柄,50/30 μm DVB/CAR/PDMS萃取头)、DB-WAX(30 m×0.25 mm×0.25 μm)弹性石英毛细管色谱柱:江苏默克仪器有限公司。
1.3 试验方法
1.3.1 培养基的配制
YPD培养基配制参考文献[12];孟加拉红培养基配制参考文献[13]。
1.3.2 酵母菌的分离纯化
称5 g甜瓜曲至250 mL三角瓶中,并加入适量无菌水于28 ℃、150 r/min振荡30 min[14]。吸取梯度稀释后的200 μL样品涂布于孟加拉红固体平板、YPD固体平板。28 ℃恒温培养2 d后挑选形态像酵母菌的单菌落进行分离纯化3代,镜检后YPD斜面保藏。
1.3.3 酵母菌复筛
初筛酵母菌株以2%接种量分别接种到酒精体积分数为 4%、6%、8%、10%、12%、14%的YPD液体培养基中,28 ℃ 培养3 d后通过观察杜氏管中的产气情况及测定菌体在600 nm处的吸光度(OD600),比较各菌株的耐酒精能力[15]。
按2%接种量将酵母菌分别接入用1 moL/L H2SO4调制pH值为1.5、2.5、3.5、4.5、5.5、6.5的液体YPD培养基中,28 ℃培养3 d后通过观察杜氏管中的产气情况及检测菌体的OD600,比较各菌株耐酸能力[16]。
按2%接种量将酵母菌分别接入YPD液体培养基中,并于28、32、36、40、44 ℃培养3 d后通过观察杜氏管中的产气情况及检测菌体的OD600,比较各菌株的耐高温能力[16-17]。
1.3.4 酵母菌株的形态及结构观察
观察纯化后单一菌落的颜色、形状、表面光滑度及湿润度等特征,挑取单菌落于载玻片上,在光学显微镜(40倍)物镜下观察菌体形态[18]。
参考吕好新等[19]的方法进行扫描电镜结构观察。
1.3.5 酵母菌株的遗传鉴定
酵母菌DNA的提取[20-21]:将分离纯化获得的酵母菌株分别接种于YPD液体培养基中,在28 ℃、180 r/min条件下培养24 h后,转入新的YPD液体培养基中继代培养,提取继代培养的菌体DNA,并于-20 ℃保存产物。
酵母菌的PCR扩增:扩增引物为26S NL1和NL4。扩增条件:96 ℃预变性5 min;96 ℃变性20 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环,72 ℃再延伸10 min。PCR产物经1%琼脂糖凝胶电泳鉴定回收,在华大基因研究公司进行测序。测序结果在NCBI库中进行BLAST比对,用MEGA7.0软件构建系统发育树,进行26S rDNA同源性分析。
1.3.6 酵母菌株产风味物质的主成分分析
GC-MS条件参考文献[22]并略有改动。称取复筛酵母菌发酵的牛奶样品各3 g,加入21 mL饱和食盐水,吸取20 μL的0.009 g/L内标物(2-辛醇)混匀,取混匀后样品5 mL于20 mL顶空瓶中,45 ℃水浴平衡10 min,萃取45 min,解析3 min后进行检测。
1.4 数据处理
采用Origin 2018软件对数据进行制图和统计分析,采用IBM SPSS Statistics 26软件进行显著性分析,利用Mega 7.0软件构建系统发育树。
2 结果与分析
2.1 酵母菌的筛选
2.1.1 酵母菌初筛
用稀释涂布分离法从甜瓜曲样品(图1)中分离纯化酵母菌株,通过3次单菌落传代,在孟加拉红培养基、YPD培养基上初步筛选4株典型酵母菌(编号分别为TN1、N2、Z2、HX)进行菌落形态观察,结果如表1所示,生长曲线如图2所示。

图1 甜瓜曲样品Fig.1 Schematic diagram of melon koji

表1 各菌株菌落形态Table 1 Morphology of each strain colony
由图2可知,TN1和N2具有相同的延滞期、对数生长期和平稳期,而且这两株酵母平稳期较长,在发酵过程中稳定性较高。相对于TN1和N2,HX虽然具有相对较高的生物量,但是具有稍长的延滞期、对数生长期和平稳期,培养时间较长;Z2的最大生物量低于HX,且延滞期更长。

图2 4株酵母菌生长曲线Fig.2 Growth curve of 4 strains of yeast
2.1.2 酵母菌复筛
通过耐酸、耐酒精及耐温度测试对4株初筛菌株的性能进行考察,结果如图3及表2—表4所示。
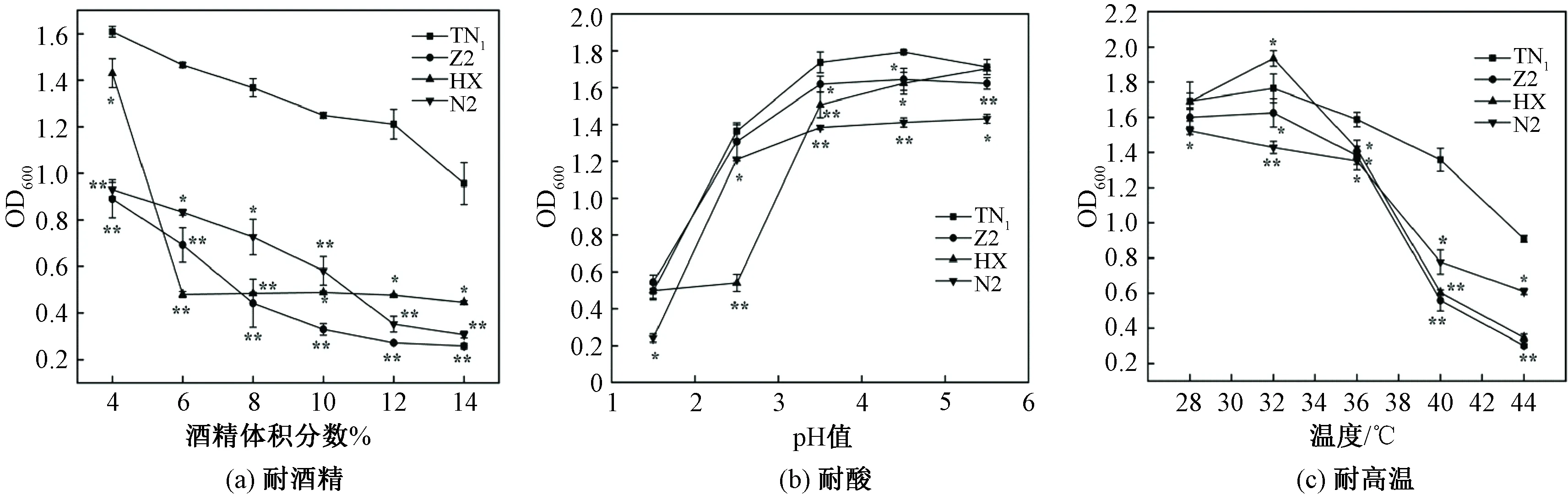
注:*、**分别表示与TN1对比显著差异(P<0.05)、极显著差异(P<0.01)。图3 不同发酵条件对各菌株的耐受力影响Fig.3 Effects of different fermentation conditions on the tolerance of each strain
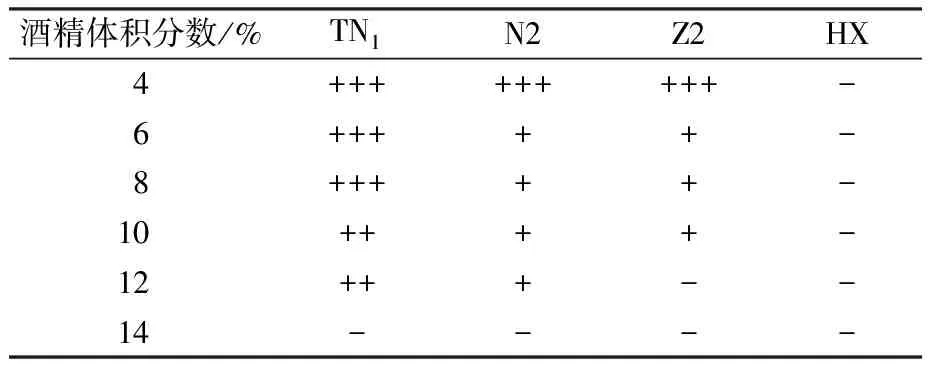
表2 各酵母菌不同酒精体积分数下的产气情况Table 2 Gas production of yeast under different alcohol concentrations
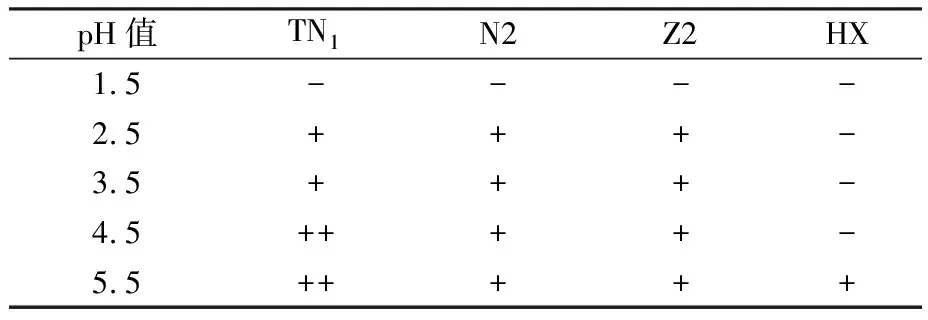
表3 各酵母菌不同酸度下的产气情况Table 3 Gas production of yeast under different acidity

表4 各酵母菌不同温度下的产气情况Table 4 Gas production of yeast under different temperature
由图3(a)和表2可知,菌体浓度随着酒精体积分数的增大逐渐减少,这是由于酒精体积分数升高会抑制细胞生长[23],4株酵母菌在酒精体积分数4%时生长较好,TN1、N2、Z2均可产生充足杜氏小管的气体,在酒精体积分数达到14%时生长明显都被抑制且均不产气,而HX酵母在不同的酒精体积分数下均不产气。其中TN1产气较快、耐受力较强,与HX有显著差异,与Z2、N2有极显著差异。由图3(b)和表3可知,pH值在1.5时Z2菌体浓度稍高于TN1,无显著差异,所有菌株均不产气。随着酸度逐渐升高,TN1的菌体浓度也逐渐提升,耐酸性和产气能力优于其他菌株,具有显著性差异。由于在酒精发酵过程中酵母菌会产生酸性代谢产物[24-25],因此可以在发酵过程中保持较高活性的耐酸性酵母菌株对发酵有利。由图3(c)和表4可知,随着温度的升高各菌株在32 ℃时菌体浓度达到最高,随后逐渐降低。40 ℃时HX和Z2菌体浓度下降幅度较大,与TN1均具有极显著差异,说明这两株菌株耐高温性能差,而TN1耐温性最好且在40 ℃和44 ℃时均能产生充足的气体,N2次之。综上,通过耐酒精、耐酸及耐高温等特性考察,复筛出TN1、N2作为目标菌株进行下一步试验并比较二者发酵性能,为后续Kefir酒精性酸乳的开发提供参考依据。
2.2 复筛菌株发酵乳制品风味物质主成分分析
采用固相微萃取-气质联用法对两株酵母发酵的牛奶进行挥发性风味物质检测并分析,TN1检测到32种挥发性风味物质,N2检测到25种挥发性风味物质。TN1和N2酵母菌所产的挥发性物质及其相对含量如表5所示。选取酯类、醇类、酮醛类化合物中含量较多及香气特殊的风味物质17种进行主成分分析,分析两组样品风味物质的特点,结果见表 6。
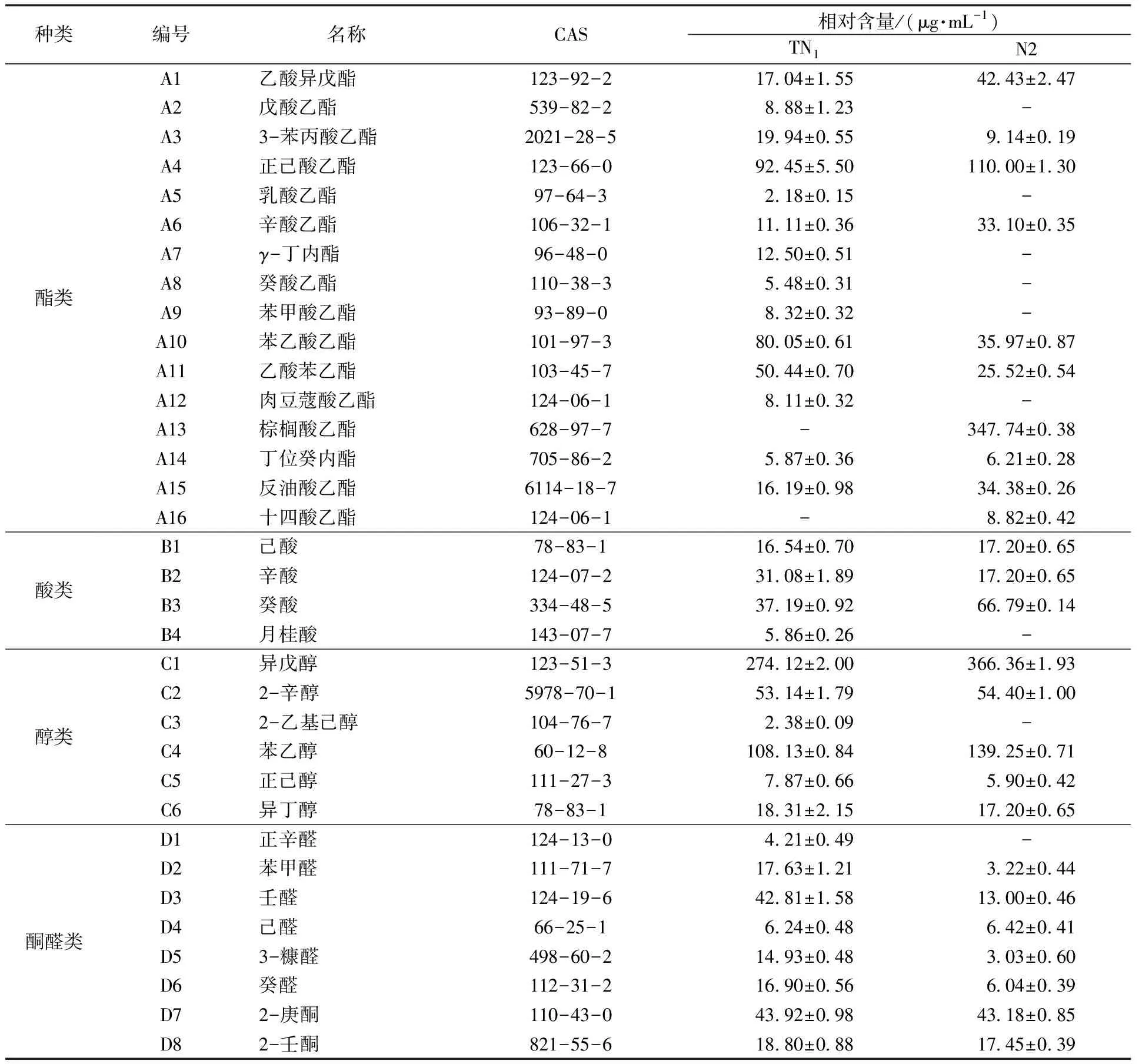
表5 两种酵母菌发酵牛奶的风味物质种类及相对含量Table 5 Types and relative content of flavor substances in two yeast-fermented milk
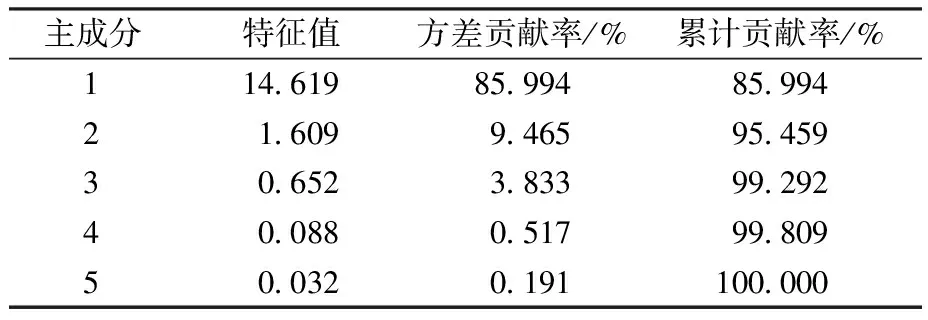
表6 主成分分析的特征值、贡献率及累计贡献率Table 6 Eigenvalues, contribution rate and cumulative contribution rate of the principalcomponents
表5中酯类、醇类及酮醛类是酵母菌主要挥发性香气物质。GC-MS检测结果中壬醛与苯乙醇具有特殊玫瑰香气,酯香可以促进发酵乳香气的协调性[26]。正己酸乙酯、辛酸乙酯、乙酸异戊酯等酯类占比较大,赋予花香和热带水果香气[27-28]。另外,酵母菌在生长代谢过程中产酸,除辛酸、癸酸赋予发酵样品桃子味、奶酪等多种风味外,其余酸类物质也能与乙醇经酯化酶的催化产生乙酯类香味物质,提高产品风味[29]。同时,酵母在生长过程中,利用氨基酸通过脱羧、还原过程生成相应的高级醇[30],包括异丁醇、异戊醇、苯乙醇等,赋予Kefir乳特殊的玫瑰香气及果香;当然,高级醇含量应在适当范围,若过高会呈现苦涩、冲辣的现象,产生不愉悦的杂味[31],表5中显示TN1菌株产生的风味更丰富一些,高级醇含量相对适中。
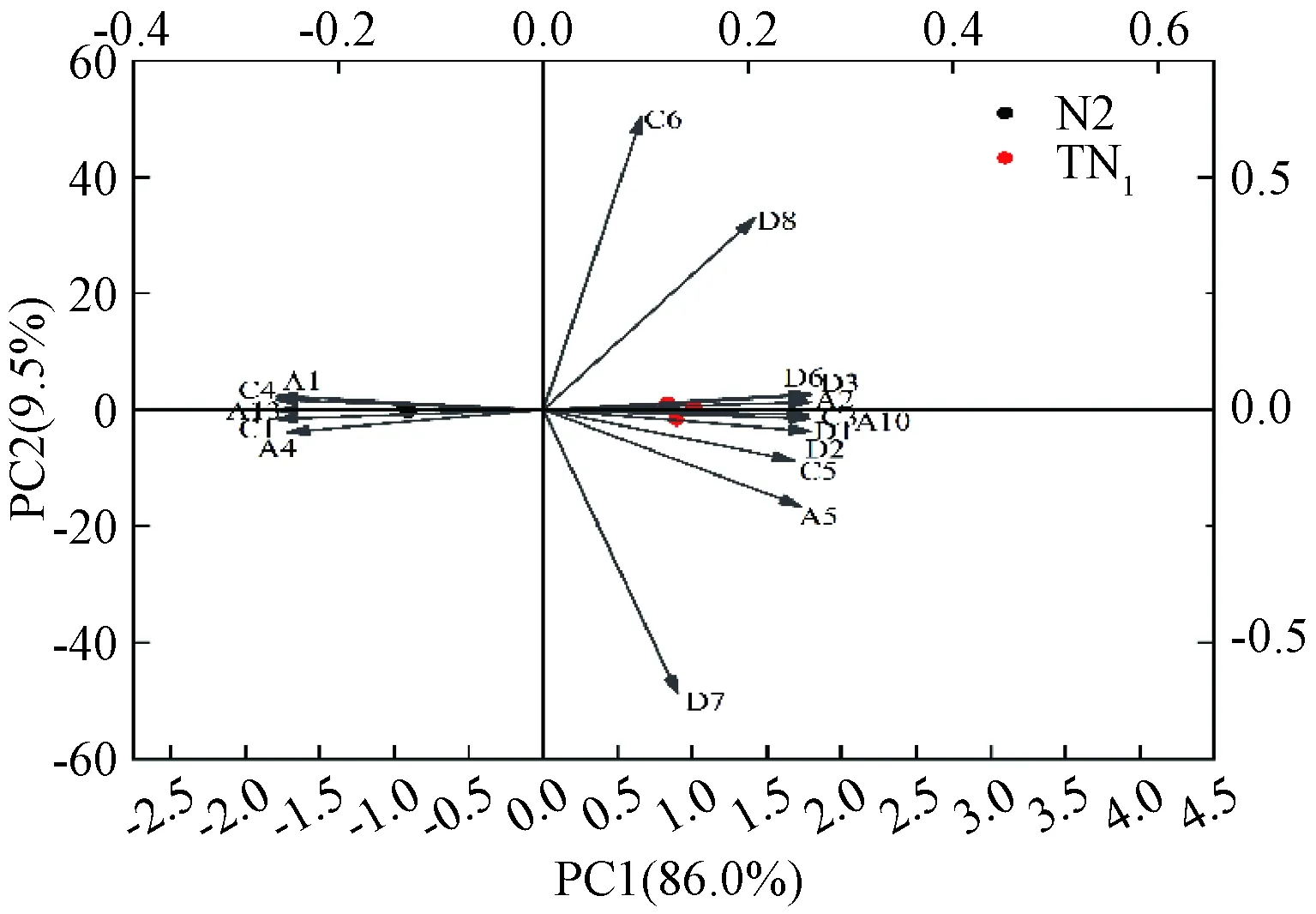
注:右侧的3个红色圆点代表TN1 3次平行试验结果;左侧3个黑色圆点代表N2的3次平行试验结果。图4 两种酵母菌发酵牛奶的主成分分析结果Fig.4 Principal component analysis results of two yeast-fermented milk
从图4可知,PC1 的贡献率为86.0%,PC2的贡献率为9.5%,前两个主成分能解释整体变异的94.5%,可以显著区分两种酵母菌发酵牛奶的风味物质。风味物质较多分布在TN1样品,N2样品中风味物质种类较少。乙酸异戊酯、正己酸乙酯、棕榈酸乙酯、异戊醇和苯乙醇是N2样品中的主要风味物质;TN1样品中包含主要酯类3种,其中具有优势风味物质的乳酸乙酯。醇类物质的正己醇、异丁醇、2-庚酮,距离两种样品较远,更偏向于是TN1样品的主要成分。根据矢量投影可知,各风味物质在TN1样品中种类更复杂、含量较高、香气更佳。
综合来看,TN1菌发酵乳具有较佳且丰富的风味种类,高级醇含量适中。本试验不仅为后续Kefir酒精性酸乳发酵提供了优势菌种,还具有一定的应用价值。
2.3 TN1菌株的形态观察及生物学鉴定
2.3.1 TN1菌株的形态学观察
通过光学显微镜、扫描电镜观察酵母菌TN1的形态,结果见图5。菌落表面黏稠、润滑、质地均一、易挑起,乳白色,形态呈椭圆形,芽殖,具有典型酵母菌细胞形态。

图5 TN1酵母菌菌落、菌体形态及扫描电镜图Fig.5 Colony, cell morphology and SEM characterization of TN1
2.3.2 TN1菌株的生物学鉴定
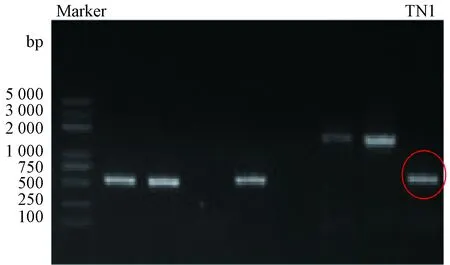
图6 菌株TN1的PCR扩增产物琼脂糖凝胶的电泳结果Fig.6 Results of agarose gel electrophoresis of PCR amplification products of strain TN1
提取TN1菌株基因组DNA并对其进行26S rDNA PCR 扩增。由图6可知,目的片段长度大约500 bp,将PCR目的片段切胶回收后送至华大基因研究公司测序,并将测序结果使用NCBI网站BLAST 模块比对。
下载相似性较高的比对结果的FASTA格式文件,采用软件Mega7.0 构建了26S rDNA序列的系统发育树(图7),基于26S rDNA 基因序列的系统发育树表明,经菌种鉴定TN1菌株与NRRL Y-12632具有100%的同源性,该菌株鉴定为酿酒酵母(Saccharomycescerevisiae)。
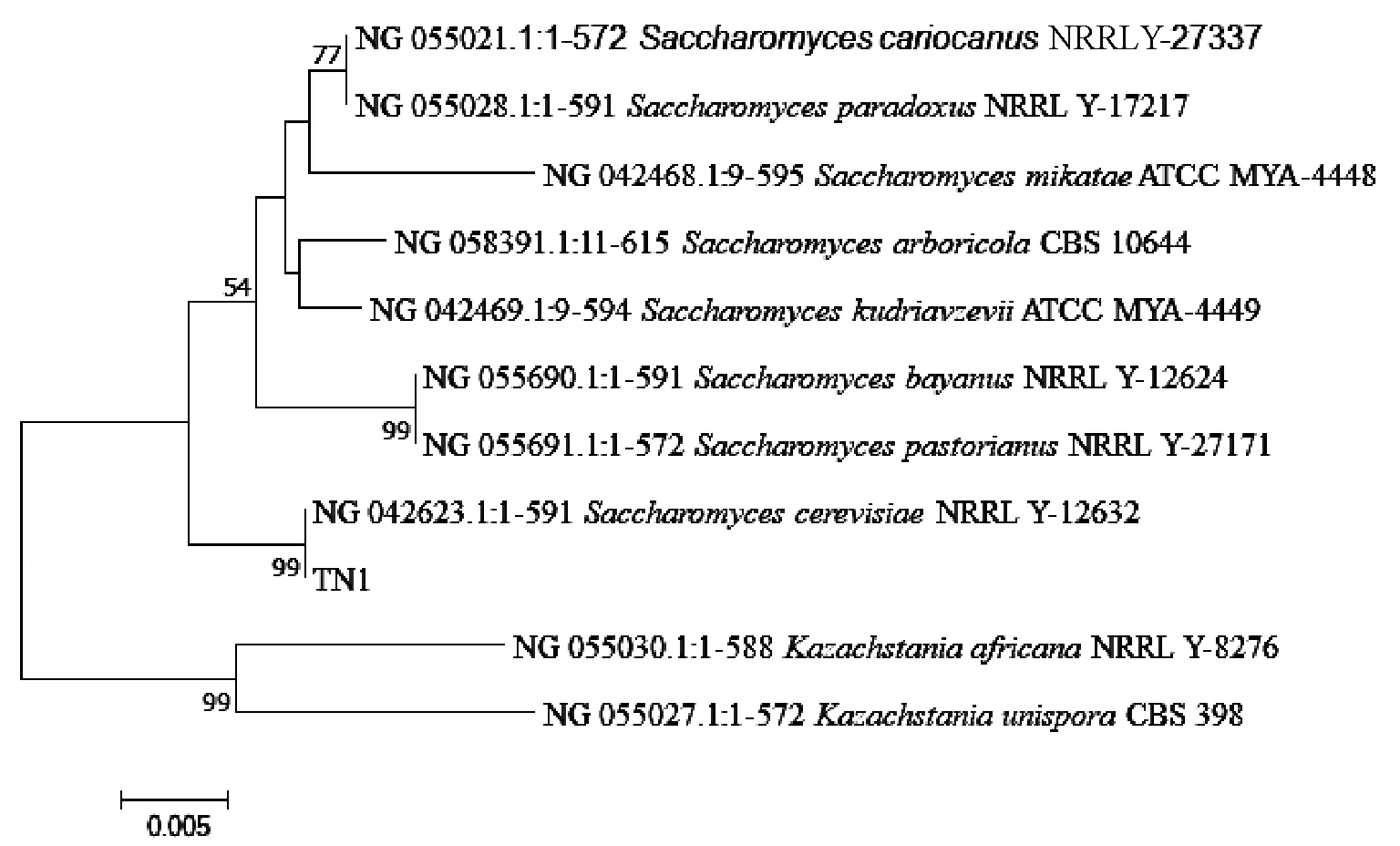
图7 菌株TN1基于26S rDNA序列系统进化树Fig.7 Phylogenetic tree of strain TN1 based on 26S rDNA gene sequence
3 结论
本试验从甜瓜曲中分离纯化出4株产香酵母菌,分别编号为TN1、N2、Z2、HX。通过耐高温、耐酸、耐酒精试验对4株酵母进行初筛、复筛,采用固相微萃取-气质联用色谱(SPME-GC-MS)对香气物质分析进行主成分分析。结果表明,4株酵母菌中TN1、N2发酵性能较佳,而TN1发酵牛奶产生的香气物质种类最多,高级醇含量适中,产生的香气更佳,更适合后续Kefir酸乳的开发。结合TN1菌株的分子生物学分析结果,该菌株与NRRL Y-12632菌株同源性为100%,表明其具有较高的同源性,将TN1鉴定为酿酒酵母。
本试验以牛奶作为发酵基质,研究了TN1酵母菌的香味物质成分,为后续Kefir酒精性酸乳发酵提供了一株产香多、耐受性强的酵母菌。但Kefir属于混菌体系,TN1与乳酸菌以及醋酸菌的协同作用以及工艺条件优化仍需进一步探索。TN1发酵性能的研究不仅有利于Kefir酒精性酸乳风味物质的提升,而且为后续Kefir发酵剂的开发奠定了基础。
