老年非小细胞肺癌多发脑转移患者不同放疗模式下的疗效和剂量学特点
2023-05-10边亚红杜国威赵清叶鞠芳
边亚红,杜国威,赵清叶,鞠芳*
(1青岛大学医学部,山东 青岛 266075;2青岛大学附属青岛市中心医院·青岛市肿瘤医院肿瘤科,山东 青岛 266042)
最新研究表明,全球新发的非小细胞肺癌患者约70%为≥65岁的老年人[1]。高达50%的非小细胞肺癌患者在病程中会出现脑转移,严重威胁患者的生命健康[2]。目前,放射治疗为脑转移瘤治疗的主要方式之一。全脑放疗(whole-brain radiotherapy,WBRT)是≥4个病灶的非小细胞肺癌脑转移患者的主要治疗方式之一[3]。随着放射治疗技术的发展,临床医师较多地选择在全脑放疗的基础上对转移瘤进行同步加量(simultaneous integrated boost,SIB)或全脑放疗后对转移瘤进行序贯加量(sequential boost,SB)。目前有关全脑放疗或全脑放疗联合病灶加量放疗的疗效和安全性的研究结果尚不统一,且缺少同时比较全脑放疗、全脑放疗联合同步加量和全脑放疗联合序贯加量三种放疗模式之间优劣的研究。而老年患者由于身体机能减退、常合并多种疾病,对放疗的耐受性相对较差,尤其值得关注。目前有关老年非小细胞肺癌多发脑转移患者放疗模式选择、有效性和安全性的研究少有报道。本研究关注老年患者非小细胞肺癌多发脑转移的放疗疗效与安全性,拟通过分析真实世界里在不同放疗模式下的疗效、剂量学特点及不良反应发生情况,为临床确定老年患者非小细胞肺癌多发脑转移的放疗模式选择提供依据。
1 对象与方法
1.1 研究对象
选择2018年8月至2021年8月在青岛大学附属青岛市中心医院行颅脑放疗的老年非小细胞肺癌多发脑转移患者115例。纳入标准:年龄65~86岁;原发病灶经病理学证实为非小细胞肺癌,有或无表皮生长因子受体(epidermal growth factor receptor,EGFR)敏感突变,无其他敏感突变;脑转移病灶经增强核磁共振确诊,脑转移病灶数≥4个;行调强适形放疗(intensity modulated radiation therapy,IMRT)或容积弧形调强放疗(volumetric modulated arc therapy,VMAT),全脑放疗或全脑放疗+病灶局部加量放疗;体力状况评分(pain score, PS)≤2分;预计生存时间≥3个月。按照放疗模式的不同分为3组,其中全脑放疗组40例、序贯加量组33例、同步加量组42例。
1.2 方法
1.2.1 CT扫描定位 患者取仰卧位,采用头部热塑膜固定,模拟CT增强扫描。扫描范围:上界为颅顶,下界为颅底下5cm,层厚为3mm。扫描图像上传至Eclipse TPS放射治疗计划系统,进行靶区勾画和计划设计。
1.2.2 靶区及危及器官勾画 放疗靶区由已获得医院放疗技术授权的医师勾画,所有患者的靶区均经副主任及以上医师审核。肿瘤病灶靶区(gross tumor volume,GTV)为影像学显示的可见肿瘤病灶,计划肿瘤靶区(plan gross tumor volume,PGTV)为GTV外放3mm,临床靶区(clinical tumor volume,CTV)为全脑,计划靶区(planning tumor volume,PTV)为CTV外放3mm。危及器官勾画包括脑干、晶体、视交叉和视神经。
1.2.3 放疗计划设计和审核 由物理师进行放疗计划设计,均经副主任及以上医师审核,共同评价并进行优化。全脑放疗组处方剂量:95% PTV 40Gy/20f或30Gy/10f,均为5次/周,其中32例采用IMRT技术,8例采用VMAT技术。序贯加量组处方剂量:全脑放疗95% PTV 40Gy/20f,全脑放疗结束后给予脑转移病灶加量95% PGTV 20Gy/10f,均为5次/周,脑转移病灶总剂量为60Gy/30f,其中10例采用IMRT技术,23例采用VMAT技术。同步加量组处方剂量:95% PTV 40Gy/20f,同步给予95% PGTV 50~60Gy/20f,5次/周,其中15例采用IMRT技术,27例采用VMAT技术。限制危及器官剂量:脑干<54Gy,晶体<9Gy,视交叉<54Gy,视神经<54Gy。对于出现轻微及以上占位效应的脑转移患者,在放疗过程中使用甘露醇联合地塞米松脱水、降颅压治疗,以缓解脑水肿及相关症状。
1.3 观察指标
1.3.1 疗效评价 所有患者在结束颅脑放疗1~3个月内行颅脑增强核磁共振检查,评价近期疗效。根据实体瘤疗效评价标准1.1版(RECIST 1.1版)进行疗效评价,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病进展(progressive disease,PD)、疾病稳定(stable disease,SD)。总有效率(overall response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。
治疗结束后对3组患者进行远期疗效评价。通过医院病历系统查找和电话随访方式记录患者颅内无进展生存期(intracranial progression-free survival, IPFS)和总生存期(overall survival, OS),计算1年IPFS率和1年OS率。IPFS为自放疗开始至PD的时间,OS为自放疗开始至死亡或失访时间。随访截止时间为2022年8月。
1.3.2 剂量学参数评价 对3组放疗计划质量进行评价,其中序贯加量组的靶区计划为全脑放疗计划和序贯加量计划融合后的计划。评价指标如下。(1)靶区适形值(conformation number,CN):(Vt, pres /Vt)×(Vt,pres/Vpres)。Vt,pres为处方剂量包绕的靶区体积;Vt为靶区体积;Vpres为处方剂量包绕的人体体积。CN值越接近于1表示靶区适形度越好。(2)处方剂量靶区体积比(prescription isodose volume to target volume ratio,PITV):Vpres/Vt。PITV值<1,表示靶区未完全被处方剂量线覆盖;PITV值>1,表示处方剂量线覆盖范围过大。(3)靶区覆盖度(target coverage,TC):Vt,pres/Vt。TC值在0~1之间波动,理想值为1。(4)均匀指数(homogeneity index, HI):(D2%-D98%)/Dmedian,式中D2%为2%靶区体积接受的放射剂量,D98%为98%靶区体积接受的放射剂量,Dmedian为靶区中位剂量。HI值越接近于0,靶区剂量分布越均匀。
1.3.3 安全性评价 观察放疗期间和放疗后出现的不良反应,包括恶心呕吐、骨髓抑制和神经系统不良反应。其评价参考放射肿瘤协作组(radiation therapy group,RTOG)急性放射性损伤分级标准。
1.4 统计学处理
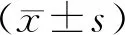
2 结 果
2.1 临床资料的比较
3组患者的性别、年龄、病灶体积、原发病灶是否控制、是否颅外转移、颅外转移是否控制、是否行表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinases inhibitor,EGFR-TKI)治疗的临床基本资料比较,差异均无统计学意义(均P>0.05;表1)。
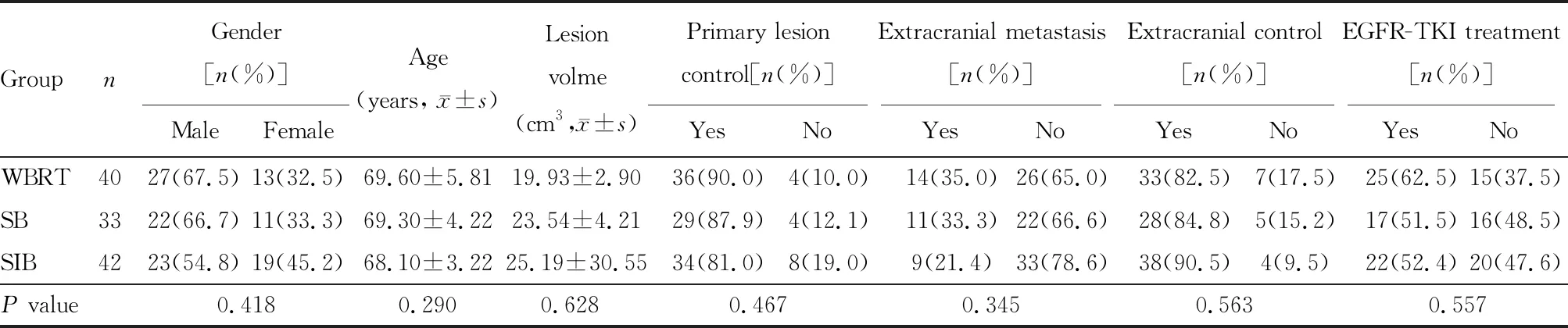
表1 患者一般资料比较
2.2 3组患者近期与远期疗效比较
近期疗效:同步加量组的ORR和DCR较全脑放疗组高,差异均有统计学意义(均P<0.05),其余组间比较差异均无统计学意义。远期疗效:序贯加量组和同步加量组1年的IPFS率及OS率较全脑放疗组高,差异均有统计学意义(P<0.01),其余组间比较差异均无统计学意义(表2)。
2.3 3组患者靶区剂量学参数的比较
同步加量组PTV的CN、PITV优于全脑放疗组和序贯加量组,全脑放疗组CN、PITV优于序贯加量组,差异均有统计学意义(均P<0.01);序贯加量组PTV的TC优于其他2组,差异有统计学意义(P<0.05);全脑放疗组的HI明显优于其他2组,同步加量组的HI优于序贯加量组,差异均有统计学意义(均P<0.01),其余组间比较差异均无统计学意义(表3)。同步加量组PGTV的CN、PITV优于序贯加量组,差异均有统计学意义(均P<0.01);2组间TC、HI的差异均无统计学意义(表4)。
2.4 3组患者治疗安全性比较
3组患者均未发生3级及以上不良反应,3组均有部分患者出现恶心呕吐、骨髓抑制和神经系统不良反应,均经对症治疗后好转。3组间不良反应发生率比较,差异均无统计学意义(表5)。
3 讨 论
脑是非小细胞肺癌最常见的转移部位之一,而一旦出现脑转移,常提示预后很差[4]。全脑放疗是多发脑转移瘤的一种有效治疗手段,可减轻患者神经系统症状,并延长生存期[5,6]。但由于正常脑组织耐受剂量的限制,转移瘤受照剂量较低,可能导致肿瘤控制不佳[7]。近年来,在全脑放疗的基础上对多发脑转移病灶(≥4个病灶)进行加量的调强放疗技术更多地应用于临床。有研究表明,序贯加量放疗使转移瘤接受较高放射剂量照射的同时增加了正常组织的受量,不良反应的发生风险增大[8]。也有研究认为同步加量可使病灶实现较高的处方剂量,并保护周围正常组织[9],但加量区内剂量均匀性可能较差,影响治疗效果。有多项研究评价了肺癌多发脑转移放疗模式的有效性、安全性和剂量学特点,但尚未取得一致结论。王珊等[10]研究结果显示,同步加量组ORR和DCR分别为75%和95%,显著高于全脑放疗组。罗庆斌等[11]研究则指出,序贯加量和同步加量疗效均较理想,不良反应发生率相仿。也有研究表明,同步加量比序贯加量显著提高疗效,改善预后[4,12,13]。因此,何为老年非小细胞肺癌多发脑转移患者的优选放疗模式值得探讨。
本研究回顾性分析了115例老年非小细胞肺癌多发脑转移(≥4个病灶)患者全脑放疗、序贯加量及同步加量放疗的有效性及安全性。结果显示,同步加量组ORR和DCR,序贯加量组和同步加量组1年的IPFS率和OS率均显著优于全脑放疗组。序贯加量组的上述指标均有低于同步加量组的趋势,但差异无统计学意义。3组均有部分患者出现恶心呕吐、骨髓抑制和神经系统不良反应,组间不良反应发生率的差异无统计学意义。3组均无3级及以上不良反应,1~2级不良反应经对症处理后恢复或改善。提示两种病灶加量放疗模式均未显著增加老年患者不良反应的发生。因此,本研究认为在对老年非小细胞肺癌多发脑转移患者的三种放疗模式中,转移瘤同步加量放疗模式的疗效较好,安全性可控,耐受性良好。
本研究对3组患者采用的放疗技术进行了分析,比较了靶区的剂量学参数。结果显示同步加量组PTV和PGTV的CN、PITV优于序贯加量组,同步加量组PTV的HI优于序贯加量组,同步加量组PGTV的HI较序贯加量组更接近于0,提示同步加量与序贯加量相比,能取得更优的靶区适形度、处方剂量覆盖度和均匀度,具有剂量学优势,说明同步加量计划能更好地保证靶区剂量,并减少正常组织受量。序贯加量组PTV的TC优于全脑放疗组和同步加量组,PGTV的TC有高于同步加量组的趋势,显示了序贯加量组的靶区覆盖度较高,且与全脑放疗组相比,序贯加量组能延长患者远期生存时间。全脑放疗组PTV的CN、PITV优于序贯加量组,HI高于两个加量组。因为全脑放疗计划较为简单,所以尽管更多地使用了IMRT技术,仍能达到较好的适形度、处方剂量覆盖度和均匀度,但由于受正常组织耐受剂量的限制,转移瘤照射剂量低,显著影响了全脑放疗的疗效。
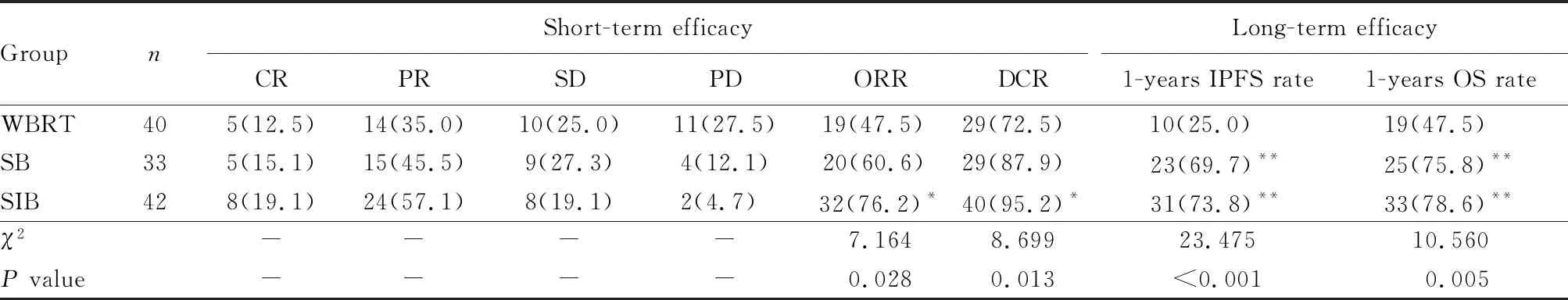
表2 3组患者近期及远期疗效比较
表3 3组PTV的剂量学参数比较
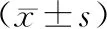
表4 2组PGTV的剂量学参数比较
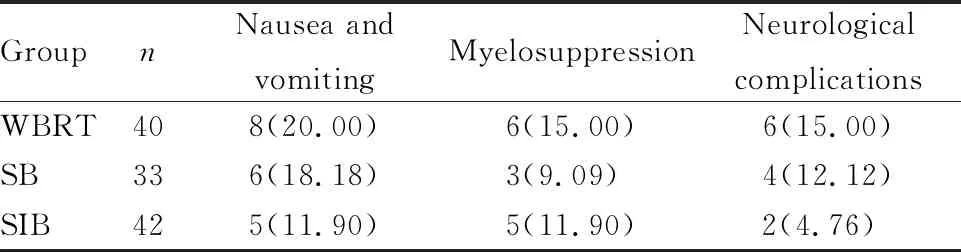
表5 3组放疗不良反应发生情况比较
多项研究表明,VMAT与IMRT相比具有靶区内剂量分布更优、靶区适形度和均匀度更好、放疗时间较短的特点,有利于提高肿瘤剂量、降低正常组织受量,从而提高治疗的有效率[4,14]。本研究显示全脑放疗时临床医师更多地采用了IMRT技术,转移瘤加量放疗时则更愿意选择VMAT技术。VMAT技术有利于加量组患者在正常组织安全的前提下获得更高的转移瘤受照剂量,取得更好的疗效。本研究中,同步加量组和序贯加量组的ORR、DCR、1年的IPFS率和1年的OS率无显著差异,但显示了前者有高于后者的趋势。分析其原因是与序贯加量组分割剂量2.0Gy/f相比,同步加量组转移瘤获得了更高的分割剂量2.5~3.0Gy/f,生物有效剂量较高,有助于提高疗效、延长生存时间[4]。另外,同步加量组患者住院时间更短,而序贯加量组需要二次定位和计划设计,增加了患者的负担和医师的工作量。因此,我们认为对老年非小细胞肺癌多发脑转移(≥4个病灶)患者的此三种放疗模式中,全脑放疗同步加量模式可作为优选方案,采用VMAT技术可能更有利。
综上,全脑放疗联合同步加量模式可作为一般情况较好、预期生存期较长的老年非小细胞肺癌≥4个脑转移病灶患者的优选治疗方案,建议有条件的单位采用VMAT技术。但当脑转移病灶数目较多、身体状况较差、预期生存时间较短时,全脑放疗可作为低姑息治疗选择,IMRT技术即可实现满意的剂量学参数。本研究存在非随机对照研究、病例数较少及未观察远期不良反应等不足。如序贯加量组的多项疗效指标有优于全脑放疗组和劣于同步加量组的趋势,但未达到统计学意义,考虑与总样本量、尤其序贯加量组样本量较小有关。今后,我们将针对非小细胞肺癌脑转移放疗模式、晚期神经认知功能保护等方面开展大样本的随机对照研究,为临床放疗模式选择提供更有力的证据。
