利拉鲁肽联合二甲双胍对2 型糖尿病患者骨转换标志物水平、骨密度的影响
2023-05-09李琼洁
李琼洁
(河南省平顶山市第一人民医院门诊药房 平顶山 467000)
2 型糖尿病(T2DM)作为慢性代谢性疾病,发病率较高,主要病理改变为胰岛素抵抗及胰岛素分泌不足,可导致患者糖脂代谢紊乱[1]。随着T2DM 患者病情的进展,可诱发糖尿病足、微血管病变、神经病变、周围血管病变等一系列并发症,甚至造成患者失明、肾衰竭等[2]。近年来,随着研究的深入,有报道显示,T2DM 患者较健康人群更易发生脆性骨折及骨质疏松,再加上T2DM 多发于中老人群,骨质疏松发生率处于较高水平,说明糖代谢和骨代谢间可能存在一定关系[3]。因此,针对T2DM 患者的治疗除了常规控制血糖,还需要重视调节骨代谢。目前,临床多采用饮食、运动干预及口服双胍类药物为主,虽可减轻临床症状,但整体疗效一般,部分患者血糖控制不理想[4]。因此,需要联合其他药物对T2DM 患者进行治疗。利拉鲁肽属于一种小分子多肽肠促胰素,可促进胰岛素的合成及分泌,在T2DM 患者中应用效果较好[5]。鉴于此,本研究选取96 例T2DM 患者进行随机对照研究,探讨利拉鲁肽与二甲双胍联合使用对T2DM 患者骨转换标志物水平、骨密度的影响。现报道如下:
1 资料与方法
1.1 一般资料 选取2020 年4 月至 2022 年3 月于平顶山市第一人民医院接受治疗的96 例T2DM患者为研究对象,按随机数字表法分为对照组与研究组,各48 例。对照组男28 例,女20 例;年龄43~77 岁,平均(58.69±7.55)岁;合并疾病:高脂血症 20 例,高血压 25 例,冠心病 18 例;病程 3~13 年,平均 (8.92±3.44) 年;体质量指数(BMI)19~31 kg/m2,平均(26.34±2.11)kg/m2。研究组男 27 例,女21 例;年龄 41~79 岁,平均(59.24±7.83)岁;合并疾病:高脂血症22 例,高血压21 例,冠心病16 例;病程 4~15 年,平均(9.15±3.62)年;BMI 20~30 kg/m2,平均(26.14±2.01)kg/m2。两组基线资料均衡性良好(P>0.05)。本研究经医院医学伦理委员会批准(批准文号:伦理字201900166 号)。
1.2 入组标准 (1)纳入标准:符合T2DM 相关诊断标准[6];自愿参与本研究,依从性良好;年龄40~80岁。(2)排除标准:对本研究所用药物过敏;入组前6个月使用过影响骨密度、骨转换标志物水平的药物;妊娠及哺乳期妇女;入组前1 个月内使用过胰岛素、糖皮质激素类药物;合并严重心肝肾功能障碍、自身免疫性疾病、恶性肿瘤;伴有T2DM 急性并发症;合并甲亢等其他内分泌疾病及肾功能不全等。
1.3 治疗方法 两组均给予运动及饮食指导。对照组给予盐酸二甲双胍片(国药准字H31020246)治疗,口服,0.5 g/次,2 次/d。研究组在对照组基础上联合德谷胰岛素利拉鲁肽注射液(国药准字SJ20210026)治疗,皮下注射,0.6 mg/次,治疗 7 d 后提高剂量至1.2 mg/次,1 次/d。两组均治疗6 个月。
1.4 观察指标 (1)血糖水平。分别采集两组治疗前、治疗6 个月后空腹肘静脉血6 ml,离心处理后收集血清样本,分别采用葡萄糖氧化酶法、相色谱法检测空腹血糖(FPG)、餐后 2 h 血糖(2 h PG)、糖化血红蛋白(HbA1c)。(2)BMI。分别于两组治疗前、治疗6 个月后计算BMI。(3)胰岛素抵抗。采用放射免疫分析法检测两组治疗前、治疗6 个月后空腹胰岛素(FINS)水平,计算胰岛素抵抗指数(HOMA-IR)。(4)骨转换标志物。采用酶标仪检测两组治疗前、治疗6个月后Ⅰ型胶原N 端前肽(PINP)、Ⅰ型胶原端肽(β-CTX)水平。(5)骨密度。采用双能X 线骨密度检测仪对两组治疗前、治疗 6 个月后全髋、L2~4的骨密度进行测定。(6)不良反应。观察一过性低血糖、腹泻、恶心、头晕等不良反应发生情况。
1.5 统计学方法 采用SPSS23.0 软件处理数据。血糖水平、BMI、胰岛素抵抗指标、骨转换标志物水平及骨密度等计量资料以()表示,采用t检验;不良反应等计数资料以%表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血糖指标及BMI 比较 治疗前,两组血糖各项指标水平及BMI 相比,差异无统计学意义(P>0.05);治疗6 个月后,两组血糖各项指标水平及BMI 均降低,且研究组均低于对照组,差异有统计学意义(P<0.05)。见表 1。
表1 两组血糖指标及BMI 比较()
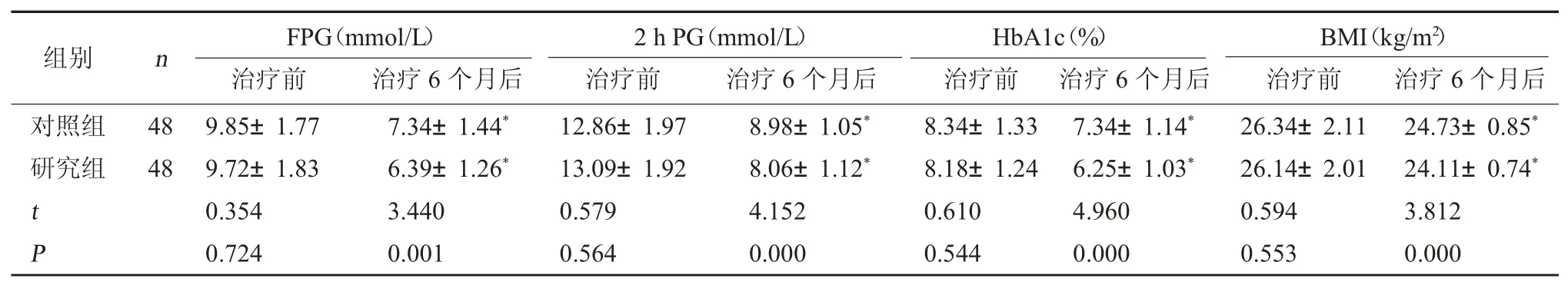
表1 两组血糖指标及BMI 比较()
注:与本组治疗前比较,*P<0.05。
BMI(kg/m2)治疗前 治疗6 个月后对照组研究组组别 n FPG(mmol/L)治疗前 治疗6 个月后2 h PG(mmol/L)治疗前 治疗6 个月后HbA1c(%)治疗前 治疗6 个月后48 48 t P 9.85±1.77 9.72±1.83 0.354 0.724 7.34±1.44*6.39±1.26*3.440 0.001 12.86±1.97 13.09±1.92 0.579 0.564 8.98±1.05*8.06±1.12*4.152 0.000 8.34±1.33 8.18±1.24 0.610 0.544 7.34±1.14*6.25±1.03*4.960 0.000 26.34±2.11 26.14±2.01 0.594 0.553 24.73±0.85*24.11±0.74*3.812 0.000
2.2 两组胰岛素抵抗指标比较 治疗前,两组胰岛素抵抗各项指标水平相比,差异无统计学意义(P>0.05);治疗 6 个月后,两组 FINS、HOMA-IR 均降低,且研究组均低于对照组,差异有统计学意义(P<0.05)。见表 2。
表2 两组胰岛素抵抗指标比较()
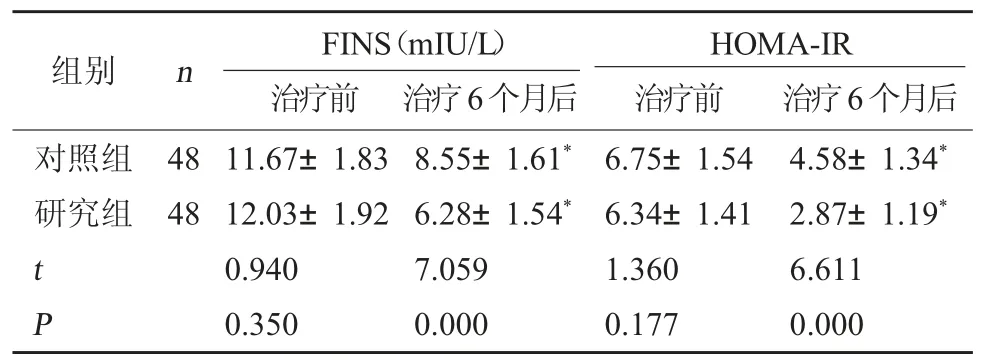
表2 两组胰岛素抵抗指标比较()
注:与本组治疗前比较,*P<0.05。
HOMA-IR治疗前 治疗6个月后对照组研究组组别 n FINS(mIU/L)治疗前 治疗6个月后48 48 t P 11.67±1.83 12.03±1.92 0.940 0.350 8.55±1.61*6.28±1.54*7.059 0.000 6.75±1.54 6.34±1.41 1.360 0.177 4.58±1.34*2.87±1.19*6.611 0.000
2.3 两组骨转换标志物水平比较 治疗前,两组骨转换标志物各项指标水平相比,差异无统计学意义(P>0.05);治疗 6 个月后,两组 PINP、β-CTX 水平均降低,且研究组均低于对照组,差异有统计学意义(P<0.05)。见表 3。
表3 两组骨转换标志物水平比较()

表3 两组骨转换标志物水平比较()
注:与本组治疗前比较,*P<0.05。
β-CTX(ng/L)治疗前 治疗6个月后对照组研究组组别 n PINP(μg/L)治疗前 治疗6个月后48 48 t P 40.23±4.15 40.64±4.31 0.475 0.636 32.84±3.24*25.65±3.12*11.090 0.000 0.78±0.12 0.75±0.10 1.331 0.187 0.52±0.08*0.31±0.06*14.549 0.000
2.4 两组骨密度比较 治疗前,两组全髋、L2~4的骨密度水平相比,差异无统计学意义(P>0.05);治疗6个月后,两组全髋、L2~4的骨密度水平均升高,且研究组均高于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组骨密度比较(g/cm3,)
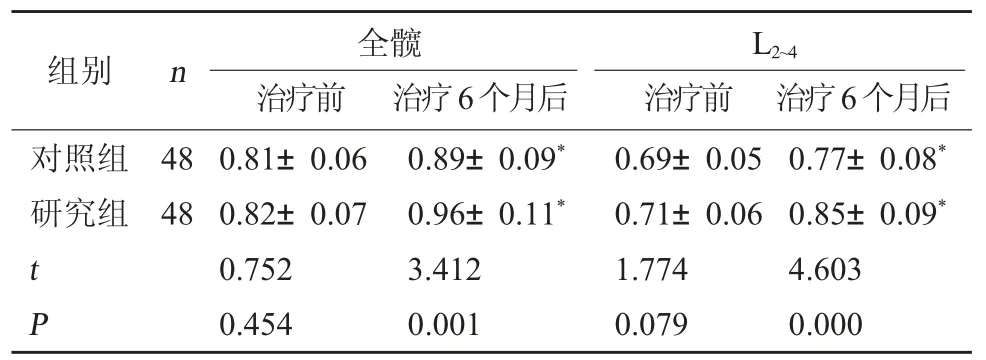
表4 两组骨密度比较(g/cm3,)
注:与本组治疗前比较,*P<0.05。
治疗前 治疗6个月后对照组研究组组别 n 全髋治疗前 治疗6个月后L2~4 48 48 t P 0.81±0.06 0.82±0.07 0.752 0.454 0.89±0.09*0.96±0.11*3.412 0.001 0.69±0.05 0.71±0.06 1.774 0.079 0.77±0.08*0.85±0.09*4.603 0.000
2.5 两组不良反应比较 两组不良反应发生率相比,差异无统计学意义(P>0.05)。见表5。
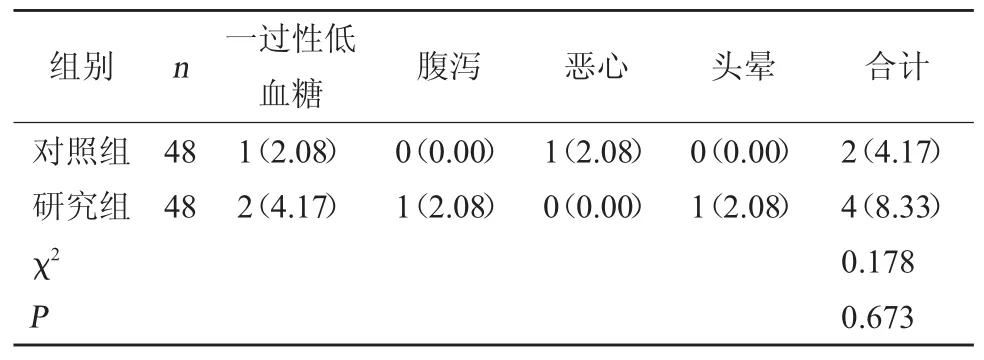
表5 两组不良反应比较[例(%)]
3 讨论
近年来,随着人们生活方式改变、生活水平提升及人口老龄化的不断进展,T2DM 发病人数不断增多,且逐渐向年轻化发展,已成为全球范围的公共卫生问题[7]。现阶段,T2DM 尚不能完成治愈,只能通过饮食控制、运动锻炼、服用降糖药物等方式控制血糖水平,减少并发症的损害[8]。二甲双胍是临床常见的降糖药物之一,可通过抑制肝肾过度的糖原异升、延缓葡萄糖由胃肠道摄取、抑制脂肪分解、提升胰岛素敏感性等作用机制,发挥降低血糖的作用[9]。虽然二甲双胍短期内降糖效果较好,但由于其不能抑制胰岛β 细胞功能下降,因此长期降糖效果不理想[10]。
本研究在二甲双胍的基础上联合利拉鲁肽对T2DM 患者进行治疗,结果显示,两组治疗6 个月后血糖各项指标水平和 BMI、FINS、HOMA-IR 均降低,且研究组均低于对照组(P<0.05),说明联合用药可有效控制患者血糖,降低体质量,抑制胰岛素抵抗,促进恢复。分析原因在于:利拉鲁肽是一种人胰高糖素样肽-1(GLP-1)类似物,可通过结合胰腺受体,促进胰岛素分泌,抑制高糖素的产生,进而使患者血糖水平下降[11]。同时,利拉鲁肽可推迟胃排空时间,进而降低患者体质量[12]。将两种药物联合用于T2DM 患者的临床治疗中,可发挥协同作用,从不同机制控制血糖,有助于临床疗效的提升[13]。
临床研究发现,T2DM 患者的脆性骨折及骨质疏松发生率明显高于血糖正常人群[14]。其原因可能是由于T2DM 患者长期处于高血糖状态,导致渗透性利尿,增加磷、钙等的排泄,降低钙磷浓度,刺激甲状旁腺激素的分泌,促进骨钙释放入血,增加骨吸收,进而增加脆性骨折及骨质疏松的发生风险[15]。相关研究发现,糖代谢和骨代谢存在相互代偿机制,人体通过增加骨吸收来调节糖代谢的平衡,当机体血糖水平上升,导致糖代谢紊乱,影响骨代谢,进而造成脆性骨折及骨质疏松的发生[16]。由此可见,有效控制患者血糖水平,对于调节骨代谢具有重要作用。通过监测骨转换标志物水平、骨密度,可及时反映机体骨代谢及骨量变化情况。PINP 是评估骨形成、成骨细胞活动的敏感性指标,当PINP 水平上升,促进骨吸收,降低成骨细胞活性,抑制骨代谢,促进骨折及骨质疏松的发生。β-CTX 多见于成熟的骨胶原中,可反映骨吸收情况。骨密度是评估骨吸收的重要指标之一,常被用于骨折、骨质疏松的临床诊治中。本研究结果显示,两组治疗6 个月后PINP、β-CTX 水平均降低,且研究组均低于对照组,而全髋、L2~4的骨密度水平均升高,且研究组均高于对照组(P<0.05),表明利拉鲁肽联合二甲双胍可有效降低T2DM 患者骨转换,增加骨密度。分析原因可能与利拉鲁肽通过与成骨细胞表面受体相结合,调节成骨细胞功能,抑制骨吸收有关。另外,本研究对用药安全性进行了比较分析,结果显示,两组不良反应发生率相比,差异无统计学意义(P>0.05),可见利拉鲁肽与二甲双胍联合用药,并未显著增加不良反应,用药安全性较好,有利于保证患者用药依从性。但本研究存在病例数量不多、来源单一等局限性,所得研究结果可能存在偏倚,因此利拉鲁肽、二甲双胍的具体作用机制及效果有待进一步深入研究。
综上所述,利拉鲁肽联合二甲双胍治疗T2DM疗效确切,可有效抑制胰岛素抵抗,控制血糖,减轻体质量,调节骨转换标志物水平,改善骨密度,且未显著增加不良反应,安全性较好。
