祛瘀化痰二仙汤对老龄高尿酸血症大鼠阴茎海绵体NLRP3 炎症小体的影响*
2023-05-09谢红金航陈兰陈智超葛平玉杨闽能
谢红 金航 陈兰 陈智超 葛平玉 杨闽能
(1 贵州中医药大学2021 级硕士研究生 贵阳 550025;2 贵州中医药大学2022 级硕士研究生 贵阳 550025;3 贵州中医药大学第一附属医院 贵阳 550001;4 贵州省德江县民族中医院 德江 565200)
据统计,全球超过1.5 亿男性受到勃起功能障碍(Erectile Dysfunction, ED)的困扰,其中年龄在40~70 岁者约占50%[1],给男性及其伴侣的生活质量造成了严重不良影响。目前已有研究明确ED 是心血管疾病的早期预警因子,两者不仅有相同的危险因素,如代谢综合征(Metabolic Syndrome, MS)、高尿酸血症、糖尿病、肥胖和缺乏运动等,也有一致的病理生理学基础。已有学者通过研究证实,在该病的诸多病理基础中,内皮功能障碍的作用不容忽视[2]。中医将ED 归为“阳痿”范畴,中医辨证论治ED 疗效确切,课题组前期研究发现中药复方祛瘀化痰二仙汤可有效保护高尿酸血症患者的血管内皮功能和勃起功能,但其作用机制尚不清楚,而尿酸诱导的损伤与无菌炎症有关。因此,本研究通过观察祛瘀化痰二仙汤对老龄高尿酸血症大鼠阴茎海绵体匀浆组织NLRP3 炎症小体和下游炎症因子以及阴茎海绵体血管内皮功能的影响,以探讨其改善勃起功能的机制。现报道如下:
1 材料与方法
1.1 动物 本研究按照贵州中医药大学实验动物伦理委员会的相关审查结果和规定进行。筛选纳入75 只18 月龄雄性SD 大鼠,无特定病原体(Specific Pathogen Free,SPF)级,平均体质量(550±20)g。由贵州医科大学实验动物中心SPF 室提供(动物生产许可证号:SCXK〈黔〉2019-0001)。
1.2 药品和试剂 参照课题组前期研究成果[3]将《妇产科学》中的经典方剂二仙汤加减化裁,得到祛瘀化痰二仙汤,药物组成:仙灵脾10 g,仙茅l0 g,薏苡仁20 g,浙贝母20 g,车前子10 g,地龙10 g。按照该药方的配伍和剂量,制成含不同浓度生药的合剂,三份合剂中,生药的浓度分别为0.324 g/ml、0.648 g/ml、1.296 g/ml。每份合剂均一次性煎制3 d 的剂量,并于4℃的环境中冷藏。其他试剂还包括酵母干粉(批号:201101-2);阿扑吗啡(美国 Sigma-Aldrich公司);氧嗪酸钾盐(批号:210112-3);盐酸乙胺丁醇片(国药准字H42022126)。核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-Binding Oligomerization Domain-Like Receptor Protein 3, NLRP3)、凋亡相关斑点样蛋白(Apoptosis-Associated Speck-Like Protein,ASC)、半胱氨酸蛋白酶 -1(Caspase-1)一抗和β-Actin 多克隆抗体(Abcam 公司);内皮素-1(Endothelin-1, ET-1)、白介素 -1β(Interleukin-1β,IL-1β)、白介素 -18(Interleukin-18, IL-18)酶联免疫吸附(ELISA)检测试剂盒和一氧化氮(Nitric Oxide,NO)试剂盒。
1.3 仪器 16 通道的生理记录仪(美国Biopac公司),MP150 型刺激电极(美国 Biopac 公司),AU680全自动生化分析仪(美国 Beckman Coulter),LG-21M 型离心机(四川蜀科仪器有限公司),电子分析天平(南通瑞科实验仪器有限公司),ASQM-4型手术解剖显微镜(中科院光电技术研究所),Mini Protean3 Cell 电泳仪(伯乐生命医学产品〈上海〉有限公司)。
2 研究方法
2.1 分组和模型制备 所有实验动物接受常规饲养方式:自由饮水,并给予普通饲料进行喂养,实验开始前适应性喂养1 周。将所有大鼠按照电脑生成的随机数字表法进行自由编号,并分为正常组(N组)、模型组(M 组)、祛瘀化痰二仙汤高、中、低剂量组(Qh 组、Qm 组、Ql 组),每组 15 只。模型制备参照本课题组前期已报道方法进行[4]。以阴茎海绵体内压 / 平均动脉压(Intracavernous Pressure/Mean Arterial Pressure,ICP/MAP)判定大鼠勃起功能。11周时模型组和祛瘀化痰二仙汤中剂量组各有1 只大鼠因灌胃及皮下注射不当导致腹腔感染死亡,最终共73 只雄性SD 大鼠造模成功。
2.2 给药 造模成功后的第2 天开始,所有实验动物每日均采用灌胃的方式在同一时间点进行给药,N 组和M 组均给予蒸馏水,两组剂量均为10ml/(kg·d);Qh、Qm、Ql 组按照大鼠体质量进行折算,并给予相应等效剂量的药液灌胃,三组剂量依次为:1.296 g/(kg·d)、0.648 g/(kg·d)、0.324 g/(kg·d),每天给予药液灌胃1 次,共12 周。
2.3 标本 完成12 周的实验后,于次日处死大鼠(颈椎脱位法),立即解剖游离出阴茎海绵体组织。组织处理的具体方法为:采用0.9%氯化钠注射液反复冲洗组织,将其表面血渍清洗干净,以滤纸反复吸干组织水分,储存于-80℃冰箱中冷冻以备后用。检测相关指标时,先将冷冻组织取出后以电子天平准确称取需要重量的组织,并研碎,与0.9%氯化钠注射液混合在冰水浴条件下进行匀浆,2 000 r/min 离心10 min,取上清液 3~4 ml 待测。
2.4 大鼠阴茎海绵体ICP/MAP 的检测 参照文献[4]所述方法,戊巴比妥钠将大鼠麻醉后,沿颈部和腹部中线切开,直至露出颈动脉和海绵体神经,在医学解剖显微镜下进行分离,注意避免周围迷走神经损伤。然后,将肝素盐水填充的导管插入动脉,并用于记录平均压力。双极电极用于刺激神经,该电极与压力传感器和电生理记录仪相连(参数:15 Hz、1.2 ms、7.5 V,共刺激1 min),记录ICP 和MAP。治疗结束后,处死大鼠,取出阴茎组织进行后续实验。
2.5 ELISA 检测大鼠阴茎海绵体组织中NO、ET-1、IL-1β、IL-18 含量 所有标准品的配制过程均严格参照说明书进行操作,加入标准品或待测样品、充分混匀静置、洗板(洗涤、印干),再加入第一抗体工作液充分混匀后静置,重复前一步的洗板过程,再加入酶标抗体工作液后静置,再次洗板,加入底物工作液后静置,最终加入终止液,混匀后检测吸光值。
2.6 Western Blot 法检测大鼠阴茎海绵体组织中NLRP3 炎性体和下游炎症因子表达 组织取出后加入裂解液进行细胞裂解,匀浆后离心,提取总蛋白,完成蛋白质浓度检测,再通过转膜缓冲液进行平衡,经膜处理、转膜等程序后,再进行免疫印迹,内参抗体浓度为β-Actin(1:2 000),之后采用二抗孵育1 h[抗体浓度为免疫蛋白 G(IgG),1:5 000 配制],洗膜,最终显色所获条带使用ImageJ 1.51K 软件分析。
2.7 统计学方法 数据采用SPSS23.0 软件处理,计量资料以()表示,组间比较采用单因素方差分析Bonferroni 检验方法。P<0.05 表示差异有统计学意义。
3 结果
3.1 各组大鼠尿酸 (UA)、ICP/MAP 水平 与 N 组比较,M 组大鼠阴茎海绵体组织ICP/MAP 水平显著下降(P<0.05),UA 水平则显著升高(P<0.05);与M 组比较,Qh 组大鼠阴茎海绵体组织ICP/MAP水平均显著升高(P<0.05),UA 水平则显著降低(P<0.05)。见表 1。
表1 实验大鼠UA、阴茎海绵体组织ICP/MAP 比较()

表1 实验大鼠UA、阴茎海绵体组织ICP/MAP 比较()
注:与 M 组比较,*P<0.05。
组别 n UA(μmol/L) ICP/MAP Ql 组Qm 组Qh 组M 组N 组15 14 15 14 15 498.13±84.44 476.13±74.24 469.13±73.44 512.34±72.46 90.84±8.53 0.29±0.021*0.39±0.026*0.54±0.037*0.26±0.034 0.78±0.051
3.2 各组大鼠 NO、ET-1 水平 与 N 组比较,M 组大鼠阴茎海绵体组织NO 水平显著降低(P<0.05),ET-1 水平显著升高(P<0.05);与 M 组比较,Qh 组海绵体组织 NO 水平显著升高(P<0.05),ET-1 水平显著降低(P<0.05)。见表2。
表2 实验大鼠阴茎海绵体组织血管内皮功能指标比较()
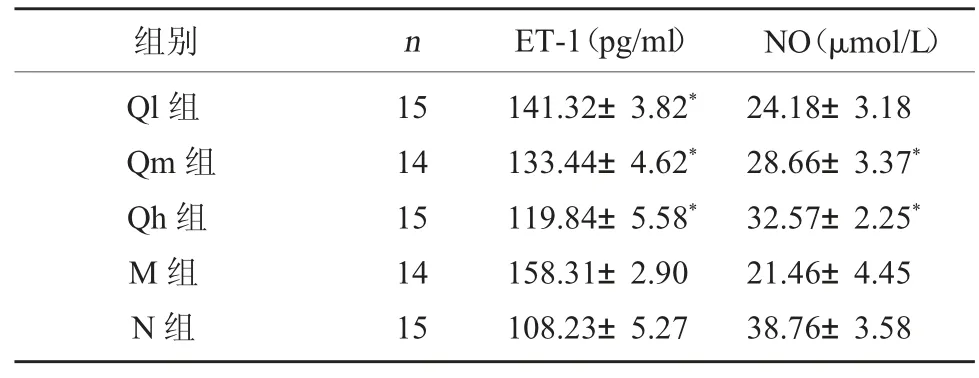
表2 实验大鼠阴茎海绵体组织血管内皮功能指标比较()
注:与 M 组比较,*P<0.05。
组别 n ET-1(pg/ml) NO(μmol/L)Ql 组Qm 组Qh 组M 组N 组15 14 15 14 15 141.32±3.82*133.44±4.62*119.84±5.58*158.31±2.90 108.23±5.27 24.18±3.18 28.66±3.37*32.57±2.25*21.46±4.45 38.76±3.58
3.3 各组大鼠IL-1β、IL-18 水平 与N 组比较,M组大鼠阴茎海绵体组织IL-1β、IL-18 水平显著升高(P<0.05);与M 组比较,Qh 组大鼠阴茎海绵体组织 IL-1β、IL-18 水平均显著降低(P<0.05)。见表3、图1。
表3 实验大鼠阴茎海绵体组织IL-1β、IL-18 表达比较(pg/ml,)
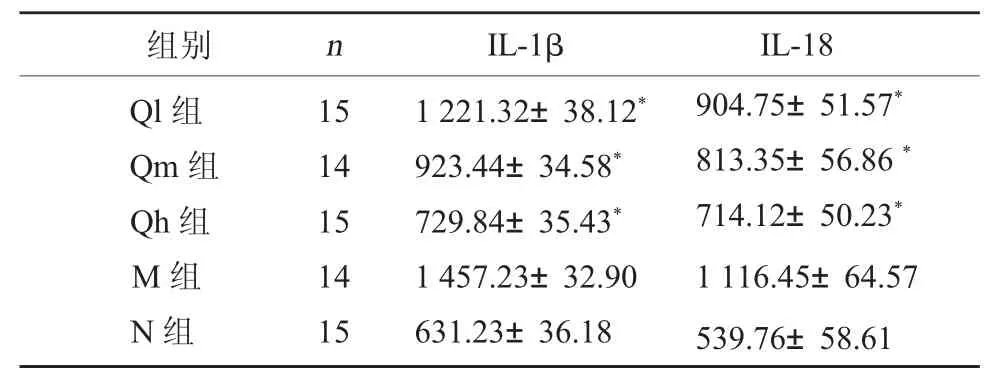
表3 实验大鼠阴茎海绵体组织IL-1β、IL-18 表达比较(pg/ml,)
注:与 M 组比较,*P<0.05。
组别 n IL-1β IL-18 Ql 组Qm 组Qh 组M 组N 组15 14 15 14 15 1 221.32±38.12*923.44±34.58*729.84±35.43*1 457.23±32.90 631.23±36.18 904.75±51.57*813.35±56.86 *714.12±50.23*1 116.45±64.57 539.76±58.61

图1 各组大鼠阴茎海绵体组织 NLRP3、ASC、Caspase-1、IL-1β、IL-18水平
3.4 各组NLRP3 炎性体蛋白水平 与N 组比较,M 组大鼠阴茎海绵体组织NLRP3 炎性体蛋白三项指标 NLRP3、ASC、Caspase-1 水平均显著升高(P<0.05);与M 组比较,Qh 组大鼠阴茎海绵体组织NLRP3、ASC、Caspase-1 水平均显著降低(P<0.05)。见图 1、表 4。
表4 实验大鼠阴茎海绵体组织NLRP3 炎性体蛋白水平比较()

表4 实验大鼠阴茎海绵体组织NLRP3 炎性体蛋白水平比较()
注:与 M 组比较,*P<0.05。
组别 n NLRP3 ASC Caspase-1 Ql 组Qm 组Qh 组M 组N 组15 14 15 14 15 0.62±0.03*0.44±0.03*0.31±0.01*0.78±0.03 0.20±0.02 0.51±0.02*0.40±0.06*0.28±0.01*0.59±0.08 0.16±0.01 0.45±0.11*0.36±0.09*0.24±0.05*0.58±0.13 0.18±0.04
4 讨论
阴茎勃起功能由多种刺激而引起,这些刺激可导致神经释放NO,从而扩张血管,促进血液流向勃起组织,而ED 的发生可由多种病因所引起,ED 本质上为一种全身性血管疾病。UA 水平的异常升高可激活炎症反应,从而损伤机体血管内皮功能,导致相关并发症的发生[5~6]。高尿酸可直接抑制海绵体平滑肌舒张功能,破坏血管内皮源性舒张因子(EDRF)/NO 与血管内皮素(ET)的动态平衡,导致阴茎海绵体血管及平滑肌细胞(SMC)收缩功能失调,从而导致ED[7]。课题组前期研究发现高尿酸血症ED 患者的血浆ET-1 水平较高而血浆NO 水平降低,其血管内皮功能存在异常[3]。同时,高尿酸血症ED 患者阴茎海绵体动脉收缩期最大流速(PSV)、舒张末期血流速度(EDV)降低,阴茎血管阻力指数(RI)、阴茎血流指数(PFI)升高,阴茎海绵体的血流动力学改变与血管内皮功能损伤有关[8],同时中药可通过保护血管内皮功能进而改善高尿酸血症患者的勃起功能[9]。
尿酸诱导的损伤与无菌炎症有关,尿酸盐结晶可通过激活补体经典代谢途径等激活免疫系统,从而引发炎症反应,同时还可增加活性氧的产生,而该物质已被多项研究证实可刺激NLRP3 炎性小体发挥生物学效应,而IL-1β 前体原本并无生物学活性,在已被激活的NLRP3 炎性小体的剪切后,IL-1β 则成为多种代谢性疾病发生发展的重要因子,可引起血管内皮功能异常,与血管病变的发病机制相关[10]。本研究根据课题组前期研究成果,制备高尿酸ED大鼠模型[4],研究发现模型组大鼠阴茎海绵体组织NLRP3 炎性体相关蛋白水平和炎症细胞因子水平明显升高。本研究还检测了阴茎海绵体组织NO 和ET-1 等血管内皮功能指标,结果显示,高尿酸ED大鼠阴茎海绵体组织ET-1 水平较高而NO 水平较低,其血管内皮功能存在异常,这与NLRP3 介导的炎症反应有关。本研究结果与之前的几项研究结果大体一致,氧化应激及炎症反应介导血管内皮细胞功能损伤,结构发生改变[11],对阴茎海绵体血窦的开放造成影响,引发ED[12]。
中医学坚持“整体观”和“辨证论治”理论,采用中药辨证组方治疗ED 拥有其独特的疗效。高尿酸ED 属于中医学“尿酸浊并阳痿”范畴,课题组前期研究成果认为,痰瘀阻滞在该病的发生与发展过程中占主要地位,痰瘀日久入络,血脉瘀塞,肆虐为患,入脏则穷极及肾,终致肾阳亏虚,是该病的核心病机[13]。基于病机,提出“化痰祛瘀补肾”的治则,并以经方二仙汤为基础,结合文献研究中药治疗高尿酸血症的组方常以清热利湿、健脾补气、散结化瘀为主[14],化裁拟定“化痰祛瘀二仙汤”。方以仙灵脾(又称为淫羊藿)、仙茅补肾壮阳除湿,薏苡仁健脾除湿,车前子利水祛痰为主,配伍浙贝母化痰散结,地龙祛瘀通络。现代药理研究认为薏苡仁、车前子可通过改善肠道菌群结构,影响宿主健康,降低UA[15~16];淫羊藿是中医治疗方中常用的补益之品,具有一定抗炎作用,淫羊藿苷可快速由肠道相关菌群代谢为主要活性单体成分淫羊藿次苷Ⅱ[17],而该成分可有效维持勃起功能[18]。本研究结果与谭树聪[19]研究结果大体一致,经过祛瘀化痰二仙汤治疗后ICP/MAP 升高,大鼠勃起功能得到恢复,阴茎海绵体匀浆组织ET-1 水平降低,NO 水平升高;且伴随有阴茎海绵体匀浆组织NLRP3 炎性体相关蛋白水平和细胞因子IL-1β、IL-18 水平降低[20]。
综上所述,祛瘀化痰二仙汤可有效减轻高尿酸血症ED 大鼠阴茎海绵体血管内皮功能损伤,从而改善勃起功能,其原因可能与方中药物抑制了阴茎海绵体组织中NLRP3 炎症小体介导的炎症反应有关。
