组织学绒毛膜羊膜炎及其分期与胎龄<34周早产儿结局关系的研究
2023-05-09陈秋霞汪洪林张林静黄赞怡赵振东
陈秋霞,汪洪林, 张林静,黄赞怡,赵振东
绒毛膜羊膜炎(chorioamnitis,CAM)是指由病原微生物入侵引起胎盘绒毛膜和羊膜炎症,导致宫内感染,是导致早产发生的重要原因,其可增加新生儿脑损伤、感染及死亡风险,严重危及孕妇及新生儿生命健康[1]。CAM分为临床绒毛膜羊膜炎(clinical chorioamnionitis,CCA)和组织学绒毛膜羊膜炎(histology chorioamnitis,HCA),两者占比约为1∶9。其中HCA发病隐匿,临床仅表现为胎盘病理学检查阳性,易漏诊[1-2]。近年研究表明,CAM与约1/3早产的发生及免疫功能紊乱密切相关,表明CAM和胎膜早破后感染是引起围产儿发病、死亡的重要原因[3]。HCA能够刺激胎儿发生免疫应答,引起体内炎症反应,导致早产及胎膜早破的发生[4]。研究显示,HCA阳性孕妇发生早产的风险是非HCA孕妇的2倍[2,5]。CAM可导致新生儿脑、肺、眼等多种器官损伤及呼吸窘迫综合征(respiratory distress syndrome,RDS)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、新生儿坏死性小肠结肠炎(necrotizing enterocolitis of newborn,NEC)、败血症等不良结局的发生,甚至引起早产儿死亡[6]。因此,本研究拟探究HCA与胎龄<34周早产儿结局的关系及HCA分期与早产儿不良结局的相关性,期望为临床诊治提供帮助。
1 资料与方法
1.1 研究对象
回顾性选取2019年6月至2021年8月在海南省妇女儿童医学中心分娩的128例胎龄<34周早产儿及其母亲作为研究对象,根据胎盘病理检查结果分为HCA阳性(+)组87例和HCA阴性(-)组41例;根据HCA分期标准分为HCA早期组(40例)、中期组(30例)、晚期组(17例)和非HCA组(41例)。
纳入标准:胎龄<34周,单胎活产;孕妇均行胎盘常规病理检查;出生后转入新生儿科治疗;临床病例资料完整。排除标准:CCA;呼吸系统、神经系统及中枢神经系统畸形早产儿;合并遗传代谢性疾病、染色体畸形或先天性发育异常;临床资料不全等。本研究获得医院伦理学委员会批准,患者及家属均签署知情同意书。
1.2 诊断方法
1.2.1 胎盘病理诊断 待胎儿娩出后常规取完整胎盘,送病理科行肉眼观察和切片检查。取邻近胎膜破口处10 cm×10 cm胎盘胎膜组织,10%甲醛固定,石蜡包埋切片,苏木精-伊红染色,由较高资历病理科医师进行诊断。
1.2.2 HCA分期诊断 以镜下中性粒细胞浸润绒毛膜、胎膜及羊膜为分期诊断标准[7]。早期:镜下见中性粒细胞浸润平滑绒毛膜的滋养细胞或绒毛板下纤维蛋白;中期:镜下见中性粒细胞浸润绒毛板和(或)胎膜绒毛和(或)羊膜;晚期:镜下见中性粒细胞固缩坏死,羊膜基膜增厚或呈嗜酸性,出现局灶性羊膜坏死。
1.3 资料收集
查阅电子病历或资料,收集入组早产儿及孕母相关临床资料,孕母资料包括年龄、孕次、产次、妊娠期高血压疾病、妊娠期糖尿病、胎膜早破、产前抗生素和糖皮质激素使用情况及胎盘病理结果等。早产儿资料包括胎龄、出生体重、出生后 1 min Apgar评分、是否剖宫产及新生儿窒息、出生时复苏、围生期死亡、羊水污染、产后实验室感染指标[白细胞计数(white blood cells,WBC)、降钙素原(procalcitonin,PCT)及中性粒细胞百分比]及生后不良结局[RDS、BPD、NEC、脑室内出血(intraventricular hemorrhage,IVH)、脑室周围白质软化(periventricular leukomalacia,PVL)、新生儿早发型败血症(early-onset sepsis,EOS)、晚发型败血症(late onset sepsis,LOS)]和出生后存活情况等。脑损伤诊断参照《早产儿脑损伤诊断与防治专家共识(2012版)》[8],早产儿相关疾病诊断均参照《实用新生儿学(第5版)》[9]。
1.4 统计学方法
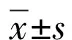
2 结果
2.1 HCA(+)组和HCA(-)组早产儿及孕妇临床资料比较
HCA(+)组胎膜早破率、孕妇产前抗生素使用率高于HCA(-)组(P<0.05);两组孕妇在年龄、孕次、产次、产前糖皮质激素使用率、妊娠期高血压及妊娠期糖尿病等方面差异无统计学意义(P>0.05)。HCA(+)组早产儿胎龄、出生体重低于HCA(-)组(P<0.05);两组早产儿在1 min Apgar评分、剖宫产率、羊水污染、新生儿窒息及出生时复苏方面差异无统计学意义(P>0.05)。详见表1。

表1 HCA(+)组和HCA(-)组早产儿及孕妇临床资料比较[例
2.2 不同分期HCA亚组与非HCA组早产儿感染指标比较
HCA组早产儿生后1天WBC、PCT水平及中性粒细胞百分比较非HCA组明显升高,且随着HCA分期增高,PCT及中性粒细胞百分比逐渐升高,差异有统计学意义(P<0.05);各组CRP水平变化差异无统计学意义(P>0.05)。详见表2。

表2 不同分期HCA亚组与非HCA组早产儿感染指标比较
2.3 不同分期HCA组与非HCA组早产儿不良结局比较
HCA组早产儿RDS总发生率低于非HCA组,NEC、BPD、EOS、PVL总发生率高于非HCA组,差异有统计学意义(P<0.05);HCA早、中期组RDS发生率与非HCA组差异有统计学意义(P<0.05);HCA晚期组NEC发生率与非HCA组差异有统计学意义(P<0.05);HCA中、晚期组BPD、EOS、PVL发生率与非HCA组差异有统计学意义(P<0.05);各组LOS、IVH发生率及围生期死亡率差异无统计学意义(P>0.05)。详见下页表3。

表3 不同分期HCA组与非HCA组早产儿不良结局比较[例(%)]
2.4 HCA分期与RDS、BPD、PVL严重程度的相关性分析
Spearman等级相关分析显示,HCA分期与RDS严重程度呈负相关(r=-0.290,P<0.05),与PVL严重程度呈正相关(r=0.473,P<0.05),与BPD严重程度未见明显相关性(r=0.102,P>0.05)。详见下页表4、5、6。
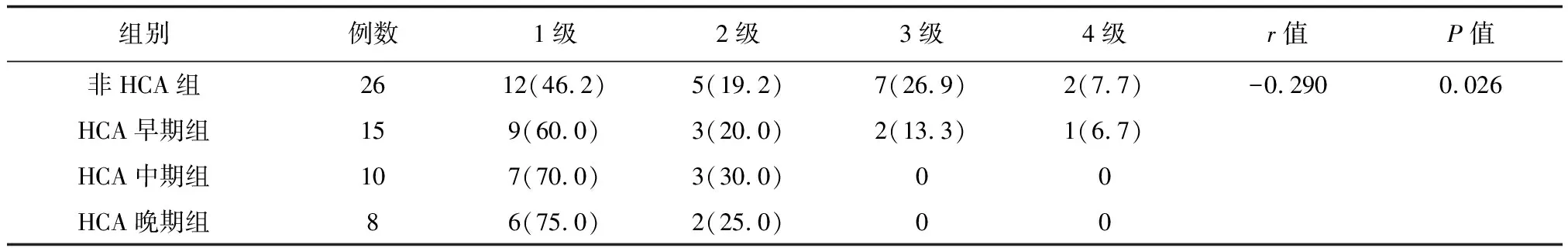
表4 HCA分期与RDS严重分级的相关性[例(%)]
3 讨论
CAM是宫内感染的主要表现形式,以HCA为主,相关研究证实其与胎膜早破互为因果关系,是导致早产的主要原因[2]。据报道,超过1/4的早产是由宫内感染引起,妊娠30周前分娩大多与CAM有关,胎龄越小其发病率越高[10-11]。研究指出,CAM可导致新生儿RDS、BPD、脑损伤等不良结局的发生,也会引起产后出血、产后子宫内膜炎及败血症等严重的产妇并发症,甚至导致母婴死亡[2,5]。因此,探究CAM与早产儿不良结局的关系临床意义显著。

表5 HCA分期与BPD严重程度的相关性[例(%)]

表6 HCA分期与PVL严重程度的相关性[例(%)]
研究显示,胎龄<34周早产儿HCA发生率较多,晚期早产儿各系统发育较为成熟,不良并发症发生率较低,结局较早中期早产儿好[12]。因此,本研究选择胎龄<34周早产儿作为研究对象,以孕妇胎盘病理结果为依据,回顾性分析母婴临床资料发现,<34周早产儿中HCA阳性87例,发生率为68.0%。结果显示,HCA(+)组早产儿胎龄、出生体重低于HCA(-)组,与研究报道的随着胎龄增大,HCA阳性检出率降低相符,提示HCA是诱发早产的主要因素。胎膜早破是CAM的并发症,早产中发病率约为30%左右[11],而本研究中HCA(+)组孕妇胎膜早破率为65.5%,明显增高,分析原因可能是研究纳入均为<34周龄早产儿。研究报道,HCA可使胎膜防御能力和局部结构损伤,在受到各种诱因刺激时胎膜会发生破裂,而胎膜早破可诱发HCA,随着破膜时间延长,HCA发生率增加[4]。有关胎膜早破的研究也表明,胎盘破膜时间与HCA分期/分级呈显著正相关,<32周胎膜早破及破膜潜伏期为18~168 h是HCA发生的危险因素,分析可能是破膜时间延长增加了孕妇阴道上行性感染的概率,引起胎盘、胎膜感染;同时羊水可以阻止病原菌入侵,减少感染发生,但随着破膜时间延长,羊水减少,感染风险增加,HCA程度加重[13-14]。另外,对于胎龄<34周早产儿发生胎膜早破,在无继续妊娠禁忌证后,多予以积极使用药物以保护胎儿神经治疗、促进胎儿肺脏成熟、警惕感染的发生,故导致孕妇产前抗生素使用率明显增高。此外还发现,HCA组早产儿生后1天WBC、PCT、中性粒细胞百分比等炎症感染指标较非HCA组明显升高,且随胎盘炎症浸润程度增加,PCT、中性粒细胞随HCA分期的增加逐渐升高存在差异,而HCA组和非HCA组早产儿CRP水平变化组间差异无统计学意义。综合分析HCA发生引起宫内感染,病原微生物刺激激活胎儿免疫系统导致炎症级联反应发生,引起大量炎症细胞因子释放。据有关报道,孕妇产前感染指标WBC、CRP等水平变化在CAM分级分组中存在显著差异,指标水平越高预示着宫内感染风险越大,可反应CAM孕妇胎盘炎症浸润程度[15]。
本研究结果提示HCA早产儿也存在炎性反应,与母体胎盘炎症浸润程度关系密切,因此应警惕HCA等宫内感染的发生,以重视早产儿炎症的发生。
宫内感染与新生儿多种疾病的发生关系密切,可导致早产儿多种不良结局,如新生儿RDS、BPD、NEC、脑损伤及败血症等:
(一)RDS是早产儿常见的呼吸系统疾病,30~31周龄早产儿RDS发生率为57%,宫内感染可促进胎肺成熟,降低新生儿RDS发生率,其发病率与胎龄呈负相关[16]。研究报道,HCA阳性早产儿RDS发生率较低,CAM能够调节肺张力,促进胎儿肺成熟,降低RDS发生,炎症可能通过促进肺泡表面活性物质的生成进而减少RDS发生风险[17-18]。本研究显示,HCA组早产儿RDS总发生率明显低于非HCA组,且HCA早中期组RDS降低明显,晚期组差异无统计学意义,分析可能与严重的炎症引起胎儿肺脏损伤,致其肺泡表面活性物质灭活有关;HCA分期与RDS严重程度呈负相关,提示适当的HCA对胎龄<34周早产儿RDS发生具有保护作用,可降低其发生率。
(二)BPD是多因素相关疾病,宫内感染、氧损伤、肺发育不成熟等均可导致早产儿发生严重肺损伤[19]。研究认为CAM导致早产儿BPD是宫内感染引起炎症因子释放加剧肺脏炎症反应,从而通过阻碍肺泡发育、加速肺组织纤维化,导致BPD[20-21]。多项研究也表明,HCA可增加BPD风险,<34周早产儿其胎盘炎症加重,BPD发生增加[22]。本研究显示不同分期HCA组BPD发生率均明显较非HCA组增高,与研究报道一致;HCA分期与BPD严重程度未见显著相关性,可能因研究为单中心、样本量较小及BPD发生例数较少有关,HCA与BPD的关系仍应进一步探究。
(三)早产是导致NEC的重要原因之一,炎症介质会刺激肠黏膜上皮细胞信号转导及基因转录,诱导细胞凋亡,增大肠黏膜通透性,促进炎症级联反应,诱发NEC[23]。且研究报道,早产及产前炎症会影响肠道免疫和屏障功能,易使新生儿肠道免疫受损发生菌群失调,导致NEC[24]。产前CAM也被认为是NEC发生的风险因素[25]。而本研究纳入<34周早产儿,分析发现HCA晚期组NEC发生率明显高于非HCA组,总发生率与非HCA组组间差异有统计学意义,与相关报道一致,提示HCA造成宫内感染引起多种炎性介质释放,促进炎性联级反应,会增加<34周早产儿产后NEC发生风险,临床应重视早产产妇胎盘病理的检查及诊断。
(四)脑损伤是导致早产儿终身神经障碍的根本原因。据文献报道,HCA导致脑损伤的原因:一是HCA发生时胎盘血流减少引起胎儿脑组织缺血缺氧性损伤;二是HCA导致炎症因子释放增加影响脑白质病变和髓鞘损伤,通过介导NO和细胞毒性等破坏了脑神经细胞[26]。研究表明,宫内感染引起血管炎症因子释放会影响血脑屏障,引起血管内皮细胞粘附、聚集、凝血功能障碍,增加颅内出血风险[27]。本研究综合围产期因素后发现,不同分期HCA组IVH发生率与非HCA组差异无统计学意义,但PVL总发生率及HCA中晚期组发生率高于非HCA组,与高奥会等[28]研究近似;HCA分期与PVL严重程度呈正相关性,表明HCA与<34周早产儿脑损伤关系密切,因此强调早产儿出生后脑损伤早期预防的重要性。
(五)研究表明暴露于CAM的早产儿出生后EOS发病率明显增高,与HCA抑制胎儿免疫系统,肺部免疫细胞反应性降低,产后微生物入侵导致胎儿抵抗力下降有关[29]。且有研究报道,HCA早产儿EOS发生率是非HCA早产儿的4.5倍,EOS多为母体病原菌垂直传播,侵入羊膜腔后可直接通过胎儿消化道、呼吸道、泌尿生殖道等进入胎儿体内,经破损黏膜进入血液[2,30]。本研究不同分期HCA组EOS发生率均明显增高,而LOS发生率组间差异无统计学意义。由此可见,暴露HCA的<34周早产儿其出生后RDS风险降低,BPD、EOS和PVL等不良结局发生风险增大,所以应加强HCA对早产儿出生后不良结局的早期预防。不同分期HCA组早产儿生后死亡率及总死亡率增加与非HCA组差异无统计学意义,与Han X等[1]研究报道的HCA(+)组早产儿死亡率明显高于HCA(-)组相悖,可能与纳入例数及纳入对象不同等有关。考虑本研究纳入例数有限,且为单中心分析探究, HCA对<34周早产儿结局的影响仍需通过更多前瞻性、多中心研究来进一步补充证实。
综上所述,存在HCA的<34周早产儿随着胎盘炎症浸润程度越深,其炎症程度加重;HCA降低了早产儿RDS发生率,增加了BPD、EOS、PVL发生率,且与RDS、PVL严重程度呈现相关性,可用于评估早产儿预后;HCA对早产儿NEC、LOS及死亡等不良结局的发生无显著影响。
