光热疗法在宫颈癌治疗临床前基础研究中的应用
2023-05-09杜仲努尔尼沙阿力甫王蕾马蓉衡友强朱丽君张学良马彩玲
杜仲,努尔尼沙·阿力甫,王蕾,马蓉,衡友强,朱丽君,张学良,马彩玲*
宫颈癌是常见的女性恶性肿瘤,传统的治疗方法有手术治疗、放射疗法、化学疗法以及靶向治疗等。然而传统治疗方法仍存在一定的不良作用,是目前需要攻克的难题之一。作为新型抗宫颈癌的方法,光热疗法(photothermal therapy,PTT)凭借其较少的不良作用和较高的治疗效率备受关注。本文对目前基于PTT的宫颈癌治疗方式在临床前的典型基础研究进行了总结探讨和展望。
1 宫颈癌治疗方式与光热疗法
在全球范围内,宫颈癌是女性癌症中仅排在乳腺癌之后的常见癌症[1]。2011年至2020年,宫颈癌的世界标准化年龄发病率和死亡率每年分别为(26.3~27.4)/100万和(16.6~18.0)/100万[2]。宫颈癌的传统治疗方式主要根据宫颈癌的分期、分型,以及患者的个人情况和妊娠需求来决定[3]。宫颈癌的临床分期按照国际妇产科学联合会(International Federation Gynecology and Obstetrics,FIGO)可以分为早期疾病、局部晚期疾病和晚期疾病[4]。早期疾病主要以手术治疗为主,必要时以化疗放疗结合辅助[5]。宫颈癌晚期的治疗方式主要是放疗为主,必要时结合化疗[6]。针对早期及局部晚期疾病宫颈癌,通过手术治疗或者放化疗,治疗效果较理想。但是针对晚期疾病,宫颈癌的预后较差,因此探索一种新型的宫颈癌治疗方式是目前研究的热点[7]。随着科技的进步与发展,PTT作为一种新型的抗肿瘤治疗方式引起了国内外关注[8]。
2 光热疗法的原理和影响因素
PTT是通过局部注射、血液循环、主动或者被动靶向的方式将光热材料递送至肿瘤部位富集,这种靶向肿瘤的聚集使得PTT能选择性地破坏肿瘤细胞而降低对正常细胞的毒性[9]。用激光辐照肿瘤部位,光热材料吸收光能转化为热能,通过热消融使肿瘤细胞出现损伤,从而导致肿瘤细胞凋亡[10]。因此,光源和光热材料是影响PTT效果的主要因素。
光源的波长可按照波段分为可见光和近红外光。常用的可见光(包含450 nm~750 nm)波段内的光,因其波长比较短,散射比较大,并受到来自生物样品的自发荧光影响[11]。而近红外光,由于波长更长,其在生物组织内传播时的散射及自荧光影响比较小,能够实现生物体内更深部位的有效探测[12],因此近红外区的光源在PTT中备受关注[13]。光源主要依靠半导体激光器产生,激光器可重复使用,寿命较长。在未来,多个患者可以使用同一激光器,成本较低。患者疾病负担和经济压力较小。
另一重要的因素,光热材料对高效PTT也起着关键的影响作用,筛选具有高光热转化效率和生物安全性的光热材料是目前国内外PTT研究的重要挑战[14]。在探索宫颈癌PTT的研究中,许多光热材料被开发和使用以达到更好的PTT效果,如表1中无机材料类的金纳米颗粒[15]和三氧化二铁纳米颗粒[16]等,它们在宫颈癌PTT中展现了出色的光热稳定性和较高光热转化效率。随着纳米技术的发展,光热材料实现了从无机到有机的转变[17]。有机光热材料中的吲哚菁绿作为光热材料被广泛应用[18]。吲哚菁绿是美国食品与药物监督局(Food and Drug Administration,FDA)批准的用于血管造影的临床显影剂,其生物安全性得到了临床认证[19]。但吲哚菁绿光热稳定性较差和体内循环时间较短限制了其在生物医学中的进一步应用,各种纳米载体被用于封装吲哚菁绿来提高它的光热性能或稳定性[20]。
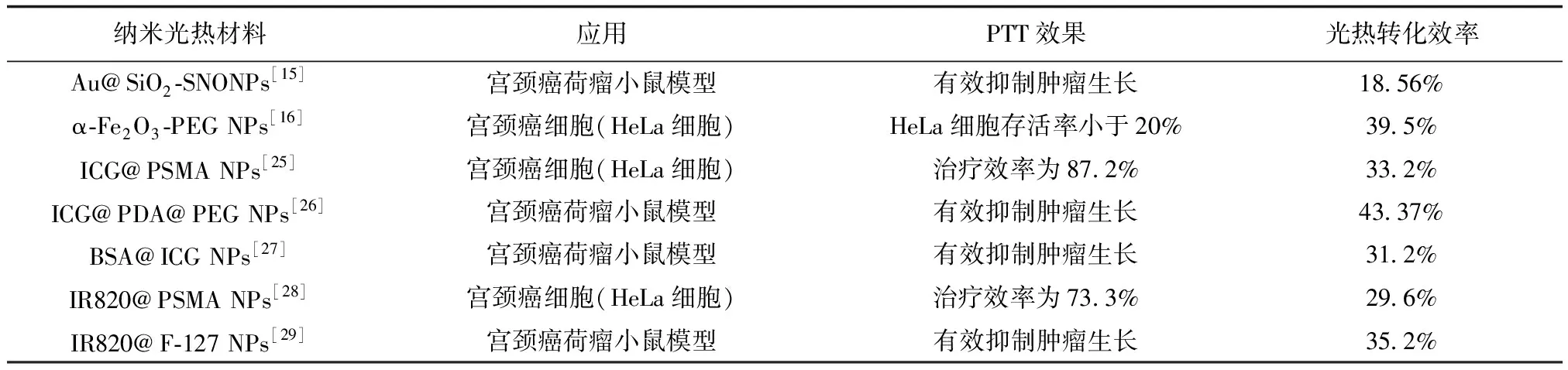
表1 几种典型的光热剂辅助的PTT在宫颈癌治疗临床前研究中的应用举例
PTT能够特异性修饰纳米载体,将靶标与光热材料进行生物化学方式结合,将光热材料特异性靶向到肿瘤部位,并在肿瘤部位聚集,有效减少对正常细胞的损伤,减少不良作用,有助于中长期消除肿瘤和控制肿瘤继续生长[21]。另外PTT实施方便,短期内可以重复实施并不会产生耐药性,间隔时间可以很短[22]。除此之外,根据临床前肿瘤动物模型研究显示,PTT对于远处转移肿瘤也有较好的抑制效果[23]。与传统治疗方式相比,PTT精准而有效的癌症治疗方法有望突破包括化疗、放疗和手术等传统癌症疗法的局限[24]。
3 光热疗法在宫颈癌治疗临床前研究中的应用
在聚苯乙烯-马来酸酐修饰吲哚菁绿的宫颈癌PTT研究中,通过对宫颈癌细胞(HeLa细胞)的干预,证实能通过热诱导使HeLa细胞出现凋亡,在宫颈癌PTT的细胞水平层面取得了较理想的结果[25]。在聚多巴胺修饰吲哚菁绿的研究中,在细胞水平以及动物模型展现了宫颈癌PTT的出色效果[26]。另外利用白蛋白修饰吲哚菁绿结合化疗药物阿霉素的PTT联合化学疗法的研究,在宫颈癌荷瘤小鼠模型中展现出了出色的靶向肿瘤能力和抗肿瘤能力,为宫颈癌PTT联合化学疗法的临床前研究打下了坚实的基础[27]。除此之外,基于同为近红外花菁染料类型中的新吲哚菁绿的宫颈癌细胞显微成像和宫颈癌细胞PTT研究,在细胞水平展示了出色的抗肿瘤效果[28]。在宫颈癌临床前动物模型的PTT研究中,同样展现了良好的抗肿瘤能力[29]。
尽管目前PTT在宫颈癌治疗方式上提供了新的方法,但是应用于临床还需要较长时间。其中,光热材料的选择是一个非常重要的因素,目前许多光热材料仍处于研究阶段,生物安全性尚未得到证实。在保证生物安全性的同时,还需要保证PTT的治疗效果。另外光热材料如何靶向到达肿瘤部位也是需要探索的一个难题。这些是未来PTT走向宫颈癌临床治疗的诸多挑战。目前许多研究应用于临床前动物模型,但是人体内微环境与动物之间相差较大,不能充分代表人体的真实反应,在动物层面实现的治疗效果可能无法在人体实现。
4 光热疗法与联合疗法在宫颈癌治疗中的应用
随着宫颈癌治疗的不断进展,PTT联合其他不同的治疗方法成为了目前的新型治疗方式,协同治疗可以发挥每种治疗方式的优点,从而产生协同效应[30]。PTT联合光动力疗法(photodynamic therapy,PDT)在宫颈癌临床前基础研究中,半导体聚合物在经过亲水性聚乙二醇修饰后,表现出了强大的抗宫颈癌细胞能力,在动物模型中也展示了出色的抗肿瘤能力[31]。另外PTT联合化学疗法在宫颈癌临床前基础研究中,一种新型的生物相容性和可生物降解的金属有机框架(metallic organic framework,MOF),通过在金纳米道路上生长结晶沸石咪唑盐框架而构建,将化疗药物多柔比星加载到这个纳米材料上。在近红外激光或弱酸性环境下,在肿瘤部位按需释放药物。更重要的是,在近红外激光照射下,由于PTT和化疗的协同效应,在体外细胞实验和体内荷瘤裸鼠模型中都实现了高效的癌症治疗[32]。
PTT联合免疫疗法可以激活全身免疫,借助PTT过程中产生的热量改善肿瘤微环境中免疫细胞的抗肿瘤免疫功能,可激活免疫细胞发生肿瘤免疫反应,从而发挥协同抗肿瘤作用。光热免疫治疗杀死残留或转移性肿瘤,通过免疫记忆细胞的产生来预防癌症复发。这种基于纳米材料的PTT可以直接消除肿瘤并诱导持续免疫反应的抗肿瘤治疗方式,称为光热免疫疗法[33]。其中包含PTT联合免疫佐剂的使用。免疫佐剂是一类在免疫反应中起辅助或增强作用的物质。当基于纳米材料的PTT与免疫佐剂结合时,它可以触发免疫反应,促进免疫细胞在肿瘤部位的富集和浸润。这种作用不仅可以抑制原发性肿瘤的复发,而且可以抑制或根除转移性肿瘤[34]。在PTT联合免疫佐剂应用于宫颈癌临床前基础研究中,纳米复合材料联合免疫佐剂胞嘧啶鸟嘌呤寡脱氧核苷酸的协同作用下,在体内荷瘤裸鼠模型实现了高效的治疗[35]。另外PTT联合免疫检查点抑制(immune checkpoint blockade,ICB)也是PTT联合免疫疗法的一种重要措施,免疫反应由检查点来维持免疫稳态并防止其不当激活,ICB是指使用抗体抑制T细胞上的负调节受体来增强内源性自然免疫反应。阻断这些负面信号是用PTT引发免疫反应的另一种策略[36]。
5 总结与展望
PTT在宫颈癌治疗方面具有非侵入性和高选择性等诸多优势,可能适用于抗肿瘤治疗的各个时期,不管是前期原位肿瘤的消融,还是后期控制转移肿瘤的大小,都有较好的效果[23],在抗肿瘤方面展现了巨大的优势,具有未来应用于临床的潜力[37]。根据患者本身的情况,PTT可以与手术治疗、放疗、化疗等传统治疗方式结合来控制肿瘤生长,以取得更好的治疗效果[30]。与传统手术治疗相比,PTT可以短期内多次实施而不会影响患者预后[38]。与传统放化疗相比,PTT不良作用较少,能减少因不良作用产生的组织或者器官损伤[39]。另外PTT操作简单,患者疼痛等不适感较少,耐受性相比传统方式更好[40],且治疗时间较短,未来可以应用于门诊。宫颈癌患者可能从PTT中获益会较大,诸多优点的PTT为未来宫颈癌治疗方式的选择提供了一个新方向,前期的临床前实验也为后续临床转化奠定了大量基础。相信随着纳米技术的不断发展,会不断推进PTT应用于宫颈癌治疗的临床转化进度。
