内质网应激与气道变应性炎症关系的研究进展
2023-05-09王冲俞兰刘晓玲
王冲,俞兰,刘晓玲
(1.内蒙古医科大学研究生院,内蒙古自治区 呼和浩特 010110;2.内蒙古自治区人民医院临床医学研究中心,内蒙古自治区 呼和浩特 010017;3.内蒙古自治区人民医院科研处,内蒙古自治区 呼和浩特 010017)
气道变应性炎性疾病(airway allergic inflammatory disease,AAID) 是指以气道高反应性、黏液分泌增多、气道重塑等为主要病理生理特征的疾病,常见疾病有变应性鼻炎(allergic rhinitis,AR)、哮喘(bronchial asthma,BA)、变应性咳嗽等。研究表明,气道上皮内含多种蛋白质合成分泌旺盛的细胞类型,本身易出现内质网应激(endoplasmic reticulum stress,ERS)。多种蛋白及相关因子可通过调节气道上皮细胞介导ERS通路从而与AAID的发生关系密切[1-3]。由于AAID的病因较为复杂,众多细胞、细胞因子及炎性介质参与其中,对发病机制的研究仍在不断拓展和深入[4-5]。本文拟通过综述ERS免疫机制方面的研究进展,探讨其在AAID发病机制中的作用,期望为相关疾病的精准医疗提供新的方向。
1 ERS概述
1.1 ERS的定义及生物学效应
内质网(endoplasmic reticulum,ER)是一种广泛分布于真核细胞胞质的特殊细胞器,其功能主要为折叠和修饰核糖体合成蛋白质,并通过小泡将合成的蛋白质运送至高尔基体[5]。此外,ER还具有调节脂质生物合成、钙稳态和细胞应激等功能[6]。ERS是指在多种生理或病理条件下,由于错误折叠和未折叠的蛋白质在细胞中累积,从而导致细胞启动的一系列信号转导途径并对这些途径进行应答反应,该反应具有停止细胞蛋白质的翻译合成、增强蛋白的折叠及转运能力、降解清除错误蛋白及启动细胞凋亡程序等作用[7]。
未折叠蛋白反应(unfolded protein response,UPR)是在应对ERS的过程中,细胞建立的一种进化保守机制,以维持ER的稳态[8]。哺乳动物细胞典型的UPR通路由ER近端受体激活,分别由跨膜蛋白活化转录因子6、需肌醇跨膜激酶1α和胰腺内质网激酶3个信号通路完成传导,可与炎症因子及微生物感染途径相互作用,从而活化或增强炎症因子的效应[9-11]。近年来研究表明,当ERS超过UPR的适应范围时,UPR失去适应性导致ER稳态的破坏,从而诱导细胞内凋亡信号增加并使细胞凋亡通路活化,触发细胞凋亡[9,11]。
1.2 ERS与炎症反应
研究发现,ERS、ER稳态恢复适应阶段及ER信号通路的激活均可影响机体的免疫功能并促进炎症的发生,在炎症的病理机制中ERS可决定免疫反应的性质及持续时间[12]。此外,ERS与炎症可通过不同机制产生关联。蛋白质折叠或ERS途径中产生的免疫缺陷及突变可导致自发炎症和高炎症反应[13]。研究表明,ERS 可激活核转录因子-κB(nuclear transcription factor- κ B,NF-κB)信号通路诱导机体产生炎症反应。此外,活性氧簇的产生及急性期蛋白的诱导也与ERS和炎症反应相关[14]。UPR与炎症信号通路之间通过多种机制相互偶联。UPR与Toll样受体通路及MAPK通路的相互作用可影响炎症反应的强度、炎症细胞的活化和炎症因子的释放[15]。ERS不仅可以通过UPR组分及典型的细胞因子调节转录因子之间的相互作用来激活炎症信号级联反应,还可通过UPR促进炎症因子的表达[16]。
2 ERS在变态反应中的免疫调节作用
变态反应的产生首先由外部环境中变应原与上皮细胞接触,之后引发涉及先天性和适应性免疫在内的不同类型细胞参与的炎症反应过程。这些细胞可产生大量分泌蛋白来防御内源及外源性威胁,并可与其他类型的细胞相互作用,从而产生有效的免疫应答反应。在此过程中,维持这些细胞ER正常功能及蛋白质稳态至关重要。Marciniak等[17]的研究发现,ERS可通过蛋白质折叠的方式影响正常细胞生理功能,与相关的免疫机制产生多个水平上的关联,进而导致包括变应性疾病在内的较为复杂的慢性炎性疾病。另有学者的研究表明,ERS及UPR与变态反应性炎症机制中的多种重要细胞(如上皮细胞、树突状细胞、T或B淋巴细胞、粒细胞和巨噬细胞)和炎症反应途径(如NF-κB、依赖于UPR的白介素(interleukin,IL)-6、肿瘤坏死因子(tumor necrosis factor,INF)的分泌以及炎症小体介导的IL-1β的产生)密切相关[18]。由此我们认为,ERS及UPR参与了机体免疫系统中多种免疫细胞的分化和激活过程,并引起炎性反应及细胞凋亡。
2.1 对先天性(非特异性)免疫系统的调节作用
先天性免疫系统是维护人体健康的首要防线,ERS及UPR途径可与先天性免疫细胞(树突状细胞、粒细胞、单核/巨噬细胞)相互作用,参与免疫应答反应。Lambrecht等[19-20]团队的一些研究表明,在变态反应疾病中,上皮细胞ER及ERS与树突状细胞的相互作用对变态反应的启动及放大效应至关重要,例如炎性支气管上皮触发X-box 结合蛋白-1(XBP-1)与mRNA 剪接耦合的UPR反应,从而诱导的ER/Ca2+储存扩张,使钙依赖的细胞因子分泌增加。此外,UPR的IRE-1/XBP-1通路被认为在维持呼吸道和肠上皮功能及肠上皮的完整性中起重要作用,且IRE-1/XBP-1α是树突状细胞参与正确抗原提呈功能以及在生理环境中发育与存活的先决条件[21-22]。嗜酸性粒细胞和中性粒细胞分别是2型和非2型免疫反应的主要效应细胞,在较严重的变态反应疾病中,嗜酸性粒细胞炎症与中性粒细胞炎症可能表现为不同程度上的共存,即嗜酸性/中性粒细胞炎症[23]。真菌致敏引起BA的特征为显著的2型免疫反应,主要表现为血液和组织中嗜酸性粒细胞的增多,烟曲霉诱导的肺2型免疫反应,临床症状可通过ERS拮抗剂进行治疗而得到显著改善[24]。ERS和UPR通路可能在非2型中性粒细胞变态反应中也发挥作用。有学者认为ERS与多种转录因子(NF-κB、低氧诱导因子1α等)相关,可在急性中性粒细胞浸润为主的肺部炎症中起重要作用[25]。此外,Kim等[26]的研究表明ERS可增加气道上皮细胞中IL-17的表达,并通过其中的正反馈环来增强ERS反应和激活NF-κB通路。他们还发现BA患者支气管肺泡灌洗液及单核细胞中存在ERS标志物的表达升高[27]。Hoffman等[28]在AAID相关的多种疾病模型中观察到UPR通路的活化及ER伴侣蛋白的增加。另外,ERS及UPR途径还可调节巨噬细胞的功能,并通过Toll样受体通路参与固有免疫反应的终末阶段[29]。
2.2 对适应性(特异性)免疫系统的调节作用
适应性免疫系统主要是由体内淋巴细胞(T淋巴细胞、B淋巴细胞)参与,ERS及UPR途径也可与其相互作用进行免疫应答。研究发现,T细胞和B细胞可通过参与上皮细胞与树突状细胞的相互作用启动获得性免疫反应。在淋巴组织中,由于树突细胞11b+的介导,辅助T细胞(T-helper cells,Th)2和Th17可发生极化。随后Th2细胞产生IL-4,并诱导B细胞发生类别转换及浆细胞合成免疫球蛋白E(immunoglobulin E,IgE),从而导致变应原特异性致敏的2型免疫反应[19]。通过对ERS机制的研究发现,UPR途径的IRE-1α/XBP-1臂在B细胞的早期发育阶段和效应分子CD8+T细胞的终末分化中起重要作用[30]。
3 ERS与气道变应性炎症
气道上皮对空气中的颗粒物和病原体起着前线防御作用,以保护相关组织器官免受异物损伤和感染。慢性气道炎症是AAID的一个主要特征。研究发现ER具有炎症调控功能,可为治疗各种炎症相关疾病提供潜在的研究策略。NF-κB作为一种UPR途径的转录因子,参与了多种炎症相关基因的调控及表达[13]。处于ERS状态中的多种UPR 途径可以不同方式降低IκBα(NF-κB抑制蛋白)的表达,从而上调NF-κB介导的炎症反应[31]。此外,Kim等[26]认为ERS抑制剂4-苯基丁酸可明显降低NF-κB的表达,导致Th2相关细胞因子(IL-4、IL-5、IL-13)和气道炎症因子的表达下调。另有研究发现,BA中的ERS也可通过NF-κB参与调节炎症反应。Bhakta等[32]的研究表明,BA中 2 型炎症反应标志物、INF刺激基因和ERS相关基因的表达明显升高,且ERS与2型炎症反应和INF刺激基因明显相关。Guo等[33]证实了ERS标志物在气道变应性炎症模型中的表达升高,且PERK/ATF4/CHOP通路与中性粒细胞浸润为主的气道炎症反应相关。此外,多种化合物及活化因子可通过ERS途径与气道变应性炎症相关(表1)[1,3,34-37]。
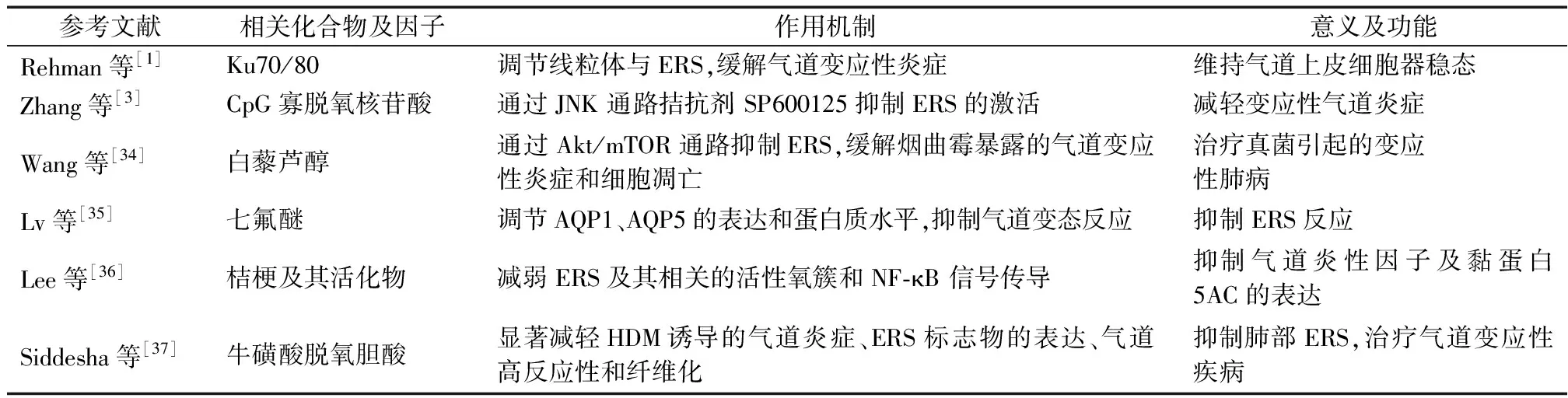
表1 气道变应性炎症中相关的ERS
3.1 ERS与BA
BA的病理生理学机制表现为吸入变应原后呼吸道产生特异性IgE导致的气道黏膜功能障碍或损伤性疾病[38]。如前所述,ERS不仅在调节上皮细胞炎症和凋亡中发挥重要作用,而且影响黏液分泌、胶原沉积及平滑肌增生。有研究认为,在哺乳动物5个黏蛋白相关基因中MUC5AC和MUC5B在气道中显著高表达,并调节呼吸系统黏液分泌[39]。另外,小气道上皮细胞中的73个ERS相关基因为MUC5AC黏蛋白相关基因[40-41]。黄芪多糖可明显下调ERS标志物水平并减少黏液产生[42]。山奈酚则通过抑制 IRE1α/TRAF2/JNK 通路的激活来阻断支气管上皮 ERS的产生,从而减轻黏液过度分泌,并降低MUC5AC基因的表达[43]。气道平滑肌的收缩也受ERS的调节。平滑肌的收缩主要依靠细胞内Ca2+浓度以及平滑肌对Ca2+的敏感性。ERS可使胞质内Ca2+失衡介导平滑肌收缩异常[42]。此外,乙醛的刺激可显著增加气道平滑肌细胞中ERS标志物的水平,致使调节炎症的NF-κB的表达上调[43]。ERS通过调节PI3K和NF-κB等通路的激活,密切参与激素抵抗型BA的发病机制[44]。因此,ERS与类固醇耐药性BA的分子机制重叠也将为治疗重症BA提供新的方法[45]。随着研究的不断深入,目前已有多种ERS相关化合物可用于治疗BA, 靶向ERS可能会成为BA治疗的一种新策略。见表2[2,28,46-51]。
3.2 ERS与AR
AR是一种发生在鼻黏膜上皮细胞的AAID,其发生发展涉及多种免疫细胞、炎性因子及细胞因子。随着研究的不断深入,ERS在AR发病中的作用也逐渐开始受到学者们关注。甄甄[52]发现AR中表达上调的细胞因子能诱导ERS的产生,ERS可通过促进IgE、IL-5、IL-13等的分泌,参与AR的发病机制。Hoffman等[53]认为屋尘螨可诱导呼吸道上皮细胞发生ERS,且跨膜蛋白活化转录因子6和ERp5(一种ER驻留蛋白)在包括AR在内的AAID发病机制中发挥重要作用。Liu等[54]发现ERS可能参与AR患者局部IgE的产生及调节,表明通过抑制 ERS来减少局部 IgE 的产生可能会为 AR的治疗提供新途径。Resano等[55]证明了ELVN-34(一种脂质介质及生物活化信使)可以有效地抵消多种基因、UPR通路和炎症因子对人鼻黏膜上皮细胞的影响,并为人鼻黏膜上皮细胞内环境平衡提供一种新型的、促进稳态的、细胞保护性的脂质信号机制,并作为AR的潜在治疗靶点。
4 展望
ERS作为异常细胞对ER蛋白质未折叠及错误折叠积聚的适应性应答反应,广泛存在于机体各类组织细胞之中,尤其是各种炎性细胞、气道上皮细胞(包括鼻黏膜上皮细胞、气管及支气管上皮细胞)等ERS敏感性细胞。因此类细胞代谢旺盛、蛋白质合成及细胞分泌量丰富,出现蛋白质未折叠及错误折叠的概率较高。近年来通过对BA病理机制的研究发现,ERS不仅在调节气道上皮细胞炎症和细胞凋亡中发挥重要作用,而且能丰富BA的治疗策略。虽然目前有关研究成果匮乏,但从现阶段研究不难推断ERS作为炎症反应的重要环节,可能与AR的发生及发展也存在密切关系。因此,深入探讨ERS对AAID的潜在机制势必会成为今后研究的热点。
