番茄尖孢镰刀菌致病特性及环境适应性
2023-05-08陆晓林姚燕来王卫平朱为静
陆晓林, 李 丹, 戴 昕, 姚燕来, 王卫平, 朱为静
(1.浙江省农业科学院环境资源与土壤肥料研究所,浙江杭州 310021; 2.杭州市农业技术推广中心,浙江杭州 310020;3.浙江省生态环境监测中心,浙江杭州 310012)
番茄营养价值高,是浙江省主要的蔬菜作物[1]。据统计,2017年浙江省设施番茄栽培面积超1万hm2,产值超亿元[2]。特别是浙江省温州市苍南县凭借独特的物候优势,已成为重要的番茄生产和供应基地之一[3]。因此,番茄产业极大地增长了当地农村经济和农民收入。但新形势下,一些设施番茄大棚基地由于常年连作和不合理施肥等原因,造成番茄连作障碍现象普遍发生[2]。
番茄枯萎病作为番茄重要的土传病害,最早于20世纪初被发现[4],目前在浙江省番茄优势产区频发[2],其在番茄植株上表现出植株萎蔫、叶片变黄、维管束褐变等系统症状,造成番茄严重减产[5]。已有研究表明,尖孢镰刀菌(Fusariumoxysporum)是番茄枯萎病主要致病菌之一[5-6]。此外,由于土壤中尖孢镰刀菌的致病力、浓度和生长速度关系到病害的发生和严重程度[7-9]。因此明确不同尖孢镰刀菌的致病力差异及其在土壤中繁殖的最适环境因素,通过创造相应的环境条件,有助于控制枯萎病的发生或蔓延[10-11]。但是,通过传统手段如稀释涂布计数或菌丝生长测定来研究枯萎病病菌生长的最适条件存在数据通量小和试验周期长等弊端[11-13]。已有研究表明,Bioscreen C全自动生长曲线分析仪可连续监测微生物的生长速率并快速筛选出微生物菌株生长的最优条件[14]。当前对不同尖孢镰刀菌生长速度的实时监测及其最适生长条件的快速筛选相关研究鲜有报道。本研究从番茄枯萎病病株及其根际土壤上分离鉴定了3株代表性尖孢镰刀菌,并对3株菌的致病特性和环境适应性进行相关研究,旨在为番茄枯萎病的科学防控提供参考。
1 材料与方法
1.1 试验材料
发病植株及其根际土壤于2021年3—5月采集自浙江省温州市苍南县不同地区连作多年的设施番茄大棚内。供试广谱性生防细菌菌株分别为贝莱斯芽孢杆菌(BacillusvelezensisK1,K1)和解淀粉芽孢杆菌(BacillusamyloliquefaciensJDF,JDF),由浙江省农业科学院环境资源与土壤肥料研究所研究人员从蔬菜作物土壤根际分离得到。用于尖孢镰刀菌分离培养及纯化的培养基分别为尖孢镰刀菌选择性培养基[11](去皮马铃薯200 g/L,琼脂粉 20 g/L,无水乙醇16.2 mL/L,45%敌磺酸钠2.1 g/L,硫酸链霉素0.75 g/L)和马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA:马铃薯浸出粉6 g/L,葡萄糖20 g/L,琼脂粉20 g/L,自然pH值)。用于生防细菌活化的培养基为lysogeny broth(LB)培养基(胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,琼脂粉 20 g/L,自然pH值)。供试0.05%HYPONeX植物营养液从网上(http://www.hyponex.co.jp)购买并按照说明书的方法配制。供试药剂:62.5 g/L精甲-咯菌腈悬浮种衣剂,购自青岛奥迪斯生物科技有限公司;65%代森锰锌可湿性粉剂,购自江西中迅农化有限公司。供试番茄品种为合作903。整个试验过程(2021年6—12月)在浙江省农业科学院环境资源与土壤肥料研究所微生物实验室进行。
1.2 尖孢镰刀菌的分离及鉴定
分别采用组织分离法和梯度稀释法[11,15]对发病植株及其根际土壤进行尖孢镰刀菌的分离。对分离得到的菌落采用尖端菌丝挑取法纯化[16]:从菌落边缘挑取适量菌丝转移到PDA培养基上,相同条件下纯化培养,反复培养3~5代直到分离出形态一致的菌株。经分离纯化,共获得20多株不同形态的尖孢镰刀菌单菌落,委托生工生物工程(上海)股份有限公司提取待测真菌的DNA,再利用通用引物ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)对所提DNA的转录间隔区(internal transcribed spacer,ITS)进行扩增[17]。用1%琼脂糖电泳检测PCR产物的大小和特异性,随后通过序列测定和同源性比较来鉴定未知真菌。最终,选取3株丰度较高的尖孢镰刀菌作为代表性菌株,分别命名为6号、8号和19号。此外,在GenBank上下载3株分离菌株的rDNA-ITS序列用于系统发育树的构建[5]。
1.3 尖孢镰刀菌对番茄种子萌发及幼苗生长的影响
将3株优势尖孢镰刀菌接种到PDB培养基,并于28 ℃和160 r/min下振荡培养2 d。培养结束后,分别制成106、105、104个/mL的孢子悬浮液,待用。各取10 mL孢子悬液(105、104个/mL)接入铺有1层滤纸的培养皿中,并在培养皿中央散播饱满一致的10颗番茄种子,置于孵育箱(26 ℃、70%相对湿度)暗培养4 d。培养结束后测定不同浓度尖孢镰刀菌孢子悬浮液对番茄种子萌发的影响[18]。设对照接种等量的灭菌PDB培养基的稀释液,所有处理均重复3次。
采用水培法测定3株尖孢镰刀菌对番茄幼苗生长的影响[19]。各取5 mL孢子悬浮液(105个/mL)接入到含有10 mL营养液的离心管中。随后,一个离心管移栽1颗番茄苗,并在24~30 ℃的温室下培养[20]。每个处理包括8株番茄苗,3次重复,对照接种等量的PDB培养基稀释液。待发病后选取发病组织进行病原菌的再次分离鉴定。枯萎病病害采用0~4级的5级分级标准,其中0级,植株健康,无叶片发黄;1级,植株无萎蔫症状,叶片发黄占比小于50%;2级,植株无萎蔫症状,叶片发黄占比大于50%;3级,植株叶片萎蔫,茎基部出现病斑;4级,植株枯死。病情指数(disease index,DI)[21]采用如下公式进行计算:
病情指数=∑(各级发病株数×该级代表值)×100/(调查总株数×病情最高级代表值)。
1.4 生防菌和药剂对尖孢镰刀菌的拮抗作用
采用平板对峙法测定生防菌对尖孢镰刀菌菌丝生长的影响[22-23],用灭菌打孔器(直径为5 mm)取活化好的尖孢镰刀菌菌饼,倒扣在新鲜PDA培养基的一侧,然后在距离病原菌4 cm的位置再接种近似大小的生防菌单菌落。设不接种生防菌为对照,每处理重复3次。培养7 d后,测定各处理组尖孢镰刀菌菌落平均半径d,对照组尖饱镰刀菌平均半径为D,并计算抑制率。
利用菌丝生长速率法[24],考察精甲-咯菌腈和代森锰锌对尖孢镰刀菌的生长抑制作用。在预试验的基础上制成N(N≥6)个系列浓度的精甲-咯菌腈和代森锰锌溶液,加入到PDA培养基混匀,以无菌水代替药剂作为空白对照。每个处理重复4次。将尖孢镰刀菌菌饼转接到上述含药PDA培养基和空白对照中,(28±2)℃培养7 d,用十字交叉法测量菌落直径,并计算菌丝生长平均抑制率及药剂对供试病原菌菌丝生长抑制的回归方程、相关系数(r)和抑制有效中浓度(EC50)[13]。菌丝生长平均抑制率=(对照菌落直径均值-处理菌落直径均值)/(对照菌落直径均值-接种菌饼直径)×100%。
1.5 尖孢镰刀菌最适生长条件测定
配制50 mL pH值分别为4、5、6、7和8以及NaCl浓度分别为0.5%、1%、2%和4%的PDB培养基。将不同pH值和NaCl浓度的PDB培养液在121 ℃下灭菌20 min,待冷却至室温后接种1%“1.3”节所制备的孢子悬浮液(105个/mL),混匀待测。各吸取0.2 mL培养液添加到加样孔内,每组设置5个平行,将样品板放入Bioscreen C(FP-1100-c,芬兰)培养箱内,中速转速和30 ℃条件下[14]培养72 h,根据菌株的生长曲线确定最适生长pH值和NaCl浓度。
1.6 数据处理与统计分析
使用Excel 2010、IBM SPSS 26.0和OriginPro 2021软件进行数据处理、方差分析并作图。不同数据组间差异显著性分析采用Duncan’s新复极差法和Student’st检验法进行多重比较(α=0.05),所有数据均用平均值±标准偏差表示。
2 结果与分析
2.1 尖孢镰刀菌的分离鉴定
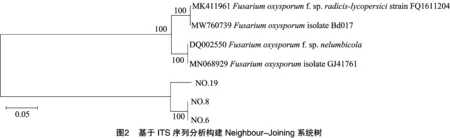
从发病番茄及其根际土壤中分离鉴定出3株占比较高的优势尖孢镰刀菌菌株6号、8号和19号(表 1和图 1)。此外,将这3株尖孢镰刀菌ITS序列在NCBI上进行BLAST比对,并下载与病原菌ITS序列同源性最为接近的4条序列,进一步结合MEGA7.0分子软件,采用邻接法构建系统发育树(图2)。发育树显示菌株6号、8号和19号的序列均与尖孢镰刀菌的相似度高达100%,且菌株6号和8号在自举值为100%水平上聚在同一个进化分支上。

表1 优势镰刀菌分离株的菌落形态特征
2.2 尖孢镰刀菌致病力测定
3株尖孢镰刀菌在不同浓度下对番茄种子萌发的影响如图3-A所示。104孢子悬浮液处理条件下,6号和8号菌株对种子萌发产生了显著(P<0.05)抑制,而19号株对萌发种子根长的影响与对照相比,无显著差异。105孢子悬液条件下,3株尖孢镰刀菌均对萌发种子的根长有显著(P<0.05)抑制作用。

3株尖孢镰刀菌对番茄幼苗的致病特性结果如图3-B所示。6号和8号菌株孢子悬浮液培养 10 d 后,番茄幼苗表现出明显的发病症状(图3-C和图3-D),病情指数均在80%以上,显著高于在19号菌株孢子悬浮液培养下的病情指数(19.79%)(P<0.001)。

2.3 生防菌和抑菌药剂对尖孢镰刀菌的拮抗效果研究
生防菌K1和JDF与尖孢镰刀菌的对峙培养试验结果表明,2株生防菌对3株尖孢镰刀菌的生长均有一定的抑制作用(图4-A)。其中,生防菌JDF对3株尖孢镰刀菌的生长抑制率均在39%以上,且三者间无显著差异(P>0.05)。而生防菌K1对8号菌株的抑制率显著优于6号和19号菌株(P<0.01),但总体上对三者的抑制率仍达到35%以上。
由表2可知, 精甲-咯菌腈和代森锰锌对3株尖孢镰刀菌均有一定的抑制作用。其中,精甲-咯菌腈对3株尖孢镰刀菌的毒力作用优于代森锰锌,且2种药剂对6号和8号菌株的抑制作用高于19号菌株。

表2 药剂对尖孢镰刀菌的毒力
2.4 pH值和盐浓度对尖孢镰刀菌生长的影响
生长曲线结果表明(图5),3株尖孢镰刀菌在pH值=4和NaCl浓度=2%条件下,生长速度最快。其中,19号菌株对pH值和盐浓度的适应性更好,在pH值为4~8及NaCl浓度0.5%~4% 范围内均能快速生长。而6号和8号菌株在酸性(pH值为4~5)和高盐(NaCl浓度2%~4%)环境下,生长速率更高。
3 讨论与结论
了解番茄枯萎病病菌的种类和环境适应性是开展有效防治的前提和基础。本研究从番茄枯萎病株及其根际土壤分离得到3株丰度优势尖孢镰刀菌6号、8号和19号。前人研究发现,尖孢镰刀菌为引发蔬菜作物枯萎病的主要病原菌之一[5,20,25]。此外,尖孢镰刀菌存在多个生理小种[7-8],且这些菌株的致病力存在差异[10,25]。在本研究中,相比于19号菌株,6号和8号菌株对番茄种子和幼苗具有更高的抑制性或致病力。笔者推测,19号菌株可能是弱致病力尖孢镰刀菌,由于缺失了谱系特异性区域而对宿主植物具有非致病性[7,9]。而关于6号和8号菌株如何侵染宿主致其发病的相关机理还有待于进一步研究。
多黏类芽孢杆菌(Bacillusspp.)是广泛存在于自然界的重要的生物防治微生物资源,其生防机制主要有生态位竞争、抑菌物质产生、重寄生作用与改善植物生长等[26-27]。多效拮抗菌贝莱斯芽孢杆菌和解淀粉芽孢杆菌在作物绿色防控上的作用更是已被前人所证实[4,28]。本试验表明,2种生防菌对3株尖孢镰刀菌均有一定的抑制作用,尤其是解淀粉芽孢杆菌对3株尖孢镰刀菌的抑制率较高,达到39.64%~44.57%,因而解淀粉芽孢杆菌用于防控本研究中尖孢镰刀菌引起的枯萎病会更有潜力。而枯萎病害的发生往往是由多种尖孢镰刀菌复合侵染作物引起,因此在摸清致病菌株致病特性基础上开展专用生防菌的筛选显得尤为重要。此外,精甲-咯菌腈和代森锰锌等杀菌剂已广泛用于经济作物真菌病害的防治中[3,13]。谢昀烨等研究表明,代森锰锌在田间防效上效果远高于精甲-咯菌腈,病原菌菌株差异性可能是其与本研究结果不一致的主要原因[3]。

本研究在室内条件下探索了3株尖孢镰刀菌的最适生长条件,明确了3株菌在pH值=4和NaCl浓度=2%条件下生长速度最快,这一结论与前人的研究结果[11,29]相似。由于氮素化肥的大量使用,我国设施大棚土壤酸化问题十分突出,而酸化的土壤环境更加有利于尖孢镰刀菌等土传病原真菌的生长和繁殖[11]。在中性或碱性条件下,致病力较强的6号和8号菌株的生长速率均受到了一定程度的抑制。因此,在不影响作物生长的前提下,提升酸化土壤pH值,或许可在一定程度上控制枯萎病的发生或蔓延。此外,研究发现,较高的盐浓度可显著促进6号和8号致病菌株的生长,这一现象与尖孢镰刀菌为耐盐真菌的结论[30]一致。
综上所述,本研究对设施番茄大棚内优势尖孢镰刀菌的致病特性和环境适应性进行了考察,研究结果为掌握番茄枯萎病的发病规律及开发相应的防治手段提供了数据基础和参考。
