皂角苷强化黑麦草去除土壤PAHs效果及机制探究
2023-05-08史鑫成何文程陈明龙
史鑫成,张 园,何文程,陈明龙
(苏州科技大学 环境科学与工程学院,江苏 苏州 215009)
0 引 言
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类典型的存在于水、土壤以及沉积物等环境介质中的有机污染物,其能够通过各种途径进入人体,产生致癌、致畸和致突变性的“三致效应”[1].此外,它分布广泛且能够在环境中持久存在.近年来,在全国各地,尤其是在长江三角洲、珠江三角洲及京津唐等经济较为发达的地区,越来越多的土壤环境受到PAHs的污染[2].以位于长江三角洲的江苏省来讲,据Sun等[3]评估发现,江苏省农田土壤中PAHs的平均浓度达到了 1.06 mg/kg,污染较为严重;特别是在经济发达的苏州地区:在张家港某钢铁厂周边农用地多环芳烃平均浓度为 6 130 μg/kg[4],吴江、吴中、相城三个市辖区农用地中PAHs的平均浓度达到了 312.5 μg/kg[5].土壤中PAHs 污染的严重不单影响到了土壤自身生态系统的稳定与健康,还会通过食物链等多种途径危害到人类的身体健康.因此,治理土壤中的PAHs已迫在眉睫,PAHs污染土壤的修复技术的发展完善始终是土壤环境技术领域的研究重点之一.
植物修复是一种低成本、操作简便,主要用于清除土壤系统中有毒有害物质的绿色修复技术,这一技术通过植物根系改善土壤理化性状;分泌多种酶类将污染物质催化降解;植物吸收及迁移转化等多种能力修复土壤环境[6].黑麦草因具有较强的耐受力和在污染土壤中较强的生长能力,因而被作为主要修复植物得到广泛应用.然而,由于土壤中PAHs的生物可利用性较低,黑麦草等植物修复的效率在短期内往往有一定的局限[7].现阶段,在强化黑麦草等植物修复PAHs污染土壤的方法中,主要有调节土壤碳氮比、投入PAHs专性降解菌(植物-微生物联合修复)、施加化学表面活性剂等措施[8].在上述强化技术中,表面活性剂的施加可以有效增溶土壤中的PAHs ,提高PAHs在土壤中的生物有效性.
生物表面活性剂[9]由于能提高难降解有机污染物在土壤中的生物有效性且本身不具有传统化学表面活性的毒性[10]而被广泛关注:槐糖脂、鼠李糖脂等微生物源生物表面活性剂已在环境修复领域取得了较好的修复成果[11-13],而对于植物源表面活性剂的却相对涉及不多.皂角苷(又称皂素,英文:Saponin)则是植物源生物表面活性剂中的典型的代表,在现有皂角苷应用土壤修复研究中,应用较多的也仅在重金属污染领域[14-15],使用皂角苷强化黑麦草修复PAHs 污染土壤的研究报告同样较为罕见.因此,本实验选取菲、芘两种典型PAHs模拟污染土壤,种植黑麦草,并施入植物源生物表面活性剂皂角苷,通过土壤中PAHs 的去除率、黑麦草生物量、黑麦草体内酶活性和PAHs含量以及根系土壤微生物群落结构等研究评价其强化效果,为皂角苷等生物表面活性剂应用于PAHs污染土壤修复提供科学依据.
1 材料与方法
1.1 供试材料
原始土壤取自江苏省太仓市璜泾镇一处农田荒地;皂角苷(BR,10%~25%,CMC值=50.1 mg/L),购于上海麦克林生化科技有限公司;菲(化学式C14H10、logKow=4.57、水溶解度 0.89 μg/L)和芘(化学式C16H20、logKow=5.18、水溶解度 0.14 μg/L),CAS号分别为85-01-8,129-00-0,购于上海麦克林生化科技有限公司.黑麦草种子购于宿迁妃里香花卉有限公司.
丙酮、二氯甲烷、甲醇、正己烷均为色谱级,其他化学药剂为分析纯.
土壤污染步骤如下:将 50 mL 溶有一定菲和芘的丙酮溶液投入 5 kg 土壤中,不停搅拌,再加入 5 kg 土壤搅拌至充分均匀,待丙酮自然挥发后,按每次 10 kg 土壤投入,加水保持湿润,充分搅拌,得到约 50 kg 污染土壤.之后置于避光处,老化1个月待用.测得菲和芘的含量分别为 23.03 mg/kg、26.6 mg/kg.
1.2 实验设计
本实验设置6个处理组,分别为:a.仅种植黑麦草的污染土壤(CK);b.种植黑麦草并添加 20 mg/kg 皂角苷(S20);c.种植黑麦草并添加 50 mg/kg 皂角苷(S50);d.种植黑麦草并添加 100 mg/kg 皂角苷(S100);e.种植黑麦草并添加 200 mg/kg 皂角苷(S200);f.种植黑麦草并添加 500 mg/kg 皂角苷(S500),每个处理组设置三个平行.
每个试验盆中装有供试土壤 1.5 kg,并按上述条件施入相应浓度的皂角苷,黑麦草种子经纯水浸泡 12 h 后,每盆播下约60粒种子,待其出芽后,每盆留40株.盆栽试验于2021年2月8日—2021年4月8日在温室大棚中进行.
黑麦草于 60 d 后收获,用去离子水洗净后,一部分立即测定生理指标,一部分冷冻干燥后放入 -80 ℃ 冰箱保存;土壤样品为根际土壤,采集后冷冻干燥,同样放入 -80 ℃ 冰箱保存.
1.3 指标测定
1.3.1 黑麦草生物量测定方法
每个处理组选取一株黑麦草,整株采集,用去离子水将其洗净,置于滤纸上待其吸干水分,在烘箱中 80 ℃ 烘至恒重,分别称量植株地上部及地下部干重.
1.3.2 土壤及植物体内PAHs测定方法
土壤中PAHs的提取方法采用二氯甲烷法[11,16]:取 1 g 土壤于 50 mL 离心管中,加入 10 mL 二氯甲烷溶液,超声萃取 60 min.之后在 3 000 r/min 的转速下离心 15 min,收集所有上清液(即萃取液).将萃取液氮吹浓缩至 3 mL,并使用填有 2.5 g 硅胶的层析柱将其净化,用 15 mL 二氯甲烷和正己烷(1∶1)进行洗脱,收集洗脱液,并用氮吹吹至近干.再用 5 mL 甲醇定容,取 1 mL 过 0.22 μm 有机系滤膜,待测.
修复植物黑麦草中的PAHs的萃取方法[17]则是:取 1 g 植物样品,剪碎混匀.放置于 50 mL 离心管中,分三次每次 10 mL 加入二氯甲烷和丙酮(1∶1)混合液,每次超声萃取 30 min.收集萃取液后氮吹至干,之后用 2 mL 正己烷润洗,取 l mL 过 2.5 g 硅胶柱(200~300目)净化,加入 15 mL 正己烷和二氯甲烷(1∶1)混合液进行洗脱,收集洗脱液氮吹浓缩至近干,用 2 mL 甲醇定容,取 1 mL 过 0.22 μm 有机系滤膜,待测.
PAHs的测定使用高效液相色谱仪,其测试条件如下:色谱柱为AcclaimTM 120 C18 5 μm 120A(∅4.6 mm×250 mm);流动相为色谱纯甲醇和水(90/10);流速为 1 mL/min;柱温为 30 ℃;进样量为 10 μL,菲和芘的检测波长分别为 254 nm 和 334 nm.
土壤中的PAHs的去除率η:
η=(C0-C60)/C0
式中:C0为第 0 d 土壤中多环芳烃的浓度(μg/kg);C60为修复 60 d 后土壤中多环芳烃的浓度(μg/kg).
植物对多环芳烃(菲、芘)的富集和转运能力分别用生物浓缩系数(BCF)和运系数(TF)表示,两者的具体公式如下:
BCF=Cp/Cs
式中:Cp为多环芳烃在植物体内的浓度(μg/kg);Cs为多环芳烃在土壤中的浓度(μg/kg).
TF=Ca/Cu
式中:Ca为植物地上部分多环芳烃浓度(μg/kg);Cu为植物地下部分多环芳烃浓度(μg/kg).
1.3.3 植物抗氧化酶测定方法
植物的抗氧化酶活性参考课题组前人[18]的方法:丙二醇(MDA)采用硫代巴比妥酸法(TBA);超氧化物歧化酶(SOD)采用用氮蓝四唑(NBT)法;过氧化氢酶(CAT)和过氧化物酶(POD)两种酶活性的测定方法则采用试剂盒(CAT-2-W、POD-2-Y,苏州科铭生物技术有限公司,中国).
1.3.4 土壤微生物群落的检测
根据FastDNATMSPIN Kit(116540600,MP Biomedicals,美国)提供的实验操作步骤,提取样品的微生物基因组DNA.提取的DNA样品送至北京诺禾致源科技进行测序.
1.4 数据分析
用Excel 2019和IBM SPSS 26对数据进行分析,对不同处理数据进行单因素方差分析(ANOVA)和Duncan多重比较,数据以(平均值±标准差)表示,显著性水平设为0.05,用Origin 2021进行绘图.
2 实验结果与讨论
2.1 皂角苷对土壤中PAHs的去除率的影响
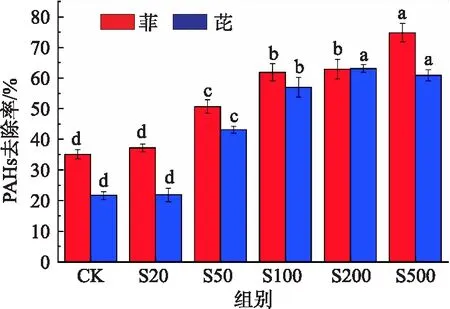
注:字母不同代表组别之间有显著性差异(P<0.05),误差线代表3个重复样品的标准偏差,下同.图1 土壤中PAHs的去除率Fig.1 Removal rate of PAHs in soil
皂角苷的施入对土壤中PAHs的去除有着良好的去除效果:在不同浓度皂角苷施加下,土壤中多环芳烃的去除率见图1.由图1可见,未添加生物表面活性剂皂角苷的土壤(CK)对于菲、芘两种多环芳烃的降解率分别是35.11%及21.65%.而随着皂角苷浓度的增加,多环芳烃的降解率也在不断提高:菲的去除率在皂角苷浓度达到 500 mg/kg 时,达到了74.9%,显著高于其他处理组,而芘在皂角苷浓度为 500 mg/kg 和 200 mg/kg 时,去除率无显著差异,分别为60.9%、63.14%.
在各处理组中,菲的去除率都高于芘,这是因为PAHs的环数(菲3环,芘4环)越高,它在土壤中的疏水性也越高,故而生物有效性相对更低,越难去除.而芘在皂角苷浓度为 50 mg/kg 时,其去除率相对低环较上一浓度增加了49.5%,这是因为当高环PAHs的生物有效性一旦提高,其去除效率相对低环PAHs会迅速上升[19],这与PAHs的胶束-水分配系数(Km)有关[20].
2.2 皂角苷对黑麦草生物量的影响

图2 黑麦草生物量Fig.2 Biomass of ryegrass
整个实验期间,黑麦草生长良好,表明施入20~500 mg/kg 皂角苷未对黑麦草产生毒害作用,这也为皂角苷表面活性剂应用于土壤修复提供了技术保障.待培养 60 d 后,其地下部分(根部)及地上部分(叶际)的生物量见图2.结果表明,在施加皂角苷表面活性剂后,对于黑麦草叶际而言,只有当施加量大于 200 mg/kg 时,叶际生物量相对于CK组显著增加,其余无显著差异;而对于根际,黑麦草生物量始终未随皂角苷浓度升高而表现出显著性差异.综上,皂角苷的浓度增加会使得黑麦草地上部分的生物量呈渐进上升趋势.

(a) (b) (c) (d)图3 黑麦草体内酶活性及MDAFig.3 Enzyme activity and MDA in ryegrass
2.3 皂角苷对植物酶活性及丙二醛的影响
CAT、SOD和 POD是植物体内能够抵御植物细胞内活性氧伤害的重要保护性酶[18,21].皂角苷对黑麦草酶活性和丙二醛含量有显著的影响,黑麦草体内CAT活性变化见图3(a),与未添加皂角苷的对照组(CK)相比,黑麦草根部及叶际CAT活性分别在皂角苷浓度达到20及 50 mg/kg 时,发生显著变化,又分别在皂角苷浓度达到500及 200 mg/kg 时,出现最大值,是CK组的1.47和1.53倍;SOD活性变化见图3(b),与CK相比,20和 50 mg/kg 皂角苷处理对根部及叶际的 SOD活性无显著影响,之后随着皂角苷浓度的上升显著且趋于稳定,在皂角苷浓度达到 500 mg/kg 时,SOD 活性出现最大值;观察图3(c)发现,POD活性变化与 SOD活性变化趋势相同;黑麦草MDA变化见图3(d),MDA是脂质过氧化产物,其含量通常用来代表植物受损伤的程度以及衡量植物对逆境条件反应的强弱[22-23],皂角苷的施入能够逐步缓解PAHs对修复植物黑麦草的毒害,在浓度达到 100 mg/kg 时,皂角苷的缓解作用开始变得显著.对比未添加皂角苷的CK组,当皂角苷施入浓度达到 500 mg/kg 时,黑麦草根部及叶际中的 MDA值分别从 27.9 μg/g 下降到 17.62 μg/g、24.1 μg/g 下降到 15.38 μg/g.
综上,当皂角苷浓度达到一定浓度时,能够显著提高黑麦草体内三种抗氧化酶的活性,进而增强了黑麦草抗氧化酶系统的抗氧化能力,减弱了多环芳烃对其细胞膜的脂过氧化损伤程度,缓解了多环芳烃对黑麦草的毒害.此外,据相关研究表明,植物抗氧化酶虽然能够对植物起到保护作用,但其本身存在阈值,当酶活性达到某一高度时,抗氧化酶系统会受到破坏,酶活性便会随之下降[22].而本研实验中,黑麦草酶活性在皂角苷施入的浓度范围内,未达到保护阈值,这一结果也能再次为皂角苷应用于植物修复提供了保障.
2.4 皂角苷对黑麦草吸收土壤中PAHs的影响
实验分别测定了黑麦草根部及叶际中PAHs的含量,两部分中菲、芘的含量及生物富集系数(BCF)和转运系数(TF)如表1、表2所示.由表可以看出从根部检测出的两种PAHs含量皆高于叶际,当皂角苷浓度大于 100 mg/kg 时,能够显著提高黑麦草对PAHs的吸收,当皂角苷入浓度达到 500 mg/kg 时,菲、芘两种PAHs的富集系数是无皂角苷施入(CK)的1.52及1.78倍;而对于转运系数来讲,皂角苷施入对PAHs从根部向叶际的转运无明显促进作用,这是因为有机化合物的logKow一旦大于4时(菲和芘的logKow分别为4.57和5.18)便极易于滞留在植物根部[24],这也说明了根部将会是植物用来吸收降解PAHs的主要部位[25].另外,从表中发现,菲在根部的含量少于芘,然而叶际中的菲含量却是芘的数倍,这是因为菲有着相对较高的水溶解度(菲和芘的水溶解度分别为 0.89 μg/L 及 0.14 μg/L),从而易于从根部到叶际的转运.

表1 不同处理下植物体内菲含量、生物富集系数(BCF)和转运系数(TF)

表2 不同处理下植物体内芘含量、生物富集系数(BCF)和转运系数(TF)
然而在评价植物吸收积累对土壤PAHs去除的贡献率时发现:植物吸收对土壤中菲和芘去除率的贡献率微乎其微,以生物量和积累量最高的 500 mg/kg 皂角苷组别(S500)为例,叶片生物量 1.42 g/株,菲浓度 0.147 mg/kg,根生物量 0.27 g/株,菲浓度 0.663 mg/kg,每盆植物40棵黑麦草,植物带走的菲的量约 0.054 mg.虽然从理论上讲,植物对于吸收的PAHs有一定的降解以及其它原因PAHs的代谢挥发,但总体是有限的[26].由此可见,皂角苷虽然能有效加强黑麦草对PAHs的吸收,然而黑麦草吸收累积土壤PAHs的贡献不足 0.1 mg/kg(贡献率不足1%).
在土壤中PAHs的生物有效性提高以后,微生物的降解作用才是去除PAHs及其它有机污染物的主要作用机制[27].此外,生物表面活性剂不仅能够直接增溶PAHs(提高土壤PAHs的生物有效性),它也能够促使植物根系分泌更多低分子有机酸(如草酸等)从而进一步提高PAHs的生物有效性[28],加强了土壤中PAHs的微生物降解.
2.5 皂角苷对黑麦草根系土壤群落结构的影响

图4 土壤中细菌群落在主要属水平的相对丰度Fig.4 Relative abundance of bacterial communities at the major genus level
土壤微生物的降解作用是去除PAHs的主要作用机制[27],土壤中天然的PAHs降解菌群主要有假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、鞘氨醇单胞菌属(Sphingomonas)、溶杆菌属(Lysobacter)、土壤红杆菌属(Solirubrobacter)等[12].在皂角苷作用下土壤细菌属水平的变化如图4所示.由图4可知,在无皂角苷施入的土壤(CK)中优势菌属主要有马赛菌属(Massilia)、假单胞菌属(Pseudomonas)、微枝形杆菌属(Microvirga)、苯基杆菌属(Phenylobacterium)及芽孢杆菌属(Bacillus)等,而随着皂角苷施入浓度的增加,群落中原占优势的马赛菌属(Massilia)、微枝形杆菌(Microvirga)、苯基杆菌(Phenylobacterium)等开始大幅度减少,而鞘氨醇单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)这三类PAHs降解菌的比例则随着浓度增加逐渐上升:如在皂角苷施入浓度为 500 mg/kg 时,微枝形杆菌(Microvirga)由5.49%降低至0.89%,缩小了83.8%;另外对于鞘氨醇单胞菌属(Sphingomonas)、芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)这三类PAHs降解菌而言,皂角苷对芽孢杆菌属(Bacillus)的丰度促进尤为突出,由8.34%升至15.33%,提升了82.9%,而芽孢杆菌属(Bacillus)也是诸多PAHs降解菌中最为典型有效的,它能降解包括菲、芘等16种PAHs[29].此外,鞘氨醇单胞菌属(Sphingomonas)及假单胞菌属(Pseudomonas)的丰度分别从11.31%上升至16.75%、4.31%上升至5.88%.PAHs降解菌丰度的增加,使得土壤中的PAHs也因此得到了更高效的降解.
3 结 论
1) 皂角苷浓度的增加会使得土壤PAHs的降解率不断提高:皂角苷浓度达到 500 mg/kg 时,菲的去除率最高,为74.9%,显著高于其他处理组;而芘在皂角苷浓度为200~500 mg/kg 时,去除率达到最优且趋于稳定,约为63.14%.
2) 皂角苷能够显著提高黑麦草体内CAT、SOD、POD三种抗氧化酶活性,并减少黑麦草体内MDA的含量,显著提高了修复植物黑麦草的抗氧化能力.
3) 皂角苷施入能够显著提高黑麦草对PAHs的吸收,当施入浓度达到 500 mg/kg 时,菲、芘两种PAHs的富集系数是CK组的1.52及1.78倍;对于转运系数来讲,皂角苷的施入无明显促进作用.总体而言,皂角苷能有效加强黑麦草对PAHs的吸收,然而其对PAHs的吸收累积量在整个土壤PAHs修复过程中所占的贡献率却很小.
4) 微生物降解作用是去除土壤PAHs的关键,添加皂角苷能够优化微生物的群落结构,提升土壤中PAHs天然降解菌属芽孢杆菌属(Bacillus)、鞘氨醇单胞菌属(Sphingomonas)、假单胞菌属(Pseudomonas)的相对丰度,从而促进了土壤中PAHs更为高效的降解.
