基于网络药理学和分子对接探讨“黄连-茵陈”治疗慢性萎缩性胃炎机制※
2023-05-07高云霄胡婧楠王小天李博林
李 泽 杨 柳 高云霄 胡婧楠 张 彤 王小天 李博林△
(1.河北中医学院第一附属医院脾胃三科,河北 石家庄 050011;2.河北省浊毒证重点实验室,河北 石家庄 050011;3.河北省脾肾病证中医治疗技术创新中心,河北 石家庄 050011;4.河北医科大学第四医院呼吸内科,河北 石家庄 050011;5.河北中医学院2022级博士研究生,河北 石家庄 050090)
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是指胃黏膜上皮遭受反复损害而导致固有腺体减少,伴或不伴肠腺化生和(或)假幽门腺化生的一种慢性胃部疾病,被公认为属于胃癌前病变[1]。CAG属于中医学“胃痛”“痞满”范畴,中医药在CAG的治疗中发挥了重要的作用。国医大师李佃贵教授的浊毒理论认为,浊毒贯穿于CAG发生发展的始终,并提出运用化浊解毒法治疗CAG,取得了很好的临床疗效[2-3],但化浊解毒法治疗CAG的具体机制以及涉及的具体蛋白靶点与通路尚不清楚。前期通过对化浊解毒法治疗CAG处方进行数据挖掘表明,“黄连-茵陈”是化浊解毒法治疗CAG应用频次最高的药对,也是处方中药物组合关联规则置信度最高的药对,最能代表化浊解毒法的核心治则[4]。黄连有清热泻火、解毒燥湿之能,茵陈能清利肝胆脾胃湿热,除湿滞浊停,散热结毒聚,两者相须为伍,一偏于利湿化浊,兼能散热结,一偏于清热解毒,兼可燥湿浊,实为化浊解毒之经典药对。相关研究表明,黄连中的活性成分能够有效抑制炎性反应,抑制相关蛋白酶活性,调节自噬,以保护胃肠黏膜[5-6];茵陈中茵陈色原酮等成分则能够抑制脂多糖诱导的炎症基因活化,从而发挥抗炎作用,还可以直接杀伤肿瘤细胞,抑制肿瘤细胞增殖,并促进细胞凋亡[7-8]。本研究采用网络药理学和分子对接的方法,分析化浊解毒法代表药对“黄连-茵陈”治疗CAG的作用靶点及可能分子机制,以期探索化浊解毒法治疗CAG的具体机制以及涉及的靶点与通路,并为化浊解毒法治疗CAG的临床应用提供合理的理论依据。
1 资料与方法
1.1 一般资料
1.1.1 “黄连-茵陈”药对有效活性化合物收集及相应靶点预测 通过中药系统药理学数据库与分析平台(TCMSP)(http://tcmspw.com/tcmsp.php)分别以“黄连”“茵陈”为关键词,以口服生物利用度(OB)≥30%及类药性(DL)≥0.18为筛选标准,对药物有效活性化合物进行筛选。再根据有效活性化合物,运用DrugBank数据库(https://go.drugbank.com)获取有效活性化合物对应靶点信息,通过UniProt数据库(https://www.uniprot.org),将物种设置为“Homo sapiens”,搜索各个靶点对应的基因简称并进行转化。
1.1.2 CAG疾病相应靶点预测 通过GeneCards数据库(https://www.genecards.org)、CTD数据库(http://ctdbase.org)、TTD数据库(http://db.idrblab.net/ttd/)及OMIM数据库(https://omim.org)对CAG疾病靶点进行检索,以“chronic atrophic gastritis”为关键词,检索完毕后对检索疾病靶点进行整合。
1.2 研究方法
1.2.1 获取“黄连-茵陈”药对化合物与CAG疾病的交集靶点 通过Venn 2.1.0 网页软件对“黄连-茵陈”药对化合物靶点与CAG疾病靶点进行分析对比,获取其交集靶点并以韦恩图形式呈现。
1.2.2 构建“药物-化合物-靶点-疾病”全局网络图 将药物及其对应化合物,化合物与疾病交集靶点导入Cytoscape 3.6.1,建立“药物-化合物-靶点-疾病”全局网络并进行可视化,网络中Degree值较高的为核心有效成分。
1.2.3 蛋白质-蛋白质相互作用(PPI)网络构建及可视化 将得到的交集靶点上传到STRING 11.0数据库(https://www.string-db.org),得到蛋白互作信息,并将其导入到Cytoscape 3.6.1软件进行可视化分析,并根据Degree值获取PPI网络中的核心靶点。
1.2.4 基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析 将得到的交集靶点导入到DAVID 6.8数据库(https://david.ncifcrf.gov),对交集靶点进行GO功能富集分析和KEGG通路富集分析,获得“黄连-茵陈”治疗CAG所涉及的分子功能(MF)、细胞组分(CC)、生物过程(BP)和信号通路,最后运用R语言软件和GraphPad软件进行可视化。
1.3 核心有效成分与核心靶点的分子对接 将筛选的核心有效成分与PPI网络中的核心靶点进行分子对接验证。从结构生物信息学研究合作组织(RSCB)PDB数据库(https://www.rcsb.org)中下载关键靶蛋白的3D结构,并通过Pymol、AutoDock Tools 1.5.6软件进行去水、去配体和加氢、加电荷的处理。从TCMSP数据库中下载核心格式为Mol的化合物文件,输出为pdbqt格式。运用AutoDock Tools 1.5.6 软件进行分子对接以获取其结合能,通过Pymol软件对对接结果进行可视化。
2 结果
2.1 “黄连-茵陈”药对活性化合物及相应靶点筛选结果 通过TCMSP数据库,以OB≥30%及DL≥0.18为筛选标准,筛选出黄连活性化合物14个、茵陈13个,去除1个重复化合物后,得到“黄连-茵陈”药对26个活性化合物。通过DrugBank数据库获取有效活性化合物对应靶点信息412个,运用UniProt数据库对靶点进行去重并删除其中非人类靶点,得到86个靶点。“黄连-茵陈”药对活性化合物信息。见表1。
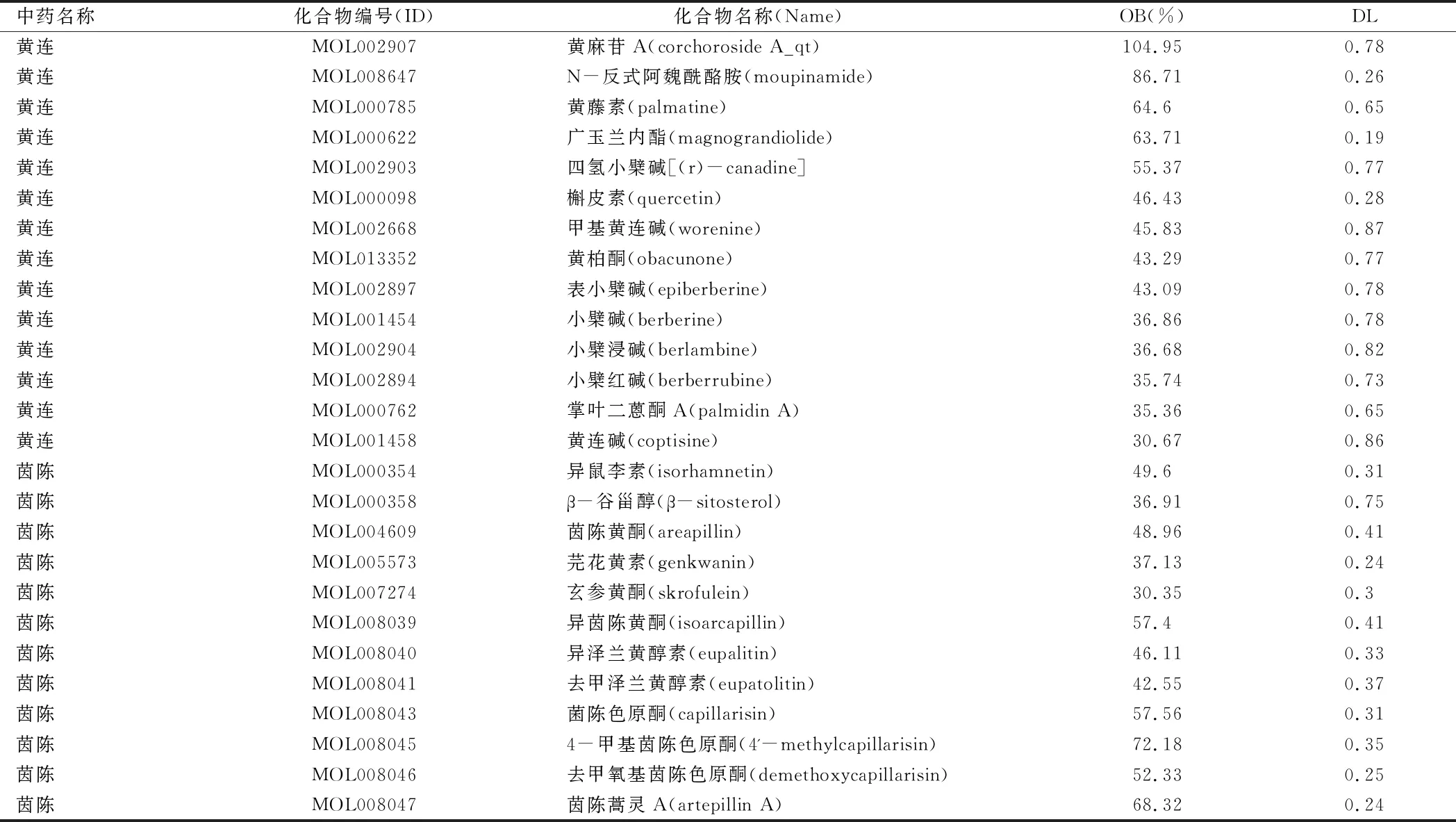
表1 “黄连-茵陈” 药对活性化合物信息
2.2 CAG疾病靶点及“黄连-茵陈”药对活性化合物与CAG疾病交集靶点筛选 根据GeneCards、CTD、TTD、OMIM数据库检索CAG靶点,去重后共有639个。将CAG疾病靶点与“黄连-茵陈”药对活性化合物靶点进行对比,共得到38个交集靶点。见图1。

图1 “黄连-茵陈”药对活性化合物靶点与CAG靶点韦恩图
2.3 “药物-化合物-靶点-疾病”全局网络图 应用Cytoscape 3.6.1软件将“黄连-茵陈”药对活性化合物与CAG的交集靶点进行“药物-化合物-靶点-疾病”全局网络图可视化,并得到Degree值排名前5的“黄连-茵陈”有效活性化合物为槲皮素、异鼠李素、β-谷甾醇、四氢小檗碱、小檗浸碱,为核心有效成分。见图2。
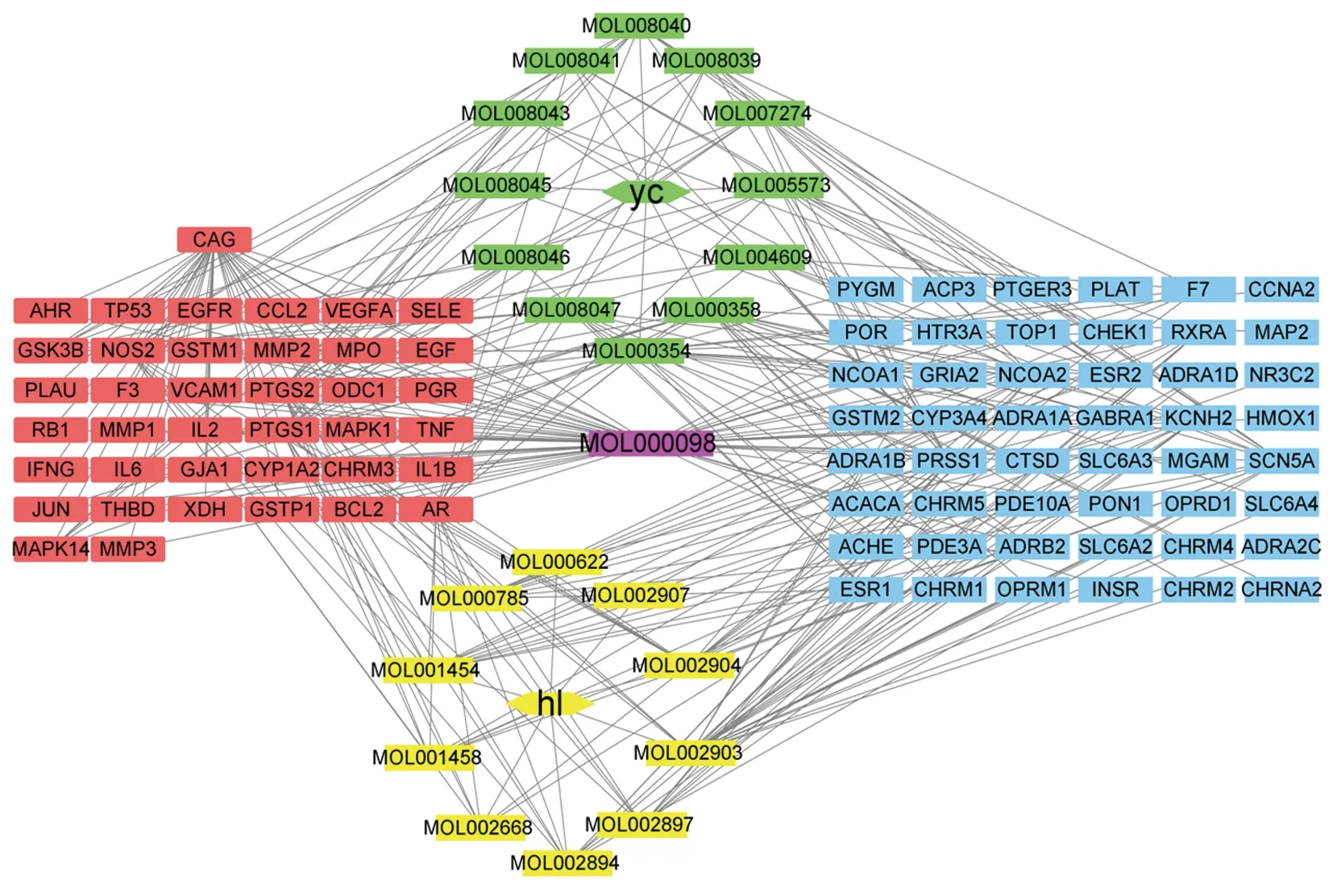
注:绿色为茵陈所属化合物,黄色为黄连所属化合物,紫色为黄连-茵陈共有化合物,红色为化合物与疾病交集靶点,蓝色为非交集靶点
2.4 PPI网络分析 将“黄连-茵陈”药对活性化合物与CAG的38个交集靶点上传到STRING 11.0数据库中进行PPI网络构建,选择“Homo sapiens”,设置high confident为0.700,得到精简PPI网络信息共有37个节点(删除1个游离靶点),178个边,其中靶点为蛋白,边为蛋白之间作用关系,平均Degree值为9.37,高于平均Degree值的靶点蛋白有16个,包括白细胞介素6(IL-6)、肿瘤坏死因子(TNF)、Ju-Nana原癌基因(JUN)、IL-1β、丝裂原活化蛋白激酶1(MAPK1)等。见图3、表2。

注:节点颜色越黄说明其Drgree值越大,颜色越蓝其Drgree值越小;节点之间连线越粗联系越紧密,越细联系越少
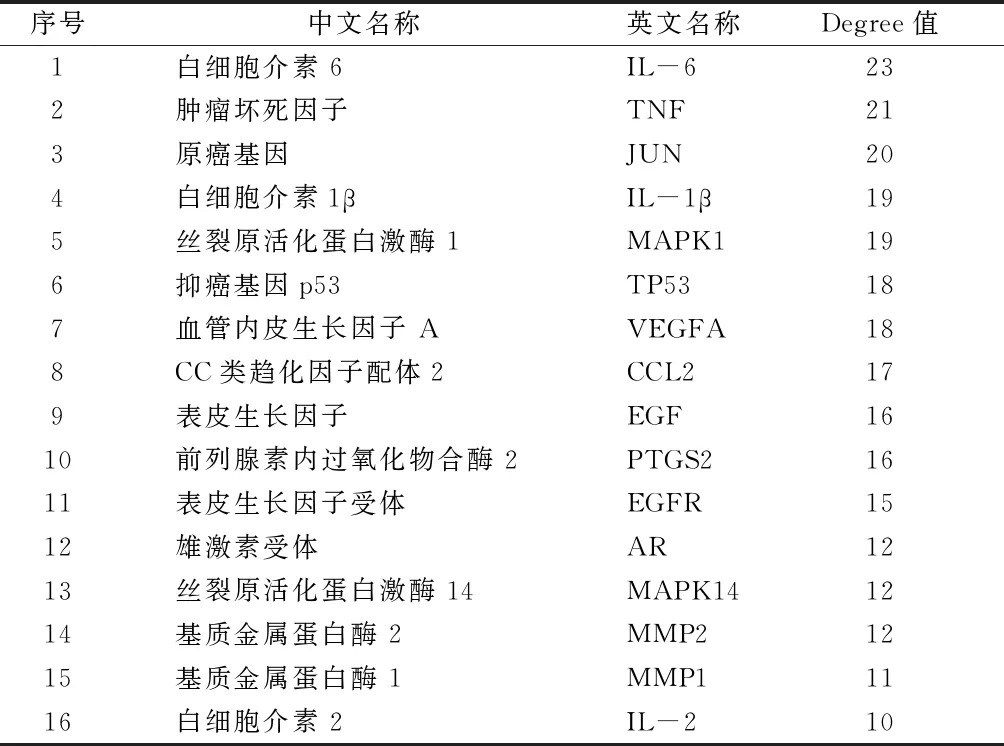
表2 PPI网络图中大于平均Degree值的靶点蛋白信息
2.5 GO功能富集分析与KEGG通路富集分析 对“黄连-茵陈”药对活性化合物与CAG的38个交集靶点分别进行GO功能富集分析与KEGG通路富集分析。通过GO功能富集分析,得到BP 98个,包括基因表达的正调控、细胞对脂多糖的反应、基因表达负调控、细胞增殖的正调控、脂多糖介导的信号通路等;CC 21个,包括细胞外空间、胞外区、细胞表面、线粒体、分泌颗粒等;MF 18个,包括酶结合、转录因子结合、细胞因子活性、过氧化物酶活性等。通过KEGG通路富集分析,得到“黄连-茵陈”治疗CAG的通路54条,包括癌症信号通路、TNF信号通路、MAPK信号通路、NF-κB信号通路、EGFR通路等。并进一步绘制了相关性较大的癌症信号通路图。见图4、5、6。
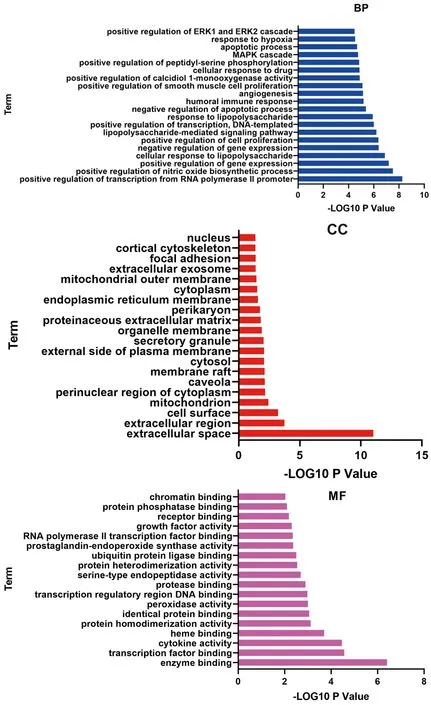
图4 交集靶点蛋白GO功能富集分析柱状图
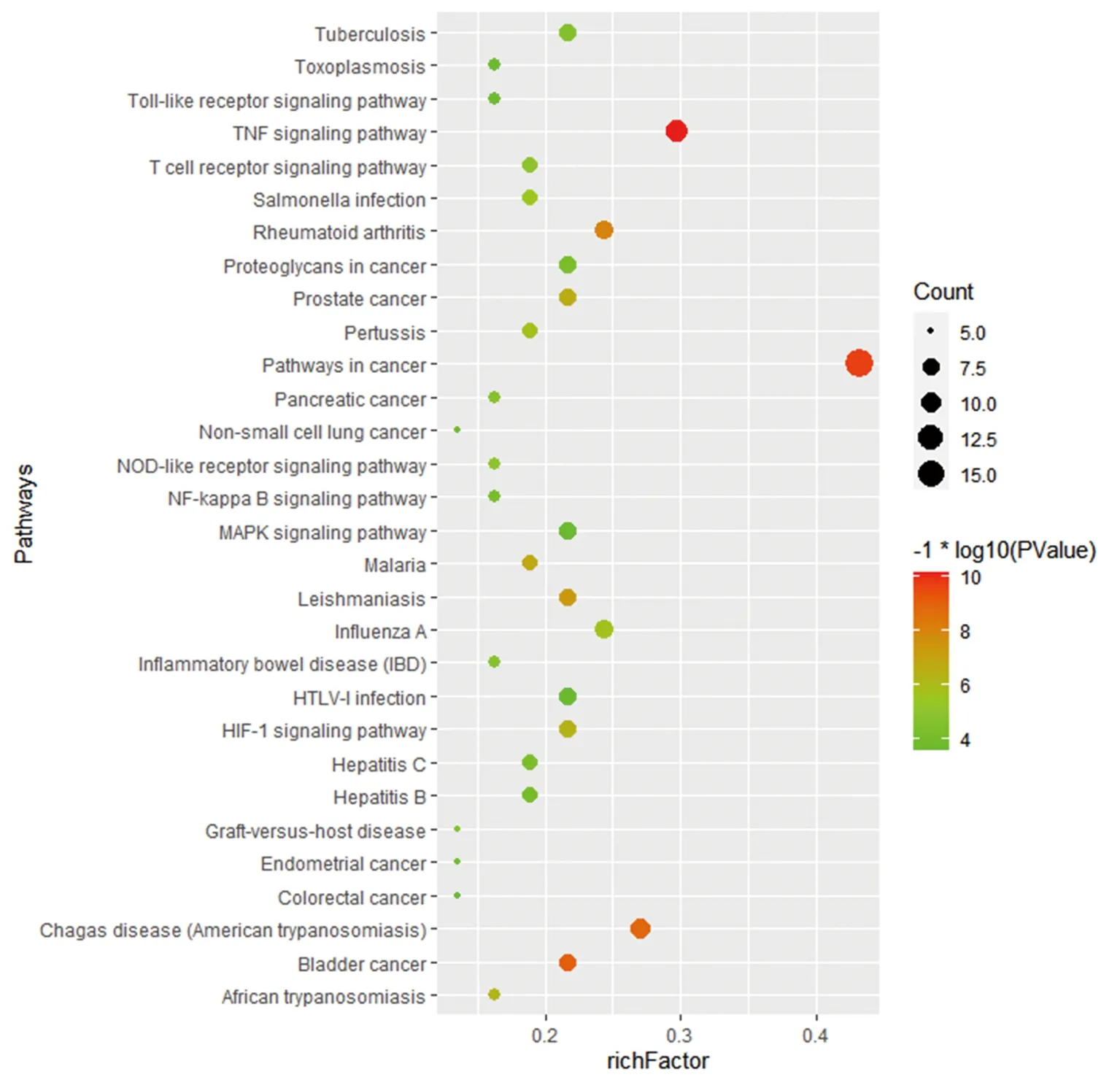
图5 交集靶点蛋白KEGG通路富集分析气泡图
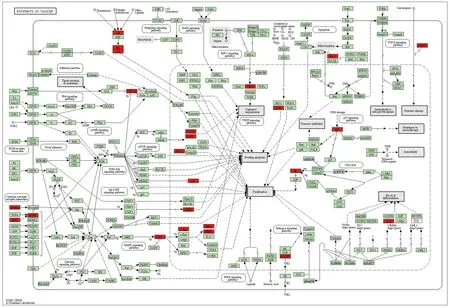
注:红色靶点为富集分析癌症信号通路所涉及基因
2.6 分子对接结果 根据“药物-化合物-靶点-疾病”全局网络中Degree值选择前5个“黄连-茵陈”有效活性化合物,包括槲皮素(MOL000098)、异鼠李素(MOL000354)、β-谷甾醇(MOL000358)、四氢小檗碱(MOL002903)、小檗浸碱(MOL002904);根据PPI网络中Degree值选择前5个核心靶蛋白,包括IL-6、TNF、JUN、IL-1β、MAPK1。将化合物活性成分与核心靶点蛋白进行分子对接以计算其结合能,化合物与靶蛋白结合能越低,其结合越稳定,越可能相互作用,且结合能量<0代表两者结合有活性,结合能小于-5 kJ/mol代表结合能活性较高,并对结合能活性较强的2组化合物和蛋白分子对接模式可视化。见图7、8、9。
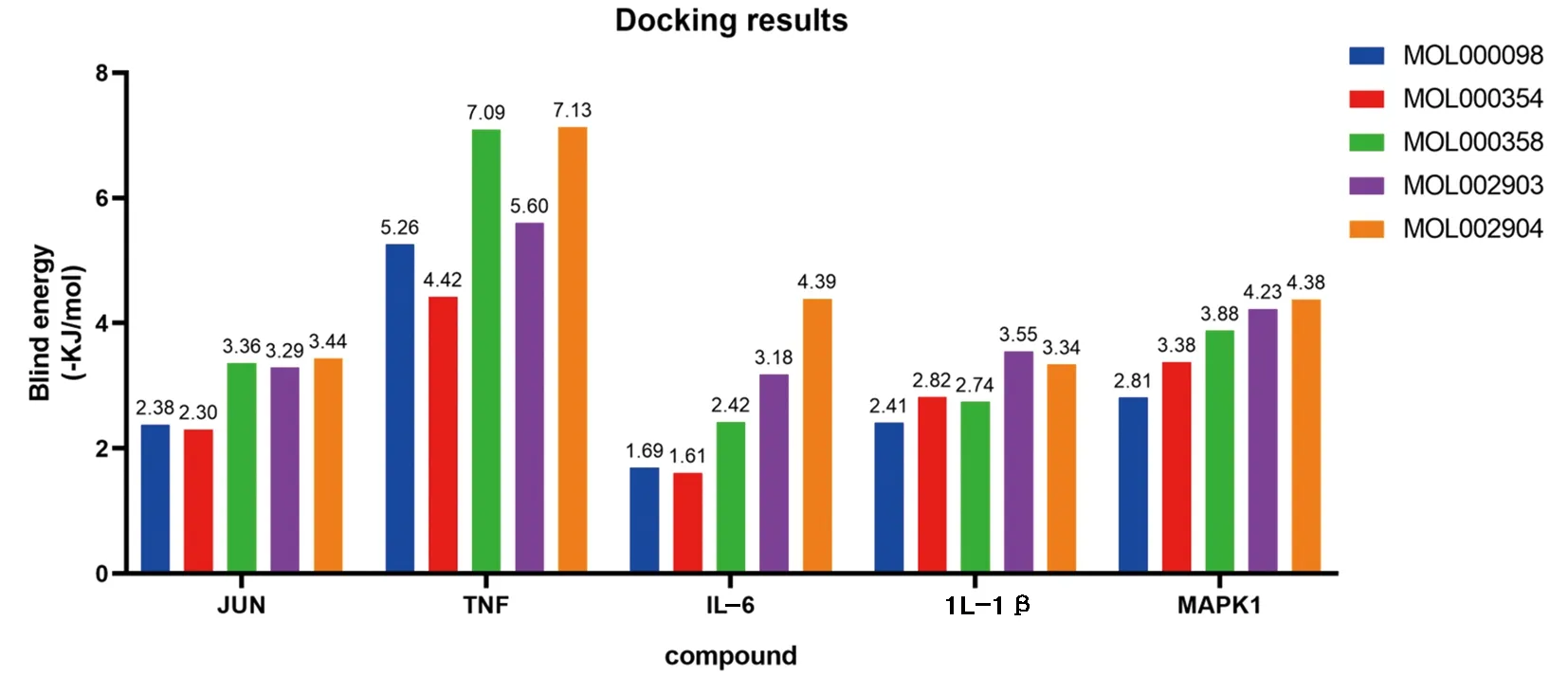
图7 化合物活性成分与核心靶点蛋白分子对接结合能柱状图
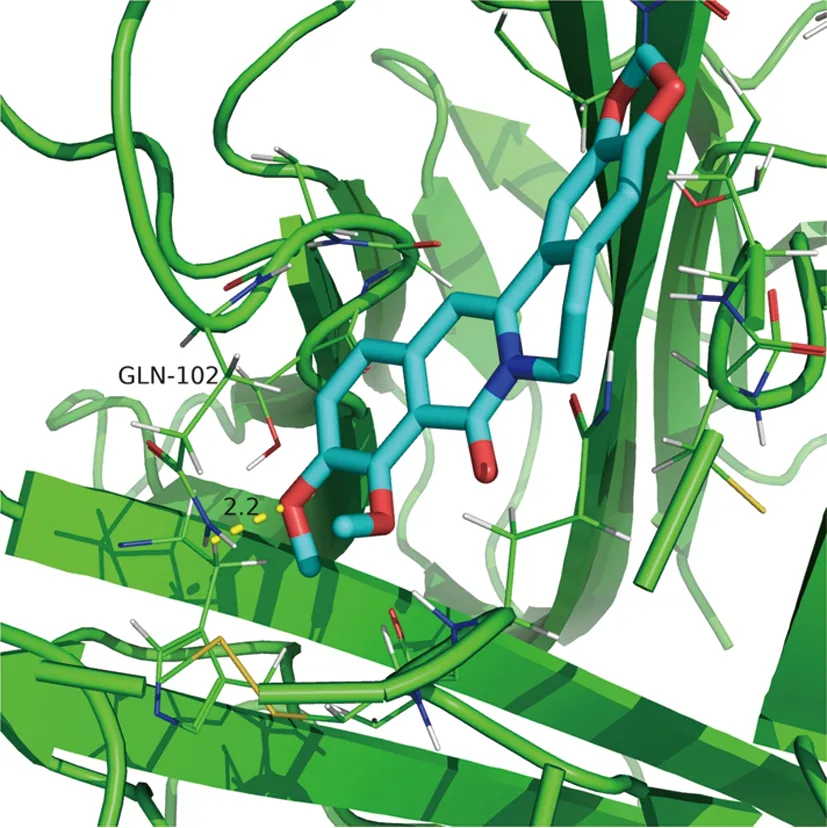
图8 小檗浸碱与TNF对接结果
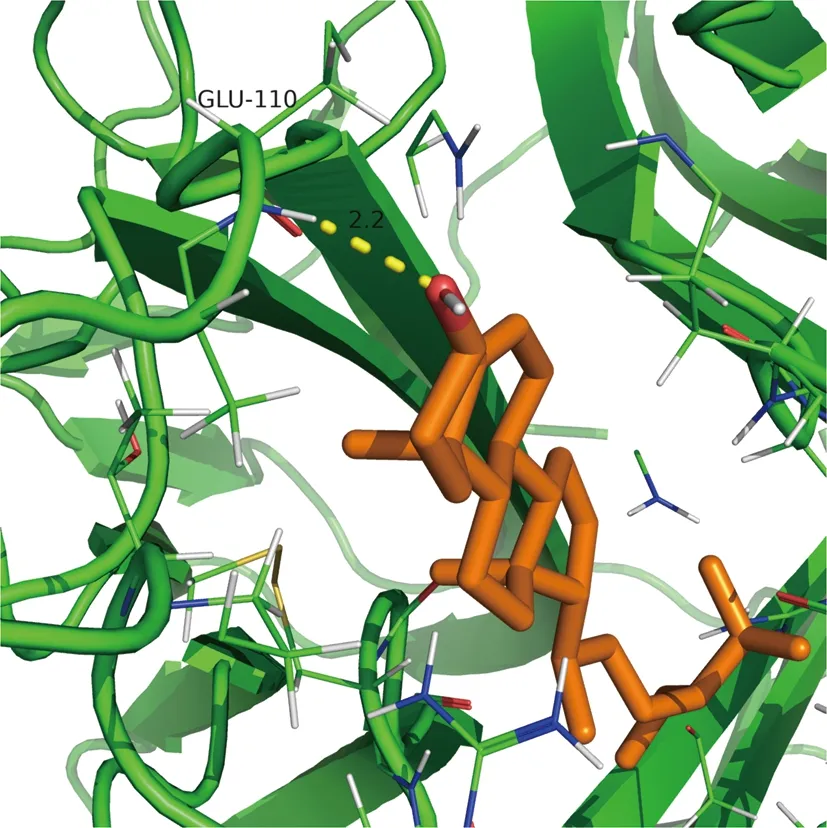
图9 β-谷甾醇与TNF对接结果
3 讨论
我国是胃癌的高发国家,其发病率和死亡率均位居前列,且其症状和疾病进展程度不完全相符,胃癌早期患者并无特殊症状,因此CAG作为胃癌前病变一直都是临床关注的重点。现代医学研究认为,幽门螺杆菌(Hp)是CAG发生的主要病因之一,Hp的致病因素包括脲酶、鞭毛、空泡毒素A(VacA)、细胞毒素相关基因抗原(CagA)等,其中VacA和CagA起着关键作用,感染VacA阳性菌株可导致细胞空泡化和凋亡,而感染CagA阳性菌株则可导致严重的胃炎和胃癌。CagA是一种关键的毒力因子,可以通过启动细胞核因子κB(NF-κB)、MAPK及细胞质蛋白酪氨酸磷酸酶/细胞外调节蛋白激酶(SHP-2/ERK)途径,以转录和翻译环氧化酶2(COX-2)、细胞间黏附分子-1(ICAM-1)、诱导型一氧化氮合酶(iNOS)、活性氧(ROS)、IL-6、IL-8、干扰素γ(INF-γ)、TNF-α等细胞因子,从而导致广泛的炎性反应,促进胃的慢性炎症、萎缩,乃至于发展为胃癌[9]。最新的胃癌发病机制学说是“炎—癌转化机制”,该理论认为胃癌的发生发展是在胃的慢性炎症基础上伴随化生、增生而成,同时相关队列研究亦支持了该观点[10-12]。因此,及时阻断甚至逆转CAG的发展对于防止胃癌的发生有着重要的意义。现代医学对CAG治疗尚无针对性的有效办法,而中医药在阻断“炎—癌转化机制”方面颇有成效,李佃贵教授提出的化浊解毒法在CAG治疗中有着深远前景[3]。本研究通过数据库筛选及网络图构建得到“黄连-茵陈”与CAG交集靶点38个,PPI平均Degree值较高的靶点有IL-6、TNF、JUN、IL-1β、MAPK1等,与之相对应的有效活性化合物23个,其中关联频数较高的化合物为槲皮素、异鼠李素、β-谷甾醇、四氢小檗碱、小檗浸碱等。
槲皮素是黄酮类化合物,研究表明槲皮素可以抑制Hp的生长,减轻Hp感染小鼠的炎症和胃损伤,具体机制可能通过降解NF-κB因子,防止NF-κB核转位,抑制致炎因子如TNF-α、IL-1β、IL-6、IL-8的基因表达,抑制炎症介质前列腺素、白三烯的形成,阻止组胺的释放,从而发挥抗炎作用[13-15]。槲皮素还具有抗氧化作用,能缓解Hp感染产生的自由基所引起的胃黏膜细胞DNA氧化损伤[16]。
黄连中的小檗碱类成分在体内外试验中能有效消灭Hp,并能抑制Hp在生物表面上的黏附,还能抑制Hp中N-乙酰转移酶活性来控制Hp的生长[17-18]。小檗碱还可抑制促炎基因IL-6、转化生长因子β(TGF-β)、IL-1β的表达,上调黏膜和小鼠腹腔巨噬细胞中抗炎基因IL-10的表达,通过减弱B淋巴细胞活化因子触发的辅助性T淋巴细胞17(Th17)反应,减轻Hp诱导的慢性胃炎,从而发挥抗炎作用[19]。此外,小檗碱还能抑制上皮细胞凋亡,抑制炎性反应,同时降低TNF-α和iNOS水平,以减轻Hp诱导的胃黏膜炎症[20]。除了小檗碱类成分外,黄连中的棕榈碱可以通过靶向调控脲酶活性位点巯基来发挥抗Hp作用,从而抑制脲酶活性和脲酶成熟,减缓Hp对胃黏膜损伤[21]。
TNF-α是一种促炎细胞因子,能促进IL-1、IL-6的产生,加强炎性反应,还有促进细胞分化和增殖的作用。TNF-α可以通过抑制糖原合酶激酶3β(GSK3b)来促进胃上皮细胞中的神经紧张蛋白信号传导[22]。此外,在肿瘤微环境中TNF-α/1型肿瘤坏死因子受体(TNF-α/TNFR1)信号的激活,可通过诱导还原型辅酶Ⅱ氧化酶组织者1(Noxo1)和鸟嘌呤核苷酸结合蛋白α14(Gna14)促进胃肿瘤的发展,这有助于维持肿瘤细胞处于未分化状态[23]。
IL-6最初作为B淋巴细胞刺激因子,既能诱导单纯CD4+T淋巴细胞分化为Th17细胞,又可抑制调节性T淋巴细胞(Treg)发育,从而促进胃黏膜炎症的发展。Hp感染的早期胃癌,IL-6水平也高于无Hp感染,根除Hp后IL-6水平显著下降[24]。此外,Hp可诱导ROS的产生,并通过刺激IL-6上调来调节信号转导和转录激活因子3(STAT3)激活,从而促进细胞生长,并刺激生长因子产生,促进细胞增殖、迁移和致癌转化[25]。
IL-1β基因的多态性和IL-1β产生的增加与Hp感染相关胃癌的风险有关,Hp感染与IL-1β基因多态性协同作用,不仅参与胃癌前病变,还可以通过下调氢-钾-ATP酶(H+-K+-ATP)和抑制胃泌素的表达,抑制胃酸分泌来促进胃癌的发生[26]。同时,IL-1β还通过激活NF-κB增加癌细胞的侵袭,从而增强基质金属蛋白酶-9(MMP-9)表达[27]。有研究发现,IL-1β通过MAPK和ROS刺激IL-8的表达,参与胃癌的血管重建[28]。
MAPK1又称细胞外信号调节激酶,是MAPK家族的一个成员,主要负责生长因子受体的信号传导。MAPK通路参与了胃癌和正常上皮细胞的细胞运动调节,调节胃癌中MMP的活性,从而影响细胞迁移和侵袭[29]。此外,磷酸化的MAPK1可激活NF-κB从胞浆转运到细胞核,进一步激活IL-8基因表达,IL-8常被认为是CAG的诊断标记物[30]。MAPK1还可以调节胃上皮细胞的周期进展、增殖,MAPK1活性的抑制则会导致细胞周期G0/G1阶段阻滞[31]。
MAPK14又称p38,参与细胞生长、分化、细胞周期进展和细胞凋亡,以及炎症过程。研究表明,MAPK14信号参与调节上皮间质转化(EMT)和EMT触发的ROS的产生[32]。MAPK14还可诱导p60和p55亚基的表达,形成NF-κB二聚体,激活NF-κB通路[33]。
EGFR属于受体酪氨酸激酶群,EGFR信号通路通常在细胞增殖、分化和生长中发挥重要作用。Hp感染与表皮细胞生长因子(EGF)激活和EGFR表达上调有关,可增强细胞的运动性,导致癌细胞的侵袭和转移[34],EGFR激活后还可通过其下游靶点Akt和B淋巴细胞瘤-2(Bcl-2)家族成员,发挥抗胃上皮细胞凋亡作用[35]。Hp可激活胃上皮细胞肝素结合性表皮生长因子(HB-EGF)基因表达和EGFR酪氨酸磷酸化,触发EGFR信号激活,从而促进IL-8的产生,并启动胃上皮细胞的肿瘤转化[36]。Hp菌株还可通过HB-EGF、EGF受体诱导激活胃泌素启动子[37],Hp刺激后的HB-EGF、MMP-7及胃泌素协同介导胃癌患者EMT激活并导致基质浸润[38]。
Hp诱导MAPK的激活和原癌基因c-Fos、c-Jun活化,参与了胃上皮细胞的癌转化,促进腺癌的发生[39]。肿瘤抑制因子p53控制着细胞对DNA损伤和致癌应激的反应,Hp诱导的p53失调是增加感染个体胃癌风险的潜在机制[40]。VEGFA是炎症和肿瘤相关血管生成的关键调节因子,Hp可以激活VEGFA基因表达,其主要是通过MAPK、c-Jun氨基末端激酶(JNK)及NF-κB等多种信号途径调控[41]。
通过分析“黄连-茵陈”药对治疗CAG的KEGG通路富集分析得到相关通路54条,涉及癌症信号通路、TNF信号通路、MAPK信号通路、NF-κB信号通路EGFR信号通路等。MAPK通路主要介导宿主细胞基因转录、有丝分裂、运动、黏附、代谢及细胞凋亡。Hp感染和MAPK激活的联合作用很可能会导致胃上皮细胞细胞周期进展、增殖及凋亡的改变[29]。NF-κB是一种重要的转录因子,通过调节致炎细胞因子和趋化因子基因的表达,参与多种免疫或炎性反应的激活,Hp已被证明可以激活胃癌细胞中NF-κB,并使炎细胞因子的表达增加[9]。TNF家族是一类多功能促炎细胞因子,可激活与细胞存活、凋亡、分化炎性反应相关的信号通路。EGFR信号通路通常在细胞增殖、分化和生长中发挥重要作用[34]。Hp感染与EGF的激活和EGFR表达的上调有关,增强了细胞的运动性以及导致了癌症的侵袭和转移[34]。
化浊解毒法是国医大师李佃贵教授依据客观的理论基础和长期的临床实践,提出治疗CAG的辨治观点,其认为因徒清热解毒则湿浊不去,徒化浊利湿则热毒不除,而化浊解毒法的运用可使毒除浊化,可达气行血畅,积除郁解,痰消火散,恢复脾升胃降之生理功能,脾气上升,胃之津液得下,胃气和降,胃得阴血濡养,萎缩的腺体可缓慢恢复正常[42-43]。本研究基于网络药理学与分子对接技术对“黄连-茵陈”药对抗CAG的活性成分、潜在靶点和作用机制进行了初步预测。从26种化合物中筛选得与CAG的交集靶点38个,这些靶点可能通过抗炎、抗氧化、正向调控细胞凋亡、负向调控血管内皮增生、保护细胞外基质等方面实现治疗作用。本研究还挖掘了54条“黄连-茵陈”药对防治CAG的潜在信号通路,涉及炎症/感染、表观遗传、细胞分化和生长周期等。本研究证明了 “黄连-茵陈”药对治疗CAG的机制涉及多靶点、多通路和多途径,而且靶点和信号通路之间互有调控、交叉、协同,形成一个复杂的信号网络系统,也对“黄连-茵陈”药对治疗CAG的具体分子信号通路进行了初步揭示,为下一步的实验研究、药物研发提供了理论基础。鉴于网络药理学和分子对接技术还没有完善,后期仍需具备相应科研能力的团队开展动物实验验证所得的结果。
