紫檀芪对脑缺血再灌注大鼠的治疗作用
2023-05-07王星淇范月超卢红建
龚 亮,贾 衡,王星淇,范月超,卢红建
1.徐州医科大学附属医院神经外科,徐州 221000;2.南通市第二人民医院,南通 226006
脑卒中是临床常见的重症神经系统疾病,致残率、复发率、病死率均较高[1]。80%以上的脑卒中为缺血性脑卒中,多发于50岁以上的中老年人群,年新发患者数超过200万例,且呈现出年轻化的趋势[2]。目前,临床对缺血性脑卒中尚无有效治疗手段,通常采用纤溶酶原激活剂溶栓配合再灌注治疗,但其对患者发病时间窗有严格限制,仅能使少数患者获益,且无法避免后续发生脑缺血再灌注(ischemia/reperfusion,I/R)损伤[3]。因此,针对缺血性脑卒中,预防性治疗的意义更大。紫檀芪是一种分布广泛的植物抗毒素,化学结构类似白藜芦醇,且利用率高、合成简单,具有抗癌、抗炎、抗氧化、抗衰老等多种生物学活性。有学者认为,紫檀芪可保护神经元免受β-淀粉样蛋白的神经毒性作用、减轻认知功能障碍,从而对老年痴呆小鼠产生治疗作用[4]。但关于其对缺血性脑卒中脑保护作用及微血管新生的影响尚未明确,且缺乏对机制的研究。本研究通过建立I/R大鼠模型,观察紫檀芪对I/R大鼠的治疗作用,并探讨相关的机制。
1 仪器与材料
1.1 仪器
E200型显微镜(日本Nikon株式会社);ChemiDoc型凝胶成像仪(美国Bio-Rad公司);DYCZ-25D型电泳仪(北京六一生物科技有限公司);HP300型自动组织脱水机(深圳市达科为医疗科技有限公司);RD-315型石蜡切片机(沈阳源达鑫科技有限公司);E0987型组织包埋机(上海碧云天生物技术有限公司)。
1.2 试药
紫檀芪(质量分数98%,上海研生实业有限公司);磷脂酰肌醇3-激酶(phosphatei-dylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)抑制剂LY294002、Tunel细胞凋亡检测试剂盒均购自上海谷研实业有限公司;丙二醛(malondialdehyde,MDA)、活性氧簇(reactive oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒均购自美国Sigma公司;兔抗大鼠CD34、AKT、p-AKT、GSK3β、p-GSK3β一抗均购自美国Chemicon公司。
1.3 动物
SPF级SD大鼠55只,雄性,8周龄,体质量(300±20) g,购自上海灵畅生物科技有限公司,生产许可SCXK(沪)2018-0003。
2 方法
2.1 模型构建
大鼠适应性饲养3 d,用改良Zea Longa线栓法建立脑I/R大鼠模型[5],用戊巴比妥钠麻醉大鼠,仰卧固定于手术台上,切开颈部暴露右颈总动脉、外动脉、内动脉,结扎颈总动脉、外动脉近心端,内动脉开口并插入硅胶线栓,造成局灶性缺血,2 h后回抽至开口处恢复血流,抗生素处理后缝合伤口,24 h用Zea Longa评分法评价大鼠神经功能:0分,无异常状态;1分,左侧前爪无法伸展完全;2分,向左侧转圈行走;3分,站立时向左侧倾倒;4分,无法站立行走。评分为1~3分视为建模成功。
2.2 分组与干预
参照文献[6-7]方法,将10只大鼠设为假手术组,剩余45只大鼠随机分为脑I/R组、紫檀芪组、联合组,每组15只;术前7 d,联合组大鼠用紫檀芪(80 mg·kg-1)DMSO溶液灌胃,2 h后腹腔注射LY294002(30 mg·kg-1)DMSO溶液;紫檀芪组大鼠用紫檀芪(80 mg·kg-1)DMSO溶液灌胃,2 h后腹腔注射等体积DMSO;假手术组、脑I/R组大鼠用等体积DMSO灌胃,2 h后腹腔注射等体积DMSO。每日1次,干预7 d。建模后脑I/R组、紫檀芪组各失败3只,联合组失败4只。假手术组大鼠仅暴露颈动脉后缝合。假手术组、脑I/R组、紫檀芪组、联合组最终分别纳入10、12、12、11只大鼠。
2.3 取材方式
确认建模成功的次日,腹腔注射戊巴比妥钠麻醉大鼠,采集腹主动脉血,用低温离心机以2 500 r·min-1离心5 min(离心半径10 cm),取血清,置于4 ℃冰箱中保存,用于氧化应激指标的检测;采血后颈椎脱臼处死大鼠,开颅取其完整大脑,切取右侧大脑组织,分成2份,一份固定于预冷的质量浓度为40 g·L-1的中性甲醛中24 h,常规脱水、浸蜡、包埋,制成厚4 μm的切片,用于观察神经元凋亡、微血管新生及病理变化;另一份投入液氮中保存,用于Western blot实验。
2.4 检测血清MDA、ROS、SOD水平
取4 ℃冰箱中保存的腹主动脉血清,根据试剂盒说明书进行操作,用比色法检测血清MDA水平,二氯荧光素法检测血清ROS水平,细胞色素C还原法检测血清SOD活性。
2.5 Tunel染色法观察海马CA1区神经元凋亡率
取大脑组织切片,常规脱蜡、水洗,根据凋亡检测试剂盒说明书操作,加入蛋白酶K后,于室温下静置20 min,微波高温修复抗原,冷却后加入新鲜配置的Tunel反应混合物,移入黑暗湿盒内37 ℃孵育1 min,PBS冲洗,滴加过氧化酶,同环境孵育30 s,PBS冲洗,DAB显色,苏木素复染,常规脱水、干燥,中性树脂封固,于显微镜下观察海马CA1区神经元凋亡情况,黄褐色细胞即为凋亡神经元,计算凋亡率。凋亡率=(黄褐色细胞数量/总神经元数量)×100%,随机选取5个不相邻的均匀视野拍照、统计,取平均值。
2.6 免疫组织化学染色法观察微血管的新生情况
取大脑组织切片,常规脱蜡,PBS冲洗,移至体积分数为3%的过氧化氢溶液中浸泡12 min,微波高温修复抗原,冷却后加入体积分数为5%的胎牛血清封闭20 min,弃血清,加入兔抗大鼠CD34一抗(1∶500),4 ℃孵育过夜,PBS冲洗,加入二抗(1∶2 000),室温孵育1 h,PBS冲洗,DAB显色,苏木素复染,常规脱水、干燥,中性树脂封固,于显微镜下观察神经微血管密度,以棕黄色单个内皮细胞或细胞群代表1个血管,随机选取5个不相邻的密集视野拍照、记录,平均值即为微血管密度(microvessel density,MVD)。
2.7 HE染色观察海马CA1区的病理学改变
取大脑组织切片,常规脱蜡、水化,苏木素染色5 min,蒸馏水冲洗,加入盐酸乙醇分化液分化,蒸馏水冲洗,NaHCO3漂洗,伊红液染色2 min,常规脱水、透明,中性树脂封固,于显微镜下观察脑组织海马CA1区的病理变化,并拍照、记录。
2.8 Western blot法检测脑组织AKT、p-AKT、GSK3β、p-GSK3β蛋白表达量
取保存于液氮中的脑组织,研磨后加入PBS制成匀浆,加入RIPA裂解液,移至离心管内,置于低温离心机中以8 000 r·min-1离心12 min(离心半径15 cm),取上清,用BCA法定量蛋白。取40 μg蛋白样本,加入4倍体积上样缓冲液,混合均匀,80 V电压下进行电泳分离,湿法转膜,加入体积分数5%的脱脂牛奶封闭2 h,TBST清洗,加入兔抗大鼠AKT、p-AKT、GSK3β、p-GSK3β一抗(1∶500),4 ℃摇床中孵育过夜,TBST清洗,加入二抗(1∶2 000),室温孵育2 h,ECL发光,暗室显影,用凝胶成像仪分析蛋白条带的灰度值。蛋白的相对表达量=蛋白条带的灰度值/内参GAPDH条带的灰度值。计算p-AKT/AKT、p-GSK3β/GSK3β。
2.9 统计学方法
3 结果
3.1 神经功能评分比较
与脑I/R组比较,紫檀芪组神经功能评分降低(P<0.05);与紫檀芪组比较,联合组神经功能评分升高(P<0.05)。结果见表1。
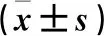
表1 各组大鼠神经功能评分的比较
3.2 血清MDA、ROS、SOD水平比较
与假手术组比较,脑I/R组血清MDA、ROS水平升高,SOD活性降低(P<0.05);与脑I/R组比较,紫檀芪组血清MDA、ROS水平降低,SOD活性升高(P<0.05);与紫檀芪组比较,联合组血清MDA、ROS水平升高,SOD活性降低(P<0.05)。结果见表2。
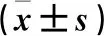
表2 各组大鼠血清氧化应激指标MDA、ROS、SOD水平的比较
3.3 海马CA1区神经元凋亡率比较
假手术组、脑I/R组、紫檀芪组、联合组海马CA1区神经元的凋亡率分别为(3.14%±0.57%)、(19.68%±2.46%)、(5.11%±0.77%)、(12.30%±2.39%),与假手术组比较,脑I/R组海马CA1区神经元的凋亡率升高(P<0.05);与脑I/R组比较,紫檀芪组海马CA1区神经元的凋亡率降低(P<0.05);与紫檀芪组比较,联合组海马CA1区神经元的凋亡率升高(P<0.05)。结果见图1。

注:A.假手术组;B.脑I/R组;C.紫檀茋组;D.联合组。
3.4 MVD比较
假手术组、脑I/R组、紫檀芪组、联合组的MVD分别为(3.00±0.47)、(10.40±3.15)、(22.60±3.42)、(15.20±2.98) 个·mm-2,与假手术组比较,脑I/R组的MVD升高(P<0.05);与脑I/R组比较,紫檀芪组的MVD升高(P<0.05);与紫檀芪组比较,联合组的MVD降低(P<0.05)。结果见图2。

注:A.假手术组;B.脑I/R组;C.紫檀茋组;D.联合组。红色箭头指示为新生血管。
3.5 海马CA1区的病理改变比较
HE染色结果显示,假手术组神经元排列整齐、结构完整,细胞质染色均匀,细胞核清晰,无水肿,核固缩;模型组神经元排列紊乱、疏松,层次不清,细胞质深染,细胞核固缩且周围出现空泡;紫檀芪组、联合组正常神经元数量增加,神经元轮廓清晰、破坏程度减轻,核周围空泡及核固缩有所改善,其中紫檀芪组病理改变的改善更明显。结果见图3。
3.6 脑组织p-AKT/AKT、p-GSK3β/GSK3β比较
与假手术组比较,脑I/R组脑组织p-AKT/AKT、p-GSK3β/GSK3β降低(P<0.05);与脑I/R组比较,紫檀芪组脑组织p-AKT/AKT、p-GSK3β/GSK3β升高(P<0.05);与紫檀芪组比较,联合组脑组织p-AKT/AKT、p-GSK3β/GSK3β降低(P<0.05)。结果见表3、图4。
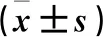
表3 各组大鼠脑组织p-AKT/AKT、p-GSK3β/GSK3β的比较

注:A.假手术组;B.脑I/R组;C.紫檀茋组;D.联合组。
4 讨论
缺血性脑卒中是指部分脑组织因血液循环不畅而发生缺血性坏死的一种急性脑血管疾病,脑部动脉粥样硬化及由血栓诱发的管腔闭塞、血流量骤减是导致其急性发病的直接原因,血压不稳、糖尿病、高脂血症、吸烟、饮酒、不良饮食习惯、强体力活动是导致其发生的主要危险因素[8]。脑组织缺血后因细胞能量代谢障碍而迅速激活缺血级联反应,导致I/R,可疏通血管、促进神经功能恢复,但将再次损伤脑组织,扩大脑梗死的面积,甚至发展为肺部感染、肾功能衰竭、脑心综合征、体温调节障碍等,危及患者生命[9]。I/R损伤是一个多因素反应叠加的过程,与氧自由基激增、钙离子超载、血脑屏障破坏、炎性因子增多等密切相关,其中氧化应激反应过度被认为是其核心机制之一[10-11]。I/R过程生成大量不同种类的活性氧,氧化-抗氧化平衡被破坏,过量的活性氧引发细胞膜脂质过氧化,血脑通透性增大,同时介导炎性因子生成,促进神经元凋亡,进一步破坏脑组织[12]。
中医对缺血性脑卒中研究已久,将其归于“中风”范畴,列为“风、痨、臌、膈”4大病症之首,认为其主要病机为人过半百、正气自虚、阴精亏损、肝气不畅、经脉痹阻、肝火上犯,进而毒侵脑络、神机失用,发为麻木不仁、张口不闭、神志不清、口眼斜之症,其本在肝,故治疗应以护肝解毒、活血化瘀为主[13]。紫檀是我国名贵中药,取自豆科植物紫檀干燥心材,性平,味咸,入足厥阴肝经,可解毒、祛瘀、止血,明代医典《普济方》记载,紫檀可治大风肌肤不仁、头而生疮、颜色肿黑、腹内生虫、鼻柱崩倒[14]。紫檀芪是一种天然抗氧化剂,最早发现于紫檀中,可清除氧自由基、抑制氧自由基活性,减轻氧化应激损伤[15-16]。LIU J等[17]研究发现,紫檀芪可降低I/R大鼠脑含水量、缩小梗死面积、增加成熟神经元数量、抑制氧化应激反应、缓解I/R损伤,表明紫檀芪具有治疗缺血性脑卒中的潜在价值。本研究的结果显示,与脑I/R组比较,紫檀芪组神经状态评分,血清MDA、ROS水平,海马CA1区神经元凋亡率均降低,SOD活性、MVD升高,表明紫檀芪可改善神经功能、抑制氧化应激及神经元凋亡、促进微血管新生。
PI3K/AKT/GSK3β通路是重要的抗凋亡信号通路之一,在细胞增殖、分化、凋亡等活动中扮演重要角色[18]。AKT是一种保守调节激酶,可直接调控下游底物蛋白的浓度,调控细胞活动过程,GSK3β是AKT的下游靶蛋白之一,直接参与调节神经元存活及凋亡过程,PI3K被活化后,将AKT转移至细胞膜从而磷酸化,p-AKT可转移至细胞质及细胞核,促进GSK3β转移及磷酸化失活,降低氧化酶活性,抑制氧化应激反应,从而发挥抑制神经元凋亡、保护脑组织的作用[19-20]。ZHANG Z等[21]研究发现,激活PI3K/AKT/GSK3β通路可以减弱氯胺酮的神经毒性,保护幼鼠海马组织,抑制神经元凋亡。本研究的结果显示,与假手术组比较,脑I/R组脑组织p-AKT/AKT、p-GSK3β/GSK3β降低,经紫檀芪干预后均升高,且在紫檀芪基础上增用PI3K/AKT/GSK3β通路抑制剂LY294002可减弱紫檀芪对I/R大鼠的治疗作用,表明PI3K/AKT/GSK3β通路在I/R大鼠中的活性异常降低,紫檀芪可能通过激活该通路对I/R大鼠产生治疗作用。
综上所述,紫檀芪可改善I/R大鼠的神经功能、抑制氧化应激及神经元凋亡、促进微血管新生,推测其作用机制与激活PI3K/AKT/GSK3β信号通路有关。
