姜黄素改善七氟烷致老年大鼠认知功能障碍的机制
2023-05-07李小娜樊少卿赵二贤许宏侠
李小娜,樊少卿,赵二贤,许宏侠
1.河南中医药大学第二附属医院日间手术室,郑州 450002;2.郑州大学第一附属医院麻醉与围术期医学部,郑州 450000;3.河南大学第一附属医院老年病科,开封 475000
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是术后常见的并发症,多发于中老年患者且集中发生于术后1周左右[1]。七氟烷吸入麻醉因术后苏醒平稳、迅速,对肝肾循环影响较小和对呼吸道作用温和等,故常用于老年患者的麻醉[2]。但七氟烷会对神经系统造成一定程度的损伤,且严重影响海马区神经细胞,导致患者出现认知功能障碍、学习能力减退等症状[3],对术后预后的影响极大。姜黄素(curcumin)是一种多酚类物质,提取自姜黄、郁金、莪术的根茎,具有抗炎、抗肿瘤、抗凋亡、调节血脂等药理作用[4]。姜黄素能够通过减轻炎症反应,缓解神经损伤,但其机制尚不明确[5]。本研究通过建立POCD大鼠模型,探讨姜黄素对认知功能障碍的修复作用及可能的作用机制,为姜黄素药物的开发及POCD的临床治疗提供参考。
1 仪器与材料
1.1 仪器
SpectraMax M5型多功能酶标仪(美国Molecular Devices公司);荧光定量PCR仪(美国Bio-Rad公司);Hema9500型基因扩增仪(广东黑马医学仪器有限公司)。
1.2 试药
姜黄素(质量分数≥98%,上海易恩化学技术有限公司);肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒,均购自北京雅安达生物科技有限公司;兔抗鼠β-actin多克隆抗体,兔抗大鼠磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B(protein kinase B,AKT)、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK3β)多克隆抗体,山羊抗兔二抗IgG,均购自北京雅安达生物科技有限公司。
1.3 动物
60只18月龄SPF级雄性SD大鼠,体质量220~250 g,由浙江维通利华实验动物技术有限公司提供,合格证号:SCXK(浙)2019-0001。饲养条件:光/暗周期12 h,温度(22±2) ℃,环境相对湿度为50%±10%。适应性饲养7 d,可自由获取食物和水,垫料每日进行更换。实验过程中对动物的各种处置均符合实验动物委员会有关动物的使用及伦理学规定。
2 方法
2.1 造模与分组
60只18月龄SD雄性大鼠随机分为模型组(12只)、姜黄素低剂量组(12只)、姜黄素中剂量组(12只)和姜黄素高剂量组(12只),另设对照组(12只)。每日上午同一时间,姜黄素低、中和高剂量组分别用50、150和300 mg·kg-1姜黄素混悬液[6-8](用生理盐水配制)灌胃,对照组及模型组给予等量生理盐水灌胃。每日下午同一时间,采用七氟烷吸入麻醉法建立POCD模型[9],将所有大鼠放入麻醉箱,除对照组外麻醉箱内以空气为载体,流速设置为2 L·min-1,持续时长为3 h,对照组大鼠置于麻醉箱内,给予同流速空气,每日1次,连续处理14 d。
2.2 标本采集
末次给药后,腹腔注射戊巴比妥钠进行麻醉,翻正反射消失后,迅速打开腹腔。经腹主动脉采集血液,静置30 min,于4 ℃下以3 000 r·min-1离心15 min,分离血清,-20 ℃保存。冰上断头处死大鼠,打开头骨,完整取出大鼠脑组织。使用预冷的生理盐水冲洗血液,快速分离出海马组织,将部分海马组织浸入多聚甲醛溶液中固定24 h备用,剩余海马组织封存于无菌冻存管内,-80 ℃保存备用。
2.3 Morris水迷宫实验
分别于给药后1、3和7 d,待大鼠清醒后进行Morris水迷宫实验测定大鼠学习记忆能力,每日5次,每次间隔5 min。水温设定为22~26 ℃,依次将大鼠从4个象限入水点放入水中,记录大鼠找到隐藏平台的时间,该时长即为逃避潜伏期。当大鼠到达平台时,摄像系统停止拍照记录,整理并分析大鼠逃避时长。撤去平台,使大鼠重新入水,自由游泳120 s,记录大鼠穿越平台的次数。实验过程中,保持室温与水温一致,室内环境相同,以排除环境因素的干扰。
2.4 血清炎症因子水平测定
取大鼠血清,室温静置20 min,按照TNF-α、IL-1β和IL-6 ELISA试剂盒说明书中的步骤操作,先设置对照孔与样本孔,于对照孔中加入不同质量浓度的对照品50 μL,样本孔中加入样品稀释液40 μL。每孔中再加入酶标试剂100 μL,密封酶标板,37 ℃孵育60 min。甩干废液,加入20倍稀释洗涤液,反应5 s,清洗5次。每孔中加入显色剂A与B,37 ℃避光孵育20 min,再于每孔中加入终止液终止反应。15 min内用全波长酶标测试仪检测各孔450 nm处的吸光度值,根据对照品质量浓度绘制标准曲线,计算样品的质量浓度。
2.5 海马组织HE染色观察
取已固定的海马组织,用PBS溶液洗涤3次,梯度乙醇脱水,置于二甲苯中透明。再分别将组织浸入软蜡和硬蜡中进行包埋,待石蜡完全凝固后取出包埋盒,使用切片机先将组织石蜡块粗略修形,再切成厚度为5 μm的薄片,展片晾干,置于37 ℃下烘烤过夜。滴加苏木精染色溶液染色2 min,流水清洗,盐酸乙醇溶液分化,流水清洗,伊红乙醇溶液浸染1 min,流水冲洗,再次脱水透明,最后用中性树胶封片。置于光学显微镜下观察海马组织的病理变化,采集图像进行分析。
2.6 海马组织TUNEL染色
取出制备好的海马组织切片,置于室温平衡温度后,用PBS溶液洗涤3次。放入用Triton X与柠檬酸钠配制的渗透液中10 min,PBS溶液冲洗,添加TUNEL反应混合物,37 ℃孵育60 min,PBS溶液洗涤3次,每次3 min,浸入DAPI培养液中15 min,使用荧光显微镜拍摄图像,观察海马组织神经细胞的凋亡情况,统计细胞总数量和细胞核呈棕黄色或棕褐色的凋亡阳性细胞数量,计算细胞凋亡率。细胞凋亡率=(阳性细胞数量/总细胞数量)×100%。
2.7 PI3K、AKT、GSK3β mRNA的表达水平
将海马组织研磨后置于EP管内,根据海马组织量加入RNAAiso Plus,适当吹打后进行匀浆处理,4 ℃以12 000 r·min-1离心15 min提取总RNA。用分光光度计检测RNA质量分数并计算最终质量分数。配制反转录反应体系合成cDNA,完成逆转录的cDNA样品用于配制20 μL反应体系进行PCR扩增,按照说明书配制相应的cDNA Real-PCR,引物序列见表1。配制QPCR-20 μL反应体系:2×SuperReal PreMix Plus 10 μL,上、下游引物各0.6 μL,50×ROX Reference Dye 2.0 μL,DNA模板1.0 μL,过氧化氢5.8 μL。反应条件:95 ℃预变性15 min,95 ℃ 10 s,60 ℃退火20 s,72 ℃延伸20 s,40个循环。扩增反应结束后,读取各样本与内参基因的Ct值,用2-△△CT法计算各样本中各基因的相对表达量。

表1 RT-PCR引物序列
2.8 PI3K、AKT、GSK3β蛋白的表达水平
将海马组织剪碎后加入RIPA裂解液,充分裂解30 min,4 ℃以12 000 r·min-1离心15 min,吸取上清液用BCA蛋白试剂盒检测总蛋白浓度。确定蛋白上样量,将40 μg蛋白样品加入聚苯烯酰胺凝胶中,恒压120 V电泳至溴酚蓝底部。转至PDVF膜上并置于脱脂奶粉中封闭60 min,加入一抗(1∶1 000),4 ℃孵育过夜。用TBST缓冲液清洗3次,每次10 min。加入二抗(1∶5 000),室温孵育60 min,用TBST缓冲液清洗3次,每次10 min。滴加ECL显色A液和B液,置于暗室中显影和定影,以β-actin为内参,计算相应蛋白的表达量。
2.9 统计学方法
3 结果
3.1 Morris水迷宫行为学评分的比较
与对照组比较,模型组大鼠术后1、3和7 d逃避潜伏期明显延长,跨台次数减少(P<0.05)。与模型组比较,姜黄素高、中、低剂量组大鼠术后1、3和7 d逃避潜伏期明显缩短,跨台次数增加(P<0.05)。与姜黄素低剂量组比较,姜黄素中剂量组和高剂量组大鼠术后1、3和7 d逃避潜伏期明显缩短,跨台次数增多,且高剂量组的变化更为明显(P<0.05)。结果见表2。
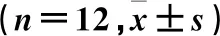
表2 各组大鼠Morris水迷宫行为学评分的比较
3.2 血清炎症因子水平的比较
与对照组比较,模型组大鼠血清中TNF-α、IL-1β和IL-6的水平升高(P<0.05)。与模型组比较,姜黄素低、中和高剂量组大鼠3项指标均降低(P<0.05)。与姜黄素低剂量组比较,姜黄素中、高剂量组大鼠3项指标均降低,且高剂量组的变化更为明显(P<0.05)。结果见表3。
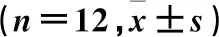
表3 各组血清炎症因子水平的比较
3.3 HE染色结果的比较
对照组大鼠海马组织CA1区神经细胞的结构完整、清晰,排列紧密有序,神经元数量较多,结构完整;细胞核呈蓝紫色,细胞质呈淡紫色,染色均匀。模型组大鼠海马组织CA1区神经细胞的结构被破坏,排列散乱无序,神经元数量减少,细胞核皱缩明显,染色不均。与模型组比较,姜黄素低、中和高剂量组大鼠海马组织CA1区神经细胞结构受损的现象得到改善,可见神经细胞结构较清晰、完整,排列紧密,神经元数量增多,结构较为完整。结果见图1。
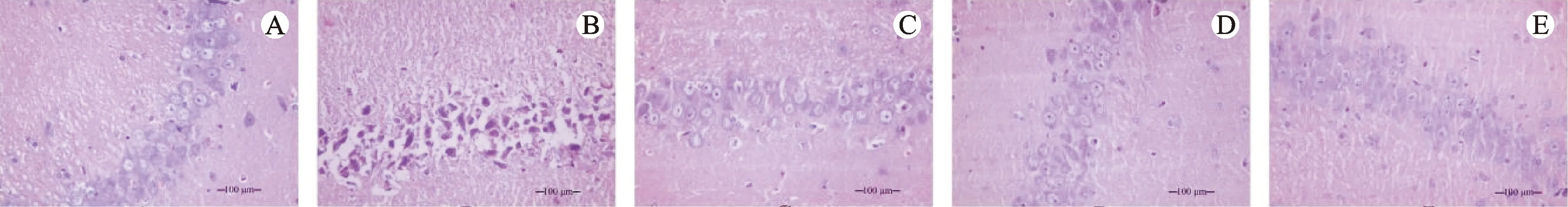
注:A.对照组;B.模型组;C.姜黄素低剂量组;D.姜黄素中剂量组;E.姜黄素高剂量组。
3.4 神经细胞凋亡率的比较
与对照组比较,模型组大鼠海马组织CA1区神经细胞的凋亡率升高(P<0.05)。与模型组比较,姜黄素高、中、低剂量组大鼠海马组织CA1区神经细胞的凋亡率降低(P<0.05)。与姜黄素低剂量组比较,姜黄素中和高剂量组大鼠海马组织CA1区神经细胞的凋亡率降低,且高剂量组的变化更为明显(P<0.05)。结果见表4、图2。
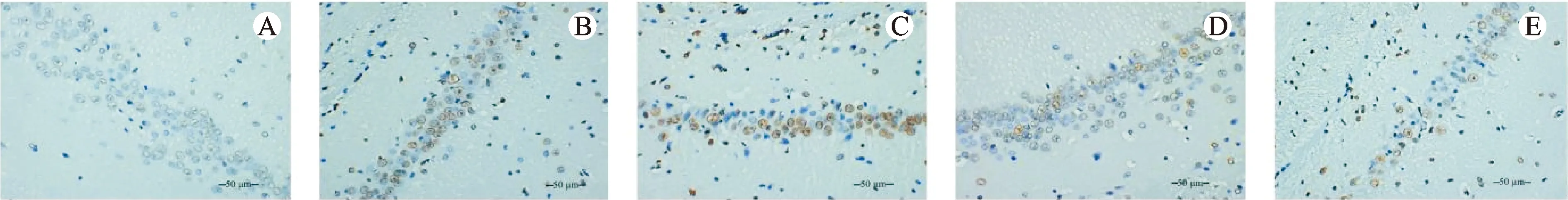
注:A.对照组;B.模型组;C.姜黄素低剂量组;D.姜黄素中剂量组;E.姜黄素高剂量组。
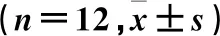
表4 大鼠海马组织神经细胞凋亡率的比较
3.5 PI3K、AKT、GSK3β mRNA水平的比较
与对照组比较,模型组大鼠海马组织PI3K和AKT mRNA的表达水平降低,GSK3βmRNA的表达水平升高(P<0.05)。与模型组比较,姜黄素高、中、低剂量组大鼠海马组织PI3K和AKT mRNA的表达水平升高,GSK3βmRNA的表达水平降低(P<0.05)。与姜黄素低剂量组比较,姜黄素中剂量组和高剂量组大鼠海马组织PI3K和AKT mRNA的表达水平升高,GSK3βmRNA的表达水平降低,且姜黄素高剂量组的变化更为明显(P<0.05)。结果见表5。
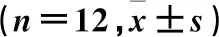
表5 大鼠海马组织PI3K、AKT、GSK3β mRNA水平的比较
3.6 PI3K、AKT、GSK3β蛋白水平的比较
与对照组比较,模型组大鼠海马组织PI3K和p-AKT蛋白的表达水平降低,p-GSK3β蛋白的表达水平升高(P<0.05)。与模型组比较,姜黄素高、中、低剂量组大鼠海马组织PI3K和p-AKT蛋白的表达水平升高,p-GSK3β蛋白的表达水平降低(P<0.05)。与姜黄素低剂量组比较,姜黄素中剂量组和高剂量组大鼠海马组织PI3K和p-AKT蛋白的表达水平升高,p-GSK3β蛋白的表达水平降低,且姜黄素高剂量组的变化更为明显(P<0.05)。结果见表6、图3。

图3 海马组织蛋白表达水平
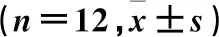
表6 大鼠海马组织PI3K、p-AKT、p-GSK3β蛋白水平的比较
4 讨论
吸入性麻醉药物与静脉注射麻醉药物相比,更易引起POCD,可导致神经细胞凋亡和学习记忆功能减退,药物浓度越大神经元凋亡越严重,且范围越大[10-12]。炎症反应和神经细胞凋亡是引起神经系统发生老化,即认知功能减退的中心环节[13]。姜科植物姜黄是一种传统中药,姜黄素作为其特有的活性成分,对中枢神经系统损伤有较好的修复作用,还可减轻机体的炎症反应[14-15]。姜黄素对神经细胞凋亡亦有抑制作用[16]。
本研究用七氟烷吸入麻醉法建立POCD大鼠模型,从分子机制上探讨姜黄素对POCD大鼠认知功能障碍的修复作用及其对海马组织神经细胞凋亡的影响。结果显示,模型组大鼠在Morris水迷宫实验中逃避潜伏期延长,跨台次数明显减少,血清TNF-α、IL-1β和IL-6水平升高,表明模型组大鼠认知功能障碍模型建立成功且伴有炎症反应。在给予不同剂量的姜黄素治疗后,大鼠均表现逃避潜伏期缩短,跨台次数明显增多,血清TNF-α、IL-1β和IL-6水平降低,表明大鼠认知功能障碍得到改善,且体内炎症反应减轻。观察海马组织HE染色切片也发现,海马组织CA1区神经元数量增多,细胞凋亡现象得到改善。
PI3K/AKT/GSK3β信号通路在中枢神经系统中可改善神经炎症,抑制神经细胞凋亡,是典型的抗炎、抗凋亡通路之一[17-18]。PI3K活化可激活下游因子AKT,而丝氨酸蛋白激酶参与细胞增殖、存活和凋亡等多种生理过程[19]。p-AKT作为GSK3β的负调节因子,能够下调GSK3β从而降低凋亡蛋白相关因子的水平,起到抑制细胞凋亡的作用[20]。在本研究中,与模型组比较,姜黄素各剂量组大鼠海马组织中PI3K、AKT mRNA和蛋白的表达水平升高,GSK3βmRNA和蛋白的表达水平均降低,且海马组织CA1区神经细胞的凋亡率降低,表明姜黄素能够激活PI3K/AKT/GSK3β信号通路,抑制POCD大鼠细胞凋亡,发挥神经保护作用。
综上所述,姜黄素能够改善七氟烷致POCD大鼠的认知功能障碍,减轻炎症反应,降低神经细胞凋亡率,可能是通过激活PI3K/AKT/GSK3β信号通路发挥作用,为临床治疗POCD提供实验依据。
