红花小孢子培养与胚状体诱导研究
2023-05-07安素妨,董薇,杨红旗,余永亮,许兰杰,梁慧珍
安素妨,董薇,杨红旗,余永亮,许兰杰,梁慧珍

摘要:小孢子培养是创造单倍体和双单倍体的重要途径,对提高红花的育种效率具有重要意义。为了研究红花游离小孢子的高效培养体系,用20份红花材料研究花药及小孢子培养中影响愈伤组织生长和胚发生的关键因素。结果表明,小孢子发育时期、红花品种、基本培养基和激素浓度是影响红花诱导愈伤组织的关键因素。花药培养的愈伤及胚诱导率高于游离小孢子,且受基因型影响。单核靠边期管状花长度为 0.45~0.50 cm时,诱导成功率达到68.32%。供试的20份红花材料中,有11份诱导出了愈伤组织,有1份分化出了胚状愈伤,诱导成功率为15.79%。分化培养最适培养基组合为1/2 MS+B5+ 6-BA 1.0 mg/L + NAA 1.0 mg/L;小孢子悬浮培养最适培养基激素浓度以添加6-BA 4.0 mg/L 和NAA 0.5 mg/L效果最好,诱导愈伤率为22.5%。
关键词:红花;花药;小孢子;愈伤组织
中图分类号:S567.21 文献标志码:A 文章编号:2097-2172(2023)04-0377-06
doi:10.3969/j.issn.2097-2172.2023.04.018
Study on the Microspore Culture and Embryoid Induction of
Safflower Lines
AN Sufang, DONG Wei, YANGHongqi,YU Yongliang, XU Lanjie, LIANG Huizhen
(Sesame Research Centre, Henan Academy of Agricultural Sciences, Zhengzhou Henan 450002, China)
Abstract: Microspore culture is an important way to create haploids and diploids, which is of great significance for improving the breeding efficiency of safflower. In order to study the efficient culture system of isolated microspores in safflower, factors affecting callus growth and embryogenesis in anther and microspore culture were studied through 20 genotypes. Results showed that the stage of microspore development, safflower varieties, culture medium, hormones concentrations were the key factors affecting microspore embryoid induction in safflower. The callus and embryo induction rates of anther culture were higher than those of isolated microspores, and were affected by genotypes. When the fruit diameter of late uninucleate microspore was 1.00 to 1.96 cm and the length of tube flower was 0.45 to 0.50 cm, the induction success rate reached 68.32%. Callus tissues were successfully induced in 11 out of 20 genotypes, embryoid callus was developed in one safflower genotype and the induction success rate was 15.79%. The optimal differentiation medium combination was 1/2 MS plus B5 plus 1.0 mg/L 6-BA plus 1.0 mg/L NAA. The optimal medium for microspore suspension culture was 4 mg/L 6-BA plus 0.5 mg/L NAA which had the callus induction rate of 22.5%.
Key words: Safflower; Anther; Microspore; Callus
紅花(Carthamus tinctorius L.),别名刺红花,菊科红花属植物,具有特异香气,在我国主产地为河南、湖南、四川、新疆、西藏等省区。红花幼苗可食用,成熟红花丝含有丰富的红色素、黄色素,具有活血化瘀的功效,其中黄色素对于治疗老年H型高血压效果良好,可改善患者的HRV,并抑制左室舒张功能减低,其机制可能与抗炎、抗氧化应激、保护血管内皮功能及抗血液高凝状态有关,且联合二甲双胍治疗早期DN能够有效改善患者免疫功能和生活质量[1 - 2 ]。此外它还是一种天然的染料[3 ]。红花种子可用作榨油,食用红花油可以降低胆固醇,还可以加工成人造奶油、色拉酱等,是一种很好的食用油脂[4 ]。
由于培养一个新品种不仅耗时长,还需大量的人力和物力,严重制约了红花良种育种及其在生产科研上的进一步利用。游离小孢子的培养是红花获得单倍体植株的重要途径之一,通过诱导培养能生成纯合的二倍体植株,即可加快红花遗传改良,也为红花的苗木繁育、分子生物学、遗传学和形态发生学等研究提供稳定的材料。研究者最初从油菜的小孢子培养中获得小孢子植株 后[5 ],小孢子培养技术的研究进展迅速,陆续在白菜类、辣椒、萝卜、芸薹属蔬菜、大麦等作物中广泛应用并获得成功[6 - 10 ],但花药和小孢子培养技术在红花中未见报道。我们借鉴其他植物花药和小孢子培养技术体系,通过对不同小孢子发育时期、不同品系的红花以及培养基条件进行探索,以期获得红花胚状体,为获得红花培养单倍体植株提供技术支撑。
1 材料与方法
1.1 试验材料
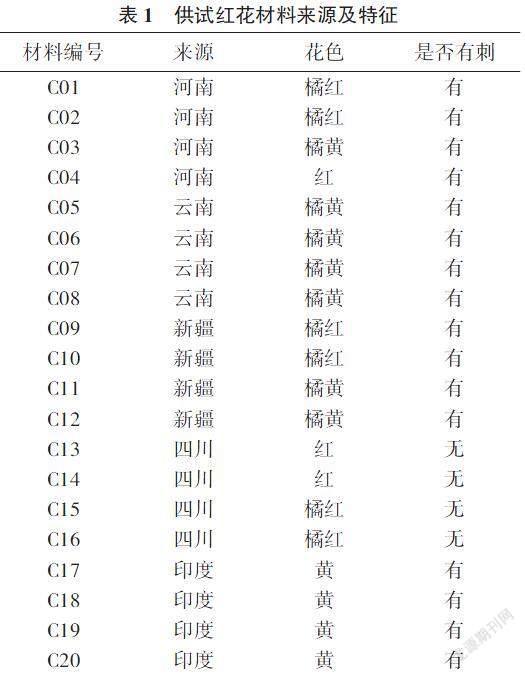
选用不同类型和来源的20份红花材料(表1),其中C01~C04为河南省卫红花农家种变异株系,C05~C08为云南红花农家种变异株系,C09~C12为新疆红花农家种变异株系,C13~C16为四川红花农家种变异株系,C17~C20为印度红花种质选系。供试材料种植于河南省现代农业开发研究基地,7:00 — 9:00时分批采集现蕾5~7 d的带茎红花花苞,插入清水中备用。
1.2 试验方法
1.2.1 预处理 为提高胚状体的诱导率,需对红花花苞进行预处理。将取回的红花花苞置4 ℃冰箱低温处理24 h。用自来水冲洗干净,在超净工作台环境下用70%乙醇灭菌1 min,10%次氯酸钠灭菌5 min,无菌水冲洗5~6次,用吸水纸吸干水分。
1.2.2 筛选红花小孢子最佳发育时期 根据许兰杰等[11 ]的方法,选取不同的红花小孢子发育时期,分别为四分体期、单核早中期、单核靠边期、双核期。在MS固体培养基中测试愈伤组织诱导率。
1.2.3 小孢子分离纯化 选取易产生愈伤组织的材料C02、C09,各选取30个花蕾。经预处理后的花蕾,取出花丝置于玻璃管中,加入MS+蔗糖60 g/L(未加激素和琼脂)液体培养基1 mL。用玻璃棒研磨使之小孢子散出,导入过滤器过滤,将滤液盛入10 mL离心管,放入1 000 r/min离心机离心3 min,弃上清液,加入悬浮培养液使沉淀的小孢子再次悬浮后,再次放入1 000 r/min离心机离心3 min,重复3次。
1.2.4 小孢子培养 将沉淀的小孢子分别转移至含有6-BA、IAA不同浓度的悬浮培养液培养皿中,按正交实验设计,在24 ℃温度下黑暗培养,形成愈伤组织后转移至分化培养基上,置于22 ℃、10 000 lx光照16 h、黑暗8 h下继代培养14 d。每激素处理40个花蕾。
1.2.5 花藥培养 将处理过的红花花苞用无菌镊子去掉外层苞片,剥开花丝取出花药,接种于诱导培养基MS+ NAA 1 mg/L + 6-BA 1.0 mg/L + KT 2 mg/L + Agar(琼脂粉) 5 g/L内, 3次重复,每个100 mm×20 mm培养皿接种4个花蕾的花药。接种后,将培养皿置于温度24 ℃培养箱中暗培养2 d,再转入22 ℃、 10 000 lx光照16 h、黑暗8 h下诱导愈伤组织。长出愈伤组织后转移至10种分化培养基中进行分化培养,统计诱导率。
愈伤组织诱导率=(产生愈伤组织的花药数/接种花药数)×100%,
胚状体诱导率=(胚状体数/接种花药总数)×100%。
2 结果与分析
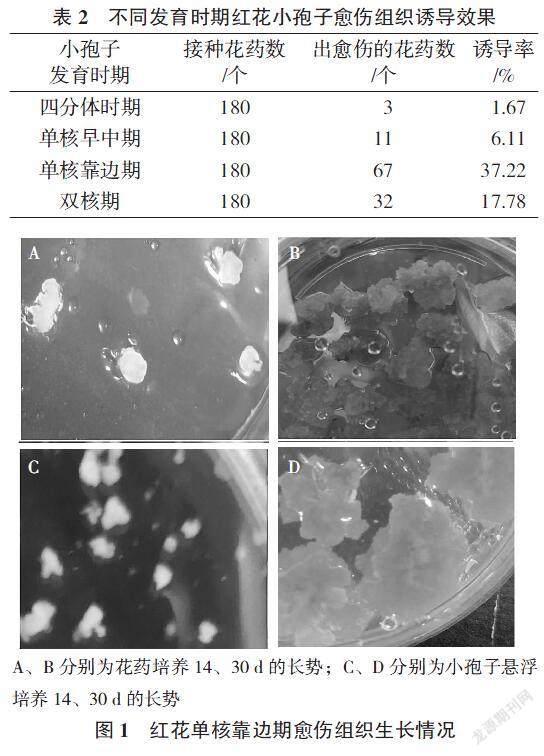
2.1 不同发育时期的小孢子诱导效果
不同发育时期的小孢子,愈伤组织诱导效果不同(表2)。四分体时期(管状花长度为 0.20~0.40 cm)的诱导率为1.67%,单核早中期(管状花长度为 0.42~0.45 cm)的诱导率为6.11%,单核靠边期(管状花长度为0.45~ 0.50 cm)的诱导率为37.22%,双核期(管状花长度为 0.60~0.90 cm)的诱导率为17.78%。由此可见,单核靠边期是花药诱导愈伤的最佳时期,这一结果与对多数植物小孢子诱导的研究结果一致[12 - 14 ]。红花小孢子单核靠边期长出的愈伤组织坚硬、绿色、长势较好(图1),因此,在小孢子悬浮培养中,单核靠边期均为诱导愈伤最适宜的时期。直接选取管状花长度为 0.5 cm的花药进行组织培养,可节约选材时间。
2.2 不同红花材料花药培养诱导效果
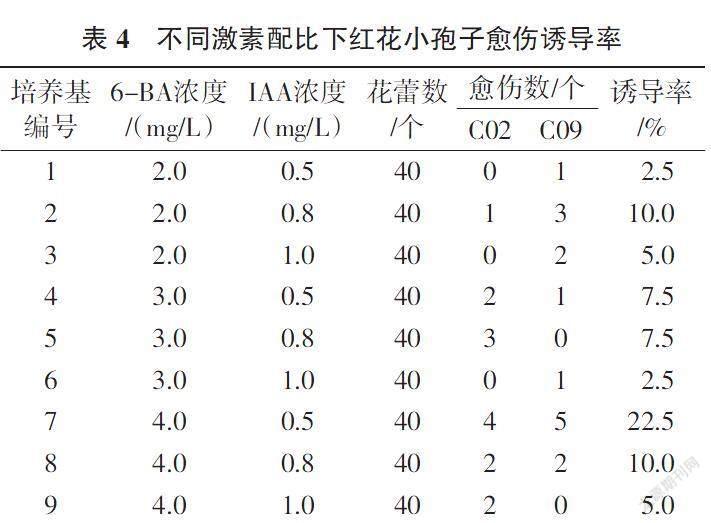
花药和小孢子在诱导培养基中约培养7 d,可见透明水珠状膨大的愈伤组织,继续培养至14~20 d,愈伤组织颜色由透明逐渐变成乳白色。转至分化培养基14 d后愈伤组织变绿,不同品种的花药和小孢子,其培养效果不同。20份供试红花材料中,有13份诱导出愈伤组织,分别为C01、C02、C04、C05、C08、C09、C10、C12、C14、C15、C19,其中C02、C09愈伤诱导率较高,分别为63.33%、57.67%。由此可见,在相同的培养条件下,不同材料的花药愈伤诱导率受基因型的影响较大(表3)。
2.3 不同激素配比对红花小孢子诱导率的影响
由表4可知,供试材料经过不同激素不同浓度配比处理后,愈伤诱导率为2.5%~22.5%,产生的愈伤组织为淡绿色,松散。7号培养基(MS+ 6-BA 4 mg/L + NAA 0.5 mg/L)中,C02、C09等2份材料愈伤诱导率最高,为22.5%,其他处理愈伤诱导率均较低。7号培养基的激素配比为红花小孢子培养愈伤组织的最佳浓度。
2.4 不同材料的胚状体分化效果
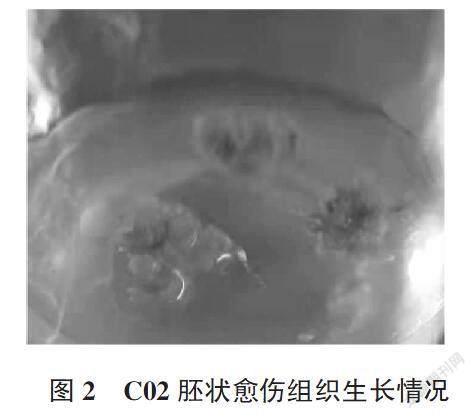
以11份红花材料诱导出的愈伤组织分别转移至10种分化培养基中诱导胚状体,均出现不同颜色的膨大组织(表5),其中在10号分化培养基组合1/2MS+B5+6-BA 1.0 mg/L + NAA 1.0 mg/L中 ,红花材料C02愈伤组织为深绿色,且长势较好,能诱导出胚状愈伤,接种19个愈伤出现3个胚状体(图2),诱导率为15.79%(表6)。初步判断1/2MS培养基较有其他培养基更易诱导出胚状愈伤,组合10为诱导红花花药胚状体较佳组合。小孢子的液体培养基虽然能诱导出愈伤组织,但在10种分化培养基中并未获得胚状体,其诱导率为0。可见红花小孢子分化培养与花药分化培养的原理可能不同,这有待进一步探索。
3 讨论与结论
花药和小孢子培养技术已经在育种中得到广泛应用。贾俊香通过白菜小孢子培养获得了多头、叶色油亮纯和的菜心DH系203份,其植株分蘖力强,产量高,抗病能力增强[15 ]。有学者利用小孢子培养的DH群体获得了甘蓝枯萎病候选基因,并对其进行了验证,结合分子标记技术,促进了抗枯萎甘蓝新品种选育进程[16 ]。谭舒心等[17 ]首次开展了白菜小孢子超低温冻存研究,建立了白菜小孢子超低温冻存复苏体系,使小孢子供体植株不受生长季节、生长期影响,可长期持续的获取高生活力的白菜小孢子。
花粉和小孢子培养诱导出胚受多种因素影响。小孢子的发育时期是影响小孢子培养的一个关键因素,并不是整个的发育期都可以培养,在许多作物中,以小孢子单核靠边期至双核初期诱导胚状体为最佳[18 - 20 ]。研究发现,小孢子的每个发育时期与花器官外部形态极为相关,针对不同的作物可根据花器官形态特征来判断小孢子的发育时期[11, 21 ]。本研究发现,红花诱导愈伤最佳时期为小孢子單核靠边期。同一品种不同的变异株系之间愈伤组织及胚状体的诱导率相差很大,大多研究中都是只有一部分组织获得了胚状体[22 - 23 ]。也有材料全部培养出胚状体,如在青梗菜游离小孢子培养中,10个品种全部获得了胚状体,但基因型不同其胚胎的发生能力差异很大[24 ],所以合适基因型的选择也是花药和小孢子培养成功的关键因素。基础培养基只有配合使用适当浓度的激素才能诱导愈伤组织的生长以及胚状体的分化,不同物种需要的激素组合有差别。在瓜类中被认为6-BA配合2,4-D和KT效果最佳[25 ],芸薹属中常用的激素组合为NAA和6-BA[26 - 27 ],除此之外,在小麦和水稻小孢子上的研究表明麦芽糖、2,4-D和 PEG 浓度会对愈伤组织率和绿苗分化率产生影响[28 - 30 ]。小孢子胚状体的产生受多种因素的影响。有研究者对实验材料进行4 ℃冷处理、热激处理后发现,小孢子的出胚率均有明显的提高[31 - 33 ]。此外,除了加入植物激素,研究人员通常会在培养基中添加一定量的活性炭提高胚状体的产生[34 - 36 ]。这些因素是否有利于诱导红花小孢子产生胚状体有待进一步研究。
研究结果表明,小孢子发育时期、红花品种、基本培养基和激素浓度是影响红花诱导愈伤组织的关键因素。花药培养的愈伤及胚诱导率高于游离小孢子,且受基因型影响。单核靠边期管状花长度为 0.45~0.50 cm时诱导成功率达到68.32%。供试的20份红花材料中,有11个诱导出了愈伤组织,仅C02分化出了胚状愈伤,诱导成功率为15.79%。分化培养最适分化培养基组合为1/2 MS+B5+ 6-BA 1.0 mg/L + NAA 1.0 mg/L;小孢子悬浮培养最适培养基激素浓度以添加6-BA 4.0 mg/L 和NAA 0.5 mg/L效果最好,诱导愈伤率为22.5%。
参考文献:
[1] 王嘉祺,李志超,张应锐. 红花黄色素对老年H型高血压患者心率变异性等的影响[J]. 西北药学杂志,2022,37(5):147-152.
[2] 鲍喜静,李建英,彭 一,等. 红花黄色素联合二甲双胍对早期糖尿病肾病患者免疫功能和生活质量的影响[J]. 河北医药,2022,44(7):1042-1045.
[3] NIE P H, ZHANG L, ZHANG W H, et al. The effects of hydroxysafflor yellow A on blood pressure and cardiac function[J]. Journal of Ethnopharmacology, 2012, 139(3): 746-750.
[4] 丁文浩. 红花油的营养价值与保健作用[J]. 农村科技,2007(4):51.
[5] ROBERT LICHTER. Induction of haploid plants from isolated pollen of Brassica napus[J]. Zeitschrift f?魨?讕?讈r Pflanzenphysiologie, 1982, 105(5): 427-434.
[6] 苗如意. 辣椒小孢子培养关键技术研究[Z]. 山西省,山西农业大学,2020-09-08.
[7] 张 丽,王庆彪,王艳萍. 利用离体小孢子培养技术培育心里美萝卜新品系[J]. 中国蔬菜,2020(8):53-56.
[8] 张胜雪,范伟强,王超楠,等. 青萝卜游离小孢子培养体系优化[J]. 中国瓜菜,2022,35(2):34-38.
[9] 伍健缤,陈坤豪,陈木溪,等. 芸薹属蔬菜游离小孢子培养研究进展[J]. 农学学报,2022,12(3):44-49.
[10] 陆瑞菊. 大麦游离小孢子培养技术的优化及单倍体耐盐、耐低氮胁迫筛选体系的建立[D]. 南京:南京农业大学,2012.
[11] 许兰杰,梁慧珍,余永亮,等. 红花花器官形态与小孢子发育时期的关系研究[J]. 河南农业科学, 2021,50(11):55-61.
[12] 谷文英,祈新梅,庞巧遇,等. 蒺藜苜蓿小孢子不同发育时期花蕾形态与花药脱分化能力的研究[J]. 中国农学通报,2011,27(20):29-33.
[13] 张恩慧,马英夏,杨安平,等. 甘蓝小孢子培养中花蕾长度与细胞单核期的关系[J]. 西北农业学报,2012,21(6):124-128.
[14] 張景景,穆国俊,侯名语,等. 花生(Arachis hypogaea L.)游离小孢子培养获得愈伤组织研究[J]. 中国油料作物学报,2012,34(6):592-597.
[15] 贾俊香. 基于小孢子培养的白菜类蔬菜种质创新[D]. 沈阳:沈阳农业大学,2019.
[16] LV, H H, WANG, et al. Breeding of cabbage (Brassica oleracea L. var. capitata) with fusarium wilt resistance based on microspore culture and marker-assisted selection[J]. Euphytica, 2014, 200(3): 465-473.
[17] 谭舒心,张淑江,章时蕃,等. 白菜小孢子超低温保存及复苏后胚状体诱导[J]. 中国蔬菜,2022(7):52-61.
[18] 冯 辉,姜凤英,冯建云,等. 羽衣甘蓝游离小孢子培养技术研究及应用[J]. 园艺学报,2007(4):1019-1022.
[19] 李桂花,王亭亭,刘 凯,等. 芥蓝小孢子培养研究初报[J]. 热带作物学报,2016,37(8):1518-1525.
[20] 唐 兵,陶 莲,卢 松,等. 白菜游离小孢子培养高频胚诱导技术体系优化[J]. 热带作物学报,2017,38(10):1913-1920.
[21] 贾俊香,李 娜,杨国栋,等. 大葱小孢子发育时期细胞学与形态特征观察[J]. 园艺与种苗,2022,42(5):1-3;29.
[22] 赵晓嫚. 青花菜小孢子胚胎发生及品质影响因素研究[D]. 南京:南京农业大学,2013.
[23] 王莎莎. 甘蓝小孢子发育观察与小孢子培养中高出胚率的诱导技术研究[D]. 杨凌:西北农林科技大学,2008.
[24] 张 琨,王一衡,王 琦. 青梗菜游离小孢子培养关键因素研究[J]. 种子,2022,41(5):144-148.
[25] 耿晨光,何 刚. 瓜类花药培养中激素和碳源的应用研究进展[J]. 长江蔬菜,2008(10):5-9.
[26] 单 宏. 基于小孢子培养的大白菜优异种质创制[D]. 沈阳:沈阳农业大学,2017.
[27] 赵大芹,陶 莲,张朝君,等. 培养基成分对黔白大白菜杂交种小孢子胚诱导的影响[J]. 贵州农业科学,2007(6):24-25;29.
[28] 兰素缺,李光威,权书月,等. 碳源组份及浓度对小麦花药培养和游离小孢子培养的影响[J]. 华北农学报,2002(S1):93-97.
[29] 郭桂梅. 水稻和大麦游离小孢子培养条件的优化[D]. 上海:上海海洋大学,2013.
[30] KAMIL ZIELI?譵SKI, et al. The effect of glutathione and mannitol on androgenesis in anther and isolated microspore cultures of rye Secale cereale L.[J]. Plant Cell, Tissue and Organ Culture PCTOC, 2020, 140(3): 577-592.
[31] 张胜雪,范伟强,王超楠,等. 青萝卜游离小孢子培养体系优化[J]. 中国瓜菜,2022,35(2):34-38.
[32] 王葆生,廉 勇,张艳萍,等. 胡萝卜游离小孢子胚状体诱导技术优化[J]. 北方园艺,2019(13):68-72.
[33] RAHMAN, ZURAIDA ABD, SEMAN, et al. Establishment of effective plantlets regeneration protocol via isolated microspore culture in Malaysian indica rice MR219[J]. Plant Biotechnology Reports, 2022(prepublish).
[34] 郭世星,牛应泽,余学杰,等. 活性炭对甘蓝型油菜(Brassica napus L.)小孢子胚胎发生的影响[J]. 种子,2005(7):37-39.
[35] 张 丽,郑鹏婧. 春白萝卜游离小孢子培养的研究[J]. 北方园艺,2013(23):31-33.
[36] YANG H L, HU J F, et al. Isolated microspore culture and plant regeneration of leaf mustard [Brassica juncea(L.) Czern. et Coss.][J]. Agricultural Biotechnology, 2016, 5(6):10-12; 15.
