香芹酮/羟丙基-β-环糊精包合物的制备、表征及对硫色镰刀菌的抑制作用
2023-05-06许奕雯田甲春田世龙
许奕雯 徐 瑞 田甲春 田世龙,* 葛 霞,*
(1甘肃农业大学食品科学与工程学院,甘肃,兰州 730000;2甘肃省农业科学院农产品贮藏加工研究所,甘肃,兰州 730000;3甘肃省农业科学院农业质量标准与检测技术研究所,甘肃,兰州 730000)
马铃薯种植广泛、产量高、营养价值丰富,是四大粮食作物之一[1]。马铃薯贮藏病害主要有干腐病、软腐病[2]和疮痂病[3]等。其中,干腐病发病率最高也最为严重,主要是由病原菌硫色镰刀菌(Fusarium sulphureum)所引起,在贮藏期间侵染块茎,造成块茎内外部病变[4],使得淀粉含量显著降低[5],严重影响马铃薯的品质,造成巨大经济损失。运用抑菌剂防治干腐病是目前应用最广泛、效果最为明显的防治方法[6]。
植物源抑菌剂具有安全性高、抑菌效果明显、低残留或无残留、抗氧化能力强及保鲜效果好等优点[7],但其水溶性差、挥发性强、不稳定,导致使用时生物利用率低和药效时效性短[8]。天然环糊精及其衍生物具有外亲水、内疏水的刚性空腔结构,可使小分子物质进入空腔内形成主客体包合物,从而提高客体分子的稳定性和水溶性,并控制客体小分子的释放量,在食品、药品及化妆品领域被广泛应用[9-10]。将植物源抗菌剂制成环糊精包合物不仅可达到增稳缓释作用,还可以充分发挥其抑菌作用[11]。已有研究表明,将β-环糊精与精油及其提取物制备成包合物,应用于各种果蔬的抑菌与保鲜上,均可得到显著的抑菌与缓释效果[12-15]。
香芹酮是从植物葛缕子种子精油中提取出来的单萜类物质,是一种天然绿色的抗菌剂,在鲜花保鲜及芒果采后腐败病防治中已有较多研究[16-17]。此外,香芹酮对马铃薯贮藏期间常见的硫色镰刀菌(Fusarium sulphureum)具有良好的抗菌活性,可抑制马铃薯贮藏期间干腐病等病害发生[18]。然而香芹酮也具有天然产物易挥发、稳定性差等共性问题,限制了其在实际应用中的可能性[19-20]。羟丙基-β-环糊精(chydroxypropylβ-cyclodextrin,HP-β-CD)是β-环糊精的醚化衍生物,与β-环糊精相比,其水溶性显著提高,包合能力提升的同时安全性更高[21]。因此,本研究将香芹酮与羟丙基-β-环糊精通过共蒸发-冷冻干燥法制备成包合物,对其进行一系列表征,证实包合物的生成,并研究其对马铃薯贮藏病害干腐病病原菌硫色镰刀菌的抗菌效果,为其应用于抑制马铃薯贮藏期间干腐病的发生提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
羟丙基-β-环糊精(相对分子质量1 495),江苏泰兴新鑫医药辅料有限公司;香芹酮(含量大于96%),阿法埃莎(天津)化学有限公司;香芹酮标准品(用于气相色谱,纯度≥98%),上海源叶生物科技有限公司;马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA),北京奥博星生物技术有限责任公司。
1.2 仪器与设备
6890N 气相色谱仪,美国Agilent公司,并配备HP-5MS 色谱柱(30 m×0.32 mm i.d.×0.25 µm);UV-1900紫外可见分光光度计,日本SHIMADZU公司;AVANCE III 400 核磁共振光谱仪,德国Bruker 公司;TGA2 热重分析仪,瑞士梅特勒-托利多集团;JSM-7800F 超高分辨热场发射扫描电镜,日本电子株式会社;Ultima IV X射线粉末衍射仪,日本理学株式会社。
1.3 试验方法
1.3.1 香芹酮/羟丙基-β-环糊精包合物的合成 采用共蒸发-冷冻干燥法制备香芹酮/羟丙基-β-环糊精包合物。准确称取羟丙基-β-环糊精276 g,香芹酮32.6 mL,二者物料摩尔比为1∶1,共同溶于25 L 5%的乙醇水溶液中,在80 ℃下持续搅拌4 h,随后移至室温持续搅拌2 h 后,将乙醇溶剂蒸除,静置,过滤,真空冷冻干燥,得到香芹酮/羟丙基-β-环糊精包合物,包合物的产率为93.6%。
1.3.2 香芹酮/羟丙基-β-环糊精物理混合物的制备 在相关表征前,准确称取1.495 g 的羟丙基-β-环糊精、移取150.2 µL 的香芹酮于带盖样品瓶中,迅速将两者充分混匀,得到香芹酮/羟丙基-β-环糊精物理混合物待测。
1.3.3 香芹酮/羟丙基-β-环糊精稳定常数的测定采用相溶解度图来测定稳定常数[22-23]。将过量的香芹酮(0.50 mL)加入到含有不同浓度羟丙基-β-环糊精溶液的10 mL比色管中,其中羟丙基-β-环糊精浓度分别为0、10、20、30、40、50 mmol·L-1。在20 ℃条件下充分振荡,达到平衡后取下层的水溶液适当稀释,用气相色谱测定溶液中的香芹酮含量。试验重复3 次。色谱条件:取 1 µL 样品按1∶5 分流进样,进样口温度250 ℃,起始温度60 ℃,保持 3 min,以10 ℃·min-1升温至200 ℃,再以20 ℃·min-1升温至250 ℃,保持2 min,以氮气作为载气。按照Higuchi-Connors 方程(公式1),由相溶解度图线性部分的斜率和截距计算得到稳定常数Kc值:
式中,Kc为20 ℃时包合物的稳定常数;S0为香芹酮在不含环糊精水中的溶解度。
1.3.4 包合物的表征
1.3.4 .1 紫外表征 分别配制1.0×10-2mol·L-1羟丙基-β-环糊精水溶液储备液和1.0×10-3mol·L-1香芹酮乙醇溶液储备液。在7 支10 mL 比色管中分别转移0.1 mL 香芹酮储备液,0、1.0、2.0、3.0、4.0、5.0、6.0 mL 的羟丙基-β-环糊精储备液(1→7),之后再分别加入2.0 mL pH值7.0的混合磷酸缓冲液,用去离子水稀释至10 mL 刻度线,摇匀静置30 min 后,在紫外可见分光光度计上于200~300 nm 范围内进行全波长扫描。
1.3.4 .21H NMR光谱 以DMSO-d6与D2O(V/V=1∶1)的混合溶剂为核磁溶剂,以四甲基硅烷(tetra methyl silane,TMS)作为内标,使用核磁共振光谱仪分别对羟丙基-β-环糊精和香芹酮/羟丙基-β-环糊精包合物进行样品采集[24]。采集参数:谱宽4 000 Hz,采集时间3.98 s,扫描次数8,延迟时间1 s。
1.3.4 .3 热重分析 分别取1~2 mg 香芹酮、羟丙基-β-环糊精及香芹酮/羟丙基-β-环糊精包合物样品置于带盖的氧化铝坩埚中进行测定[25]。温度范围:25~500 ℃,升温速率:10 ℃·min-1,N2流速:20 mL·min-1。
1.3.4 .4 扫描电镜 将羟丙基-β-环糊精、香芹酮/羟丙基-β-环糊精物理混合物和包合物样品固定在样品台上,喷镀铂金后在2.00 kV 条件下进行观察并拍照,放大倍率分别为500和1 000倍。
1.3.4 .5 粉末X-衍射分析 分别对羟丙基-β-环糊精、物理混合物及其包合物进行X-衍射测试[26]。测定条件为Cu Kα 射线、管电压40 kV、管电流200 mA,扫描3~40°、扫描速率8°·min-1、步长0.02°。
1.3.5 包合物对硫色镰刀菌的抑制作用 使用PDA将香芹酮/羟丙基-β-环糊精包合物配置成7 个不同的浓度梯度:其中香芹酮有效浓度分别为0.0、0.5、1.0、1.5、2.0、2.5、3.0 mmol·L-1,取高温灭菌后的含药PDA 培养基10 mL 倒入直径为9 cm 的培养皿中,冷却至室温。用接种针将培养48 h 直径为4 mm 的圆形菌饼正面向下分别移植贴合到带药的PDA 平板正中央,每个浓度重复3 次,置于28 ℃培养箱中培养48 h,取出培养皿分别用直尺交叉法测定菌落直径。按照公式(2)计算不同浓度下药剂对真菌菌丝的生长抑制率:
将抑制率换算成几率值,以药剂浓度对数值为自变量(x),以菌丝抑制几率值为因变量(y),用最小二乘法得出毒力回归方程和相关系数(r),根据回归方程求出香芹酮/羟丙基-β-环糊精包合物对硫色镰刀菌的半最大效应浓度(concentration for 50% of maxmal effect,EC50)。
1.4 数据处理
采用Excel 2010 和SPSS 19.0 软件进行数据处理和分析,并用Origin 2018 软件作图。
2 结果与分析
2.1 羟丙基-β-环糊精对香芹酮的包合稳定常数及水溶性的影响
从相溶解度图(图1)可以看出,香芹酮的浓度随羟丙基-β-环糊精浓度的增加呈线性增加趋势。根据Higuchi 和Connors 的理论[27],此相溶解度图可归属为AL型,说明生成了主客体比为1∶1 且易溶于水的包合物。按公式(1)计算出香芹酮/羟丙基-β-环糊精包合物的稳定常数为409.39 L·mol-1。且当溶液中羟丙基-β-环糊精的浓度达到50 mmol·L-1时,香芹酮的水溶性增加了约10.12倍,说明与羟丙基-β-环糊精形成包合物后明显改善了香芹酮的水溶性。
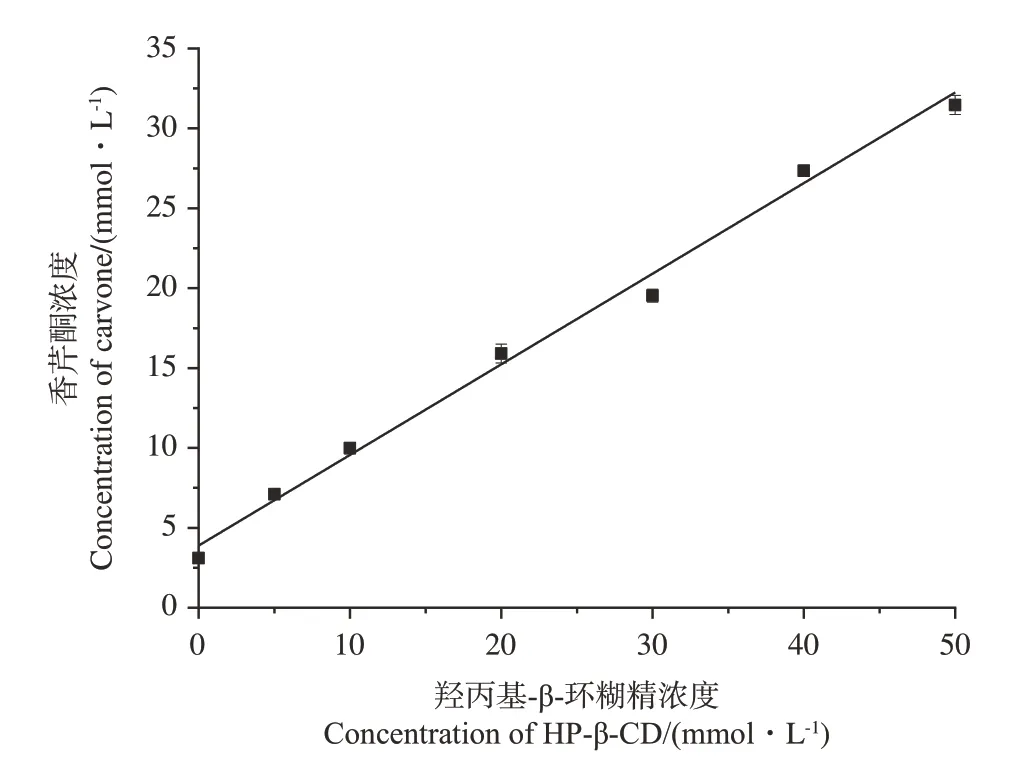
图1 香芹酮在羟丙基-β-环糊精溶液中的相溶解度图Fig.1 Phase solubitity diagrams of carvone in the presence of HP-β-CD
2.2 包合物的表征
2.2.1 紫外光谱分析 图2 为香芹酮在不同浓度羟丙基-β-环糊精中的吸收光谱。随着羟丙基-β-环糊精浓度的增加,香芹酮的最大吸收波长由241 nm 蓝移至239 nm,且香芹酮的吸光度值逐渐增强,光谱变化主要是环糊精空腔内高电子密度诱导客体分子电子发生移动的结果[28],由此证实,香芹酮分子进入了羟丙基β-环糊精的空腔并形成了超分子包合物。
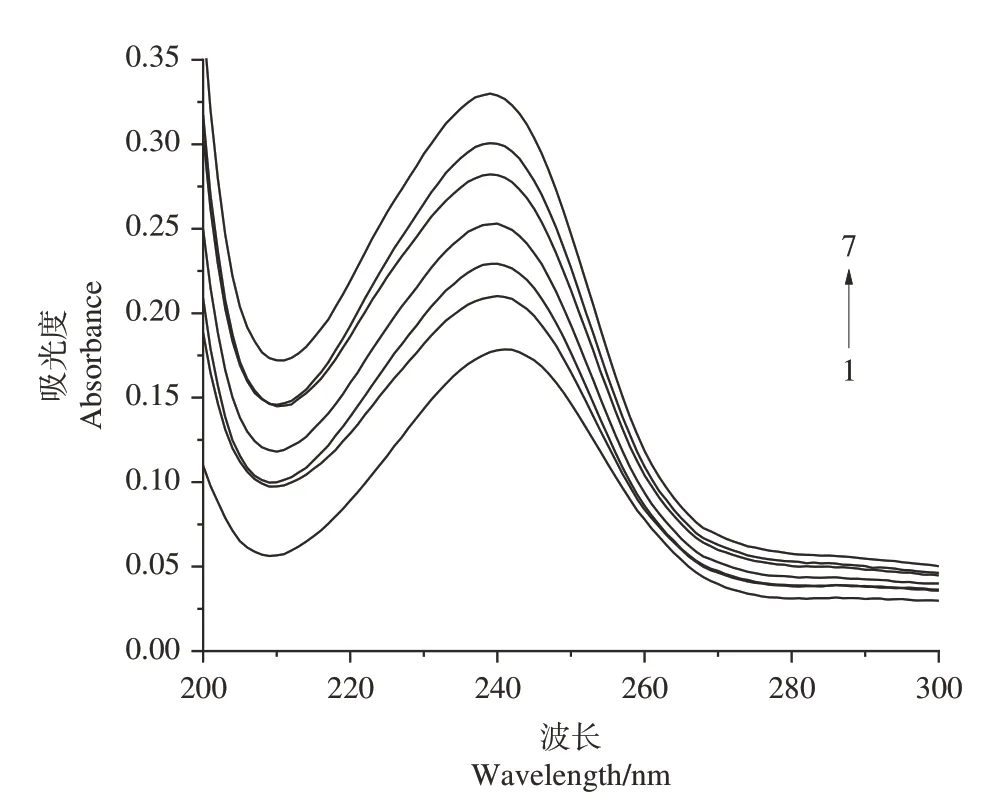
图2 香芹酮在不同浓度羟丙基-β-环糊精溶液中的紫外光谱Fig.2 UV spectra of carvone with various concentrations of HP-β-CD
2.2.21H NMR光谱分析 主客体包合物的形成将引起环糊精空腔内环境的变化,导致环糊精非极性空腔内的H-3(近大口端)和H-5(近小口端)质子发生高场位移,而环糊精空腔外的质子(H-1,H-2 和H-4)在包合前后无明显变化[29]。由表1 可知,羟丙基-β-环糊精在与香芹酮生成主客体包合物后,其H-3 和H-5 的化学位移变化值(Δδ)分别为-0.004 和-0.063,说明香芹酮分子从羟丙基-β-环糊精的大口端深深地进入了环糊精的空腔内,生成了主客体包合物。

表1 羟丙基-β-环糊精的质子生成包合物前后的化学位移值(δ)及其变化值(Δδ)Table 1 Chemical shift values(δ)and variation values(Δδ)of HP -β-CD before and after proton formation of inclusion complex
2.2.3 热重分析 由图3 可知,羟丙基-β-环糊精在50~100 ℃间发生水分蒸发,在300~325 ℃时发生分解;香芹酮在室温下就开始失重,且随着温度升高,在75~125 ℃时出现快速失重,表明香芹酮极易挥发且不稳定;物理混合物在25~125 ℃出现的失重是羟丙基-β-环糊精水分蒸发与香芹酮挥发共同叠加的效果,说明主客体间未发生相互作用。香芹酮与羟丙基-β-环糊精形成包合物后,在25~300 ℃出现缓慢失重的现象,表明生成包合物后香芹酮的热稳定性增加,延缓了香芹酮的挥发与释放。
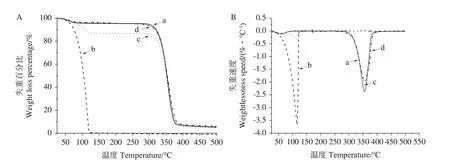
图3 羟丙基-β-环糊精(a),香芹酮(b)、香芹酮/羟丙基-β-环糊精物理混合物(c)和包合物(d)的热重曲线Fig.3 Thermogravimetry curves of HP -β-CD(a),carvone(b),physical mixture(c)and inclusion compound carvone/HP -β-CD(d)
2.2.4 扫描电镜分析(scanning electron microscope,SEM)图4 中SEM 分析显示了羟丙基-β-环糊精、物理混合物以及包合物的表面形态。图4-A、B 中的羟丙基-β-环糊精表面有小孔,具有空腔结构大小不一的球形颗粒;图4-C、D 为物理混合物,可以观察到有小块物质混合或粘附在球形颗粒上,而图4-E、F 的包合物呈现出不规则的块状,其物相结构与主体环糊精及物理混合物明显不同,说明香芹酮/羟丙基-β-环糊精包合物制备成功,主客体之间发生相互作用,形成了新的物相。

图4 羟丙基-β-环糊精(A、B)、 香芹酮/羟丙基-β-环糊精物理混合物(C、D)和包合物(E、F)的扫描电镜图Fig.4 Scanning electron microscopy(SEM)of HP -β-CD(A、 B),carvone/HP -β -CD physical mixture(C,D)and inclusion complex(E,F)
2.2.5 粉末X-射线衍射分析(powder X-ray diffraction,PXRD)粉末X-射线衍射分析是一种验证包合物是否形成的有效方法[30]。包合物的形成会使客体分子进入羟丙基-β-环糊精空腔内,导致晶格发生变化,进而使衍射图发生一定的变化[31]。香芹酮是一种液体物质,因此无法用粉末X-射线衍射仪进行分析。图5分别为羟丙基-β-环糊精(A)、香芹酮/羟丙基-β-环糊精物理混合物(B)、包合物(C)以及三者的叠加(D)衍射图。羟丙基-β-环糊精是一种非晶态物质,其衍射图中显示了非晶态相关的宽峰。物理混合物10.18°(2ɵ)的峰值偏移了1.04°,18.8°(2ɵ)的峰强度略有增强。在包合物衍射图中,10.18°(2ɵ)的峰值略微偏移0.72°,而18.8°(2ɵ)的峰强度大幅增强,结合上述SEM图可以看出,这是由包含物的表面形态与羟丙基-β-环糊精的球形颗粒状不同所致,包合物相对较小的块状形态使其参与X 射线衍射的样品比表面积增大,从而使得图谱中衍射峰的强度明显增强。上述结果表明香芹酮与羟丙基-β-环糊精之间发生相互作用并形成了主客体包合物。
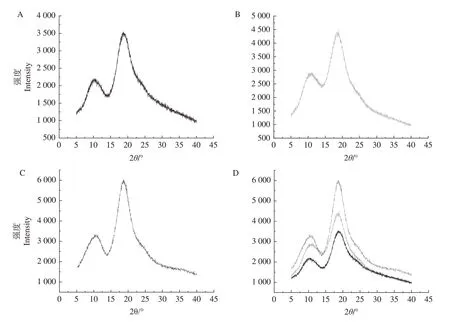
图5 羟丙基-β-环糊精(A)、物理混合物(B)、包合物香芹酮/羟丙基-β-环糊精(C)以及三者叠加(D)的X射线衍射图Fig.5 X-ray diffraction of HP -β -CD(A),physical mixture(B),inclusion compound carvone/HP -β -CD(C)and superposition of the three(D)
2.3 抗菌作用分析
由图6 可知,香芹酮/羟丙基-β-环糊精包合物处理对硫色镰刀菌菌落生长有明显的抑制作用,不同浓度包合物处理对菌落生长的抑制效果存在差异,表现为浓度越高抑制效果越明显。根据回归方程y=0.787 6x+4.107 2(r=0.981 5),得到香芹酮/羟丙基-β-环糊精包合物抑菌的EC50值为3.11 mmol·L-1。表明香芹酮/羟丙基-β-环糊精包合物对硫色镰刀菌具有较好的抑制效果。
3 讨论
香芹酮作为马铃薯抑芽剂已被美国、荷兰等国家广泛应用[20],而其施用时有效药效时间短,需要重复施药等问题一直未得到有效解决。Silva 等[32]制备了香芹酮/β-环糊精包合物并探讨其作为马铃薯抑芽剂的可能性,但仅研究了包合物的制备与抑芽效果,未对香芹酮与β-环糊精的包合机理进行深入研究。许丹等[33]研究发现,相比β-环糊精,羟丙基-β-环糊精对客体的包合作用、增溶和稳定效果更好。因此,本研究以羟丙基-β-环糊精作为主体,对客体香芹酮进行分子识别形成主客体包合物,以期改善香芹酮的物理化学性质。与薛硕等[34]研究中的香芹酮/β-环糊精包合物相比,本研究香芹酮/羟丙基-β-环糊精包合物的失重温度出现的更晚,说明羟丙基-β-环糊精与香芹酮形成包合物后,相比β-环糊精更大程度地改善了香芹酮的稳定性和释放性。
本研究通过抑菌试验明确了香芹酮/羟丙基-β-环糊精包合物对硫色镰刀菌有抑制作用,且包合物浓度越大,抑菌作用越强。朱云洁[35]研究了没食子酸辛酯/β-环糊精包合物对革兰氏阳性菌和革兰氏阴性菌的抗菌活性,并对抑菌机理做了初步探究,结果表明,没食子酸辛酯与β-环糊精形成包合物后,抑菌活性显著增强,并推断包合物是通过破坏细菌膜的完整性和通透性而对细菌表面膜电位产生影响,使DNA 分子结构发生改变而抑制细菌生长。但本研究对于包合物对硫色镰刀菌的抑菌机理尚不清楚,下一步应从抑菌过程中菌的形态变化和分子生物学差异表达调控等方面进行深入研究,阐明包合物在实际使用过程中通过哪些方式抑制或干扰菌的生长,以达到明显的抑菌效果,进而指导香芹酮/羟丙基-β-环糊精包合物在马铃薯贮藏保鲜中的实际应用。
4 结论
本研究采用共蒸发-冷冻干燥法成功制备出包合比为1∶1的香芹酮/羟丙基-β-环糊精包合物,产率为93.6%,采用相溶解度法确定其稳定常数为409.39 L·mol-1。紫外光谱中香芹酮的吸收峰出现明显的蓝移且吸光度值明显增强,1H NMR 光谱中H-3 和H-5 发生明显的化学位移变化,SEM 结果显示包合物的晶体形态出现明显变化,X-射线衍射分析中包合物的吸收峰明显增强,上述结果均证实了香芹酮/羟丙基-β-环糊精包合物的生成。热重分析结果表明,香芹酮/羟丙基-β-环糊精包合物的热稳定性强于香芹酮单体,并且羟丙基-β-环糊精对香芹酮具有抑制挥发、缓慢释放的作用。此外,香芹酮/羟丙基-β-环糊精包合物对硫色镰刀菌的生长表现出较好的抑制作用。综上,香芹酮/羟丙基-β-环糊精包合物有望成为安全防控马铃薯干腐病的新型抑菌剂。
