溶酶体活性影响秀丽隐杆线虫脂肪沉积的作用
2023-05-05陆芮,刘健,林燕
陆 芮, 刘 健, 林 燕
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
秀丽隐杆线虫(Caenorhabditiselegans)简称线虫,作为一种模式生物,已经被应用于肥胖相关脂肪沉积的研究中。线虫具有饲养条件简单、生命周期较短、体积小、通体透明以及遗传操作便利等优点[1]。由于线虫的身体是透明的,利用亲脂染料(油红O[2]、尼罗红、苏丹黑等)与脂滴特异性结合,可以直接观察到线虫体内脂肪的储存。在线虫中,脂质是以脂滴的形式储存在肠道和皮下的细胞中[3]。由于脂滴是由单层磷脂膜包被的球形结构[4],通过绿色荧光蛋白(green fluorescent protein,GFP)标记的脂滴特异性膜蛋白DHS-3,也可以直接观察线虫脂肪沉积水平[5]。此外,作为脂肪沉积研究模型,线虫中还存在着大量与哺乳动物脂质代谢相关的同源基因,保守地调控了线虫脂肪代谢与能量稳态。其中,与溶酶体活性直接相关的AMP-激活蛋白激酶(哺乳动物简称为AMPK,线虫简称为AAK-2)和雷帕霉素靶蛋白(mechanistic target of rapamycin,mTOR)等信号通路关键地调控了线虫脂肪沉积[6-9]。
溶酶体作为一种高酸性的细胞器,含有多种水解酶,降解无功能的细胞器和蛋白质等物质维持细胞稳态。然而,除降解功能外,溶酶体还参与多种细胞过程,包括营养感受、分泌、质膜修复、细胞信号转导和能量代谢调控等[10]。有报道指出,溶酶体感应细胞营养状态,激活溶酶体-细胞核信号,调节营养缺乏反应和能量代谢。在饥饿状态下,肝激酶B1(liver kinase B1,LKB1)被募集到溶酶体膜上。作为核心细胞能量和营养感受器,AMPK被LKB1活化于溶酶体表面。此外,LKB1导致mTORC1与溶酶体的解离,抑制其活性,进而导致mTORC1依赖的转录因子EB(transcription factor EB,TFEB)磷酸化降低,促进其跨核转运,从而激活溶酶体生物合成和脂质分解代谢相关基因表达[11-14]。在营养充足状态下,mTORC1定位于溶酶体膜上,抑制TFEB的核定位,降低溶酶体生物发生和自噬[14-16]。因此,溶酶体参与了饥饿状态下的营养感知和脂质分解代谢。但是,关于溶酶体是否参与了营养过剩导致的脂肪合成的作用还不明确。
本文在标准线虫生长培养基(nematode growth medium,NGM)中补充1 mmol/L葡萄糖或0.02 mmol/L棕榈酸来诱导线虫的脂肪沉积。利用油红O染色和LysoTracker Green染色检测线虫脂肪沉积和溶酶体活性的变化。利用溶酶体抑制剂氯喹和溶酶体生物合成关键转录因子hlh-30(哺乳动物TFEB的同源基因)的突变体抑制线虫溶酶体活性。利用线虫溶酶体营养感应和脂代谢相关信号关键分子aak-2、daf-15、rsks-1的突变体发现,溶酶体通过mTORC1信号通路影响线虫能量营养过剩所导致的脂肪沉积。
1 材料与方法
1.1 实验材料
野生型(N2)线虫,线虫突变体RT258(unc119(ed3)Ⅲ;pwls50)、LIU1(ldrIs1[dhs-3p∶∶dhs-3∶∶GFP+unc-76(+)])、hlh-30(tm1978)、aak-2(ok524)、daf-15(ok1412)和rsks-1(ok1255),均购于国际线虫中心(CaenorhabditisGenetic Center,CGC)。
1.2 主要试剂
胆固醇、蛋白胨、酵母粉、琼脂粉、油红O、棕榈酸、链霉素、左旋咪唑等均购于Sigma-Aldrich试剂公司;LysoTracker Green、琼脂糖均购于Invitrogen试剂公司;甘油、氯化钠、氢氧化钠、硫酸镁、氯化钙、无水乙醇、1,2丙二醇、次氯酸钠、胆固醇、磷酸二氢钾、磷酸氢二钾、葡萄糖、甲醛等试剂均购于国药集团化学试剂有限公司。
1.3 实验方法
1.3.1 线虫生长培养基的配置
在本实验中,除非特别注明,蠕虫是在20 ℃的标准条件下培养的[17]。
标准NGM的配制。称取3 g氯化钠、2.5 g蛋白胨和17 g琼脂粉,加入蒸馏水至1 L并混匀,121 ℃灭菌30 min。灭菌结束后,向上述培养基中加入过滤除菌的25 mL磷酸钾缓冲液(pH 值为6.0)、1 mol/L氯化钙、1 mol/L硫酸镁和5 g/L胆固醇(溶剂为无水乙醇试剂)各1 mL,混合均匀。待溶液冷却到60 ℃,加入1 mL的 30 g/L链霉素,混合均匀后倒入培养皿中,静置凝固后备用。
补充葡萄糖NGM的配制。待上述标准NGM溶液温度降至60 ℃左右时,将1 mL过滤除菌的1 mol/L葡萄糖母液,加入到1 L培养基中,混合均匀后,倒入培养皿中,静置凝固后备用。
补充棕榈酸NGM的配置。在上述标准NGM配制过程中,称取0.005 g的棕榈酸粉末,加入到NGM中,121 ℃灭菌30 min,冷却凝固后备用。
1.3.2 线虫的培养
将进入产卵期1~2 d的线虫,用约1 mL M9缓冲液洗至1.5 mL的离心管内,多次清洗以除净大肠杆菌,最后保留700 μL。在上述离心管中,加入300 μL现配的裂解液(5 mol/L氢氧化钠与5%次氯酸钠的体积比为1∶2)混匀。静止2 min后,反复震荡2~3次,直至2/3的线虫裂解,6 000 r/min离心1.5 min,弃上清。裂解的卵用M9缓冲液洗3次后,于M9缓冲液中20 ℃孵化至L1期幼虫。将L1时期线虫,分别转移到具有OP50大肠杆菌的标准NGM、补充葡萄糖或棕榈酸的NGM板上,于20 ℃培养至成虫。
1.3.3 线虫的油红O染色
按照标准方法进行油红O染色,并稍加修改[3]。称取0.5 g油红O粉末溶于100 mL 1,2-丙二醇中,以配置0.5%油红O染液,静置1周后使用。染色前,油红O溶液通过0.22 μm滤膜过滤。
用M9缓冲液,将成虫从NGM板上冲洗到离心管中。在离心管中,加入1 mL M9缓冲液和50 μL 10%甲醛,-80 ℃放置10 min,反复冻融3次(第3次在冰上解冻1 h)。完全融化后,用预冷的M9缓冲液洗涤3次。最后,用1,2-丙二醇脱水5min,离心除去1,2-丙二醇,再加入1.5 mL油红O染液,37 ℃恒温,染色4 h。染色后,分别用98%、85%的1,2-丙二醇和M9缓冲液洗涤,滴加在2%的琼脂糖垫上成像。至少对30只线虫成像,并使用Image-Pro Plus 6.0软件(Media Cybernetics)定量油红O阳性面积比率。油红O阳性面积比率指线虫经过亲脂性染料油红O染色所呈红色区域占整只线虫面积的比率。
1.3.4 线虫的溶酶体绿色荧光染色
LysoTracker Green染色按照标准方法进行,但略有修改[18]。将LysoTracker Green染料与过夜培养的OP50菌液以1∶1 000的比例混合,均匀涂布在NGM板上,37 ℃避光过夜。将L1时期线虫置于NGM培养基上,20 ℃避光培养至成虫。最后,将成虫用50 μmol/L左旋咪唑麻醉,置于2%琼脂糖垫上,使用尼康ECLIPSE E600显微镜对至少30只线虫成像,并使用Image-Pro Plus 6.0软件(Media Cybernetics)定量绿色荧光面积比率。绿色荧光面积比率指线虫经过LysoTracker Green染色所呈绿色荧光区域占整只线虫面积的比率。
1.3.5 线虫DHS-3∶∶GFP荧光拍照及定量
将DHS-3融合绿色荧光(DHS-3∶∶GFP)成虫用50 μmol/L左旋咪唑麻醉,置于2%琼脂糖垫上,使用尼康ECLIPSE E600显微镜对至少30只线虫进行了成像,并使用Image-Pro Plus 6.0软件(Media Cybernetics)定量绿色荧光面积比率。绿色荧光面积比率指线虫脂滴特异性膜蛋白DHS-3融合GFP表达面积占整只线虫面积的比率。
1.3.6 统计学处理
文中所有的数据均为(平均值±标准差),不同的样本两两比较采用t检验,多组比较采用one-way ANOVA和two-way ANOVA,使用Prism 5.0版(GraphPad Software,CA,USA)进行统计分析。无营养物补充与葡萄糖或棕榈酸补充比较,*、**、***分别表示P<0.05、P<0.01、P<0.001时结果具有统计学意义。无抑制剂与氯喹处理比较、N2组与hlh-30(tm1978)比较,#、##、###分别表示P<0.05、P<0.01、P<0.001时结果具有统计学意义。
2 结果与分析
2.1 营养物对线虫脂肪沉积的影响
为了研究营养物补充对线虫脂肪沉积的影响,本文在标准NGM中补充1 mmol/L葡萄糖或0.02 mmol/L棕榈酸来诱导L1时期线虫,并观察其脂肪沉积。本文利用油红O染色发现,葡萄糖或棕榈酸的补充增加了N2线虫的脂肪沉积水平,如图1a所示。为了进一步验证上述结果,使用脂滴蛋白DHS-3∶∶GFP标记的线虫LIU1检测营养物对脂肪沉积的诱导作用,观察到补充葡萄糖或棕榈酸增加了DHS-3∶∶GFP的表达,如图1b所示。结果表明,补充葡萄糖或棕榈酸显著增加了线虫的脂肪沉积。
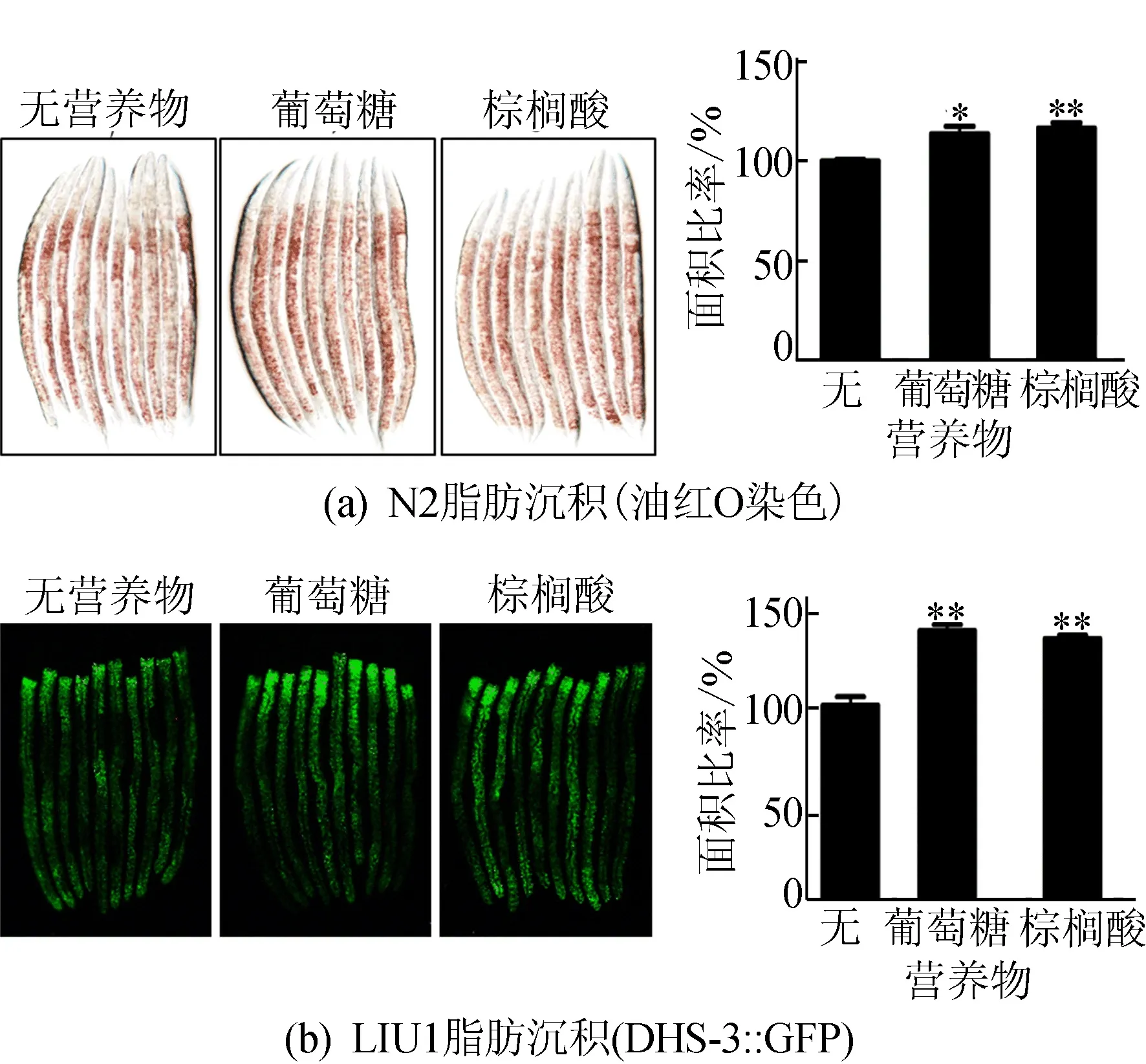
图1 葡萄糖或棕榈酸补充对线虫脂肪沉积的影响
2.2 营养物对线虫溶酶体数量和酸化的影响
溶酶体是一种高度酸化的细胞器,富含脂肪酶、核酸酶和蛋白酶等多种水解酶。这些溶酶体水解酶在pH=5.0时活性最佳[19]。LysoTracker Green是嗜酸性荧光探针,能通透细胞膜,用于活细胞内酸性细胞器的标记和示踪[20]。因此,LysoTracker Green是一种溶酶体绿色荧光探针,可以用于活细胞溶酶体特异性荧光染色。为了明确溶酶体在营养过剩状态下的感应作用,本文利用LysoTracker Green染色检测葡萄糖或棕榈酸补充对N2线虫溶酶体数量和酸化的影响,如图2a所示。由图2a可知,营养物补充后,随着脂肪沉积的增加,线虫的绿色荧光面积显著增大,表明营养物的补充增加了溶酶体的数量和酸化。本文利用溶酶体膜蛋白LMP-1融合绿色荧光(LMP-1∶∶GFP)标记的线虫RT258来监测溶酶体数量变化,也获得了相似的结果,如图2b所示。因此,溶酶体活性可能调控了营养物诱导的线虫脂肪沉积。

图2 补充葡萄糖或棕榈酸对线虫溶酶体数量和酸化的影响
2.3 溶酶体对线虫脂肪沉积的影响
本文研究溶酶体活性抑制对营养物诱导的线虫脂肪沉积的影响,如图3所示。由图3a可知,在N2线虫中,氯喹(100 μmol/L)的处理显著抑制了葡萄糖或棕榈酸所导致的溶酶体数量和酸化的增加。
由图3d可知,氯喹的处理也显著抑制了葡萄糖或棕榈酸所诱导的线虫脂肪沉积增加。与上述结果相似,在RT258线虫中,利用氯喹抑制溶酶体活性,也显著降低了营养物诱导的脂肪沉积,如图3b、图3e所示。
在线虫中,碱性螺旋环螺旋转录因子HLH-30(helix-loop-helix transcription factor)是TFEB的同源蛋白,其响应细胞的营养状况,调控溶酶体生物合成和脂解相关基因表达[21]。

图3 溶酶体抑制对营养物诱导的线虫脂肪沉积的影响
本文利用hlh-30突变体降低溶酶体的生物合成,结果发现,相对于N2线虫,hlh-30突变体显著抑制了葡萄糖或棕榈酸所诱导的溶酶体数量和酸化的增加,降低了线虫的脂肪沉积,如图3c、图3f所示。因此,溶酶体活性关键地调控了营养物诱导的线虫脂肪沉积。
2.4 mTORC1信号通路对线虫脂肪沉积的影响
在线虫中,一些保守的信号通路(如AMPK和mTORC1)已被证实参与了溶酶体营养状态的感应和线虫脂肪沉积的调控[8-9]。为了探究溶酶体调控线虫脂肪沉积所依赖的信号通路,本文利用这些信号通路关键分子的突变体aak-2(ok524)(AMPK信号相关)、daf-15(ok1412)(mTORC1信号相关)和rsks-1(ok1255)(mTORC1信号相关)进行更深入的研究。结果发现,与N2线虫相比,aak-2(ok524)、daf-15(ok1412)和rsks-1(ok1255)突变体的溶酶体数量和酸化水平及其脂肪沉积都是降低的。与对照组N2线虫相似,补充葡萄糖或棕榈酸显著增加了aak-2(ok524)突变体中溶酶体的数量和酸化,并且增加其脂肪沉积,如图4所示。然而,在daf-15(ok1412)和rsks-1(ok1255)突变体中补充葡萄糖或棕榈酸对溶酶体的数量、酸化以及脂肪沉积均没有显著作用。
这些现象与溶酶体抑制剂氯喹处理和hlh-30(tm1978)突变体抑制溶酶体活性、降低营养物诱导的线虫脂肪沉积的结果相似,进一步说明溶酶体参与了调控营养物诱导的脂肪沉积。结果表明,溶酶体通过mTORC1信号通路影响线虫能量营养过剩所导致的脂肪沉积。

图4 mTORC1信号通路介导溶酶体对线虫脂肪沉积的影响
3 结 论
本文将1 mmol/L葡萄糖或0.02 mmol/L棕榈酸补充到标准NGM中诱导线虫脂肪沉积。溶酶体作为营养再生中心,在感应细胞内外营养物质和细胞内的能量检测中发挥重要作用,随着脂肪沉积的增加,线虫溶酶体数量和酸化水平也显著增强,结果说明溶酶体可能参与了营养物诱导的线虫脂肪沉积。
本文利用溶酶体抑制剂氯喹和溶酶体生物合成关键转录因子hlh-30(tm1978)的突变体,确定抑制溶酶体活性能够降低线虫脂肪的沉积。并利用aak-2(ok524)、daf-15(ok1412)和rsks-1(ok1255)等多种突变体发现,溶酶体通过mTORC1信号通路影响线虫能量营养过剩所导致的脂肪沉积。
细胞处于饥饿状态下,细胞内溶酶体生物合成相关的主要调节因子TFEB跨核转运,进入细胞核内,促进溶酶体的生物合成,增加脂质分解代谢相关基因表达[22]。在营养限制的情况下,肝细胞中的脂滴通过与溶酶体直接的稳定接触,将蛋白质和脂质转移到溶酶体中进行降解,从而维持肝内脂质平衡[23]。因此,溶酶体感应细胞的饥饿状态,并参与了细胞的脂质分解代谢。但是,关于溶酶体参与营养过剩导致脂肪合成的作用还不明确。本研究在线虫中发现溶酶体活性在体内调控营养过剩导致脂肪沉积的作用及其分子机制,丰富了溶酶体在营养感应中的功能研究。
