脱落酸ABA受体的功能以及翻译后修饰研究进展
2023-04-29杨毅陈丽李小意
杨毅 陈丽 李小意


摘要:脱落酸(Abscisic Acid,ABA)作为植物六大激素之一,在植物应对干旱、渗透等逆境胁迫条件下,维持植物体本身内环境的稳态中都起重要作用. ABA受体RCARs/PYR/PYLs结合ABA后抑制PP2C的活性来激活ABA信号转导途径. ABA受体作为ABA信号传递中的核心成员,其翻译后修饰对其功能有重要意义.本文主要总结了ABA受体的功能以及泛素化、硝基化和磷酸化修饰对其功能的精细调控的研究进展,并对该领域需解决的问题进行了展望.总结发现,ABA受体的不同修饰对其功能的影响不同,因此其翻译后修饰的研究可能对培育抗逆农作物品种具有理论指导意义.
关键词:脱落酸; 脱落酸受体; 翻译后修饰; 泛素化; 磷酸化
中图分类号: Q945
文献标识码:A DOI:10.19907/j.0490-6756.2023.050003
收稿日期: 2023-05-30
基金项目: 国家自然科学基金(32370273); 四川大学-自贡市校地科技合作专项资金(2022CDZG-22)
通讯作者: 杨毅. E-mail: Yangyi528@scu.edu.cn
The progress on the function and post-translational modification of ABA receptors
YANG Yi, CHEN Li, LI Xiao-Yi
(Key Laboratory of Bio-Resources and Eco-Environment of Ministry of Educaion, College of Life Sciences, Sichuan University, Chengdu 610065, China)
Abscisic acid (ABA), as one of the six major phytohormones, plays an important role in maintaining the homeostasis of the internal environment under adverse stress conditions such as drought and osmotic stress. ABA receptors (RCARs/PYR/PYLs) bind to ABA and inhibit the activity of PP2C to activate the ABA signal transduction pathway. As a core member of ABA signaling, ABA receptors have post-translational modification (PTM) that is of great significance to their function in plant growth and development, and in responses to abiotic and biotic stresses. In this review, we summarize the recent works in RCARs functions and their fine regulation by PTM in plants and discuss new directions for future studies. In summary, different PTMs lead to variable functions of ABA receptors, thereby elucidation of PTMs would theoretically guide for cultivating stress-resistant crop varieties.
Abscisic acid (ABA); ABA receptors; Post-translational modification; Ubiquitination; Phosphorylation
1 引 言
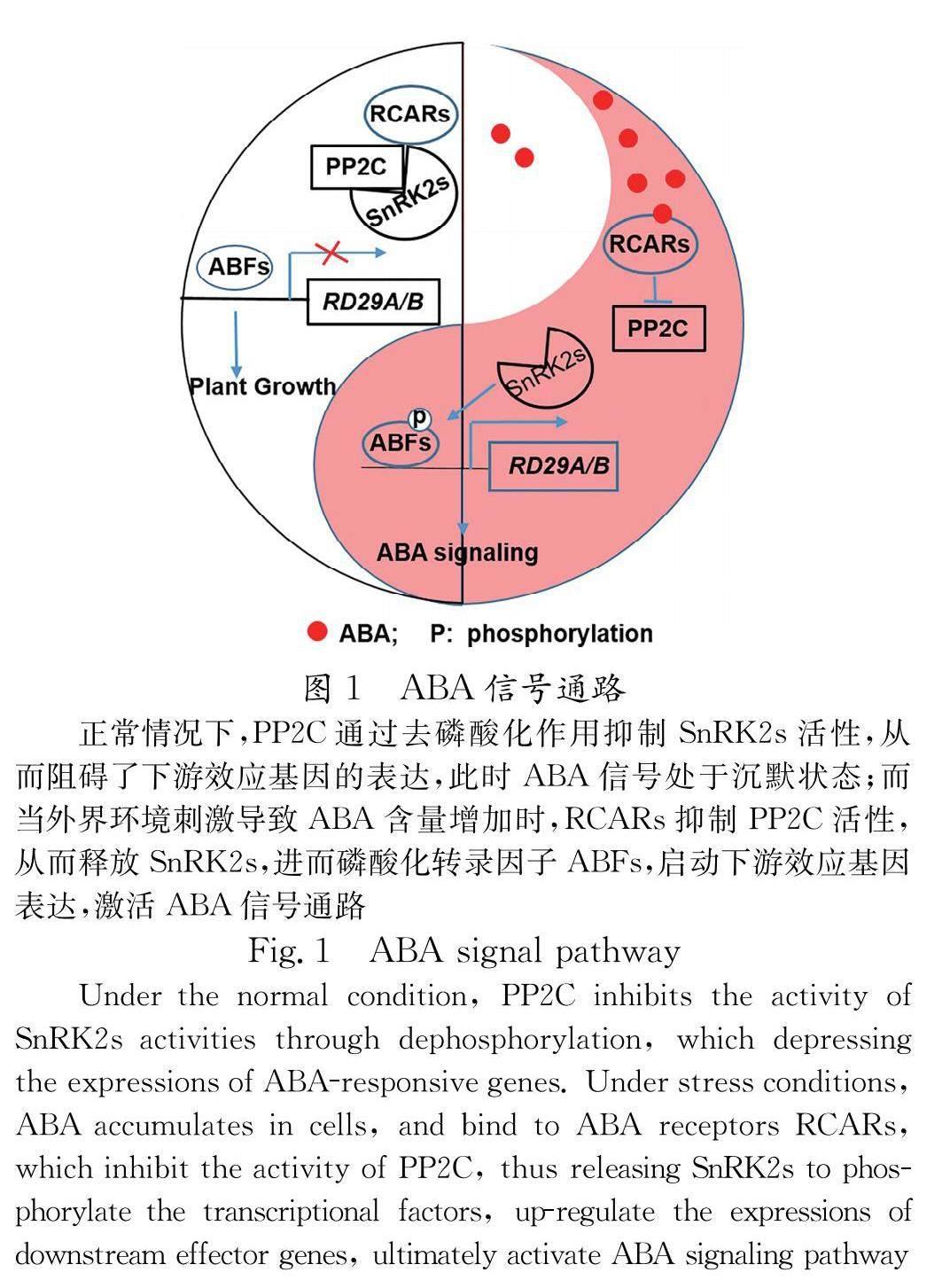
脱落酸(Abscisic acid, ABA)是一类具有倍半萜结构的物质,广泛存在于植物中.脱落酸在19世纪60年代在棉铃中被分离和鉴定.直到2009年,ABA 受体才由美国和德国的研究团队利用完全不同的研究手段于同一期的 Science 杂志独立发表.其中,Culter 研究小组从化学遗传学的角度出发,利用一种选择性的 ABA拮抗剂(pyrabactin)进行遗传筛选,最终鉴定出一个环化酶亚家族成员,同时隶属于含 START 结构域的超家族,PYRABACTIN RESISTANCE 1(PYR1) [1] .结果显示, PYR1 多重缺失突变体表现出很强的 ABA 不耐受性.德国实验室Grill 研究小组则利用遗传学方法中的酵母双杂交手段以磷酸酶PP2C成员ABI1和ABI2为诱饵筛选到与其互作的蛋白质,并命名为Regulatory Component of ABA Receptor 1/3 (RCAR1/3).两个研究小组的研究成果共同揭示了 ABA 信号通路的核心通路,即 PYR1/RCAR1與ABA 结合后抑制 Clade A PP2Cs 的活性,从而释放下游激酶SnRK2s,进而磷酸化转录因子ABF,最后启动效应基因的表达(图1).随后一系列文章证实PYR\\PYLs\\RCARs(本文都采用RCARs命名方式)是ABA受体 [2-6] .
在拟南芥中,ABA受体可以分为三个亚家族,第一家族包括RCAR1-RCAR4;第二亚家族成员:RCAR5-RCAR10;第三亚家族成员:RCAR11-RCAR12.第一亚家族和第二亚家族是主要以单体形式存在于细胞中;第三亚家族则是二聚体态形式;其中 RCAR13在植物体内是两种状态单体和二聚体 [6,7] .RCAR1、RCAR3、RCAR6、RCAR8、RCAR9、RCAR10、RCAR12和RCAR13结合ABA后,再与ABI1、ABI2或者HAB1相互作用,抑制PP2Cs磷酸酶活性 [1,8,9] .其他的受体不依赖ABA,即没有ABA的情况下,都能与PP2Cs结合.RCAR1、RCAR3和RCAR8与ABA的结合能力是第三亚家族成员(除RCAR13外)的50~90倍,解离系数约为1 μM [6,8] . ABA受体组织表达形式的有共性也有特性 [10] ,比如,5 d大小的幼苗中,RCAR8和RCAR11只要在根的上部分的皮层中,而RCAR3、RCAR11和RCAR14主要分布在根冠细胞中;RCAR3、RCAR8、RCAR11、RCAR12和RCAR14在微管组织中都有分布.
2 ABA受体的功能
ABA受体作为ABA信号的核心成员在调控植物应对干旱胁迫中起重要作用.例如,在拟南芥中分别过表达RCAR11、RCAR12、RCAR13和RCAR14能增强植物的耐旱性 [11] .棉花 GhPYL10 、 GhPYL12 和 GhPYL26 基因能够让拟南芥幼苗生长和种子萌发对ABA超敏感,植株的耐旱能力更强 [12] .木薯ABA受体MePYL8调控干旱胁迫 [13] . OsRCAR5过表达水稻中的ABA敏感性增强,同时,OsRCAR5也与PP2C相互作用 [14] .因此,在水稻中ABA信号传递与拟南芥类似.利用RD29A启动子在拟南芥和水稻中过表达 RCAR1 ,植株均表现出显著的抗旱性和干旱诱导的叶片衰老 [15] .过表达ABA受体 TaPYL1-1B 可以增强小麦的抗寒性和提高水分利用率,从而保证产量 [16] .在拟南芥中过表达葡萄中的ABA受体 VaPYL4 ( RCAR10 )可以增强植株抗旱和抗盐能力 [17] .转基因番茄OE- VaPYL9 具有较强的抗氧化酶活性和较高的脯氨酸含量,较低的丙二醛(MDA)和H 2 O 2 含量,并提高了清除活性氧的能力,进而增强番茄的抗逆性 [18] .最近的研究发现,ABA信号通路中的核心转录因子ABI5可以调控RCARs表达,从而反馈调节ABA信号途径 [19] . 因此,在植物中ABA受体作为ABA信号途径中保守参与植物抗旱响应.
除此之外,RCAR家族成员作为ABA受体不仅在ABA信号通路中起核心识别作用,也能够通过与其他蛋白质的相互作用发挥其他的调控功能.例如,PYL6 (RCAR9)与JA应答的关键转录因子MYC2存在互作,ABA会增强互作能力,从而连接了ABA和JA信号途径 [20] .此外,拟南芥中RCAR3、RCAR9、RCAR10、RCAR11和RCAR12分别与 CAR(C2-domain ABA-Related proteins)家族成员在钙离子存在的情况下互作,从而影响CAR家族的成员向磷脂囊泡中转运 [21] .进一步研究发现,CAR聚集在膜上形成Ca 2+ 依赖的正电膜曲率,从而招募RCARs应对细胞应激反应 [22] .
ABA受体不仅参与抗逆响应,同时在植物的生长发育过程中也起重要的作用(图2).本实验室的研究发现,RCAR1在体内外跟MYB转录因子MYB44相互作用 [23] . Zhao等也发现RCAR3与MYB77、MYB44 和MYB73相互作用,从而调控生长素相关基因表达,促进侧根生长 [24] . 随后的研究又发现 PYL9(RCAR1)PYL8(RCAR3) 双突导致ABA诱导的侧根生长休眠期延长,并削弱了ABA对主根生长和侧根形成的敏感性 [25] .Zhao等成功构建ABA受体的12重突变体,并揭示了它们参与ABA非依赖性的渗透胁迫诱导的SnRK2.2\\2.3\\2.6活性调控的新机制 [26] .另外, pyl1/4/6 突变体在自然水田条件下水稻长势好、产量高、种子正常休眠,但是其他的三重突变体 pyl1/2/4 、 pyl1/4/5 和 pyl1/3/4 并未出现这种现象 [27] .表明经过长期的进化,水稻PYLs在调控植株生长以及产量中发挥重要作用.PIFs转录因子PIF3\\4\\5可以与ABA受体RCAR1和RCAR3发生相互作用,而这种相互作用不受ABA的调节;同时RCAR1和RCAR3在黑暗中促进了PIF4蛋白积累,增强了PIF4与ABI5启动子的结合,上调ABI5的表达,但对PIF4介导的ABI5激活具有负调控作用 [28] .说明RCARs也参与植物暗形态建成.本实验室发现糖基转移酶UGT71C5有效地把ABA转化为失活型ABA-GE(糖基化ABA),从而调控植物体内ABA的内稳态,进而促进植物生长发育 [29] .进一步研究发现,UGT71C5可以与ABA受体相互作用,从而增强其糖基转移酶活性 [30] .Rab GTPase激活蛋白RabE1c 与ABA受体相互作用,通过未知的降解途径降解RCAR10,进而调控气孔运动和干旱胁迫响应 [31] .
RCAR家族基因在调节植物果实成熟中也起重要作用.例如, FaPYL9 转录水平随着草莓果实的成熟而升高,若干扰降低草莓果实中 FaPYL9 ( RCAR1 )表达导致草莓果实成熟期延迟3~5d,与草莓果实着色相关的 FaCHS 和 FaUFGT 基因的表达量以及果实中蔗糖含量以及花青素含量会降低,而ABA含量和果实硬度则会增加 [32] .所以,ABA受体FaPYL9在草莓果实成熟发育过程中也发挥重要作用.最近的研究发现,过表达番茄ABA受体 SlPYL9 ,植株在种子萌发、根生长和对干旱的响应方面表现出典型的ABA高敏感表型,同时,果实成熟显著加快5~7d,这是由于内源ABA积累增加和乙烯提前释放所致;相反, SlPYL9 -RNAi株系果实成熟延迟、中果皮厚度增加、花瓣脱落延迟、果实呈圆锥形/椭圆形和葫芦形 [33] . 在拟南芥中过表达葡萄ABA受体 VlPYL1 ( Grape Berry Skin )基因不仅能促进花青素积累,还能诱导ABA响应基因 ABF2 和 BG3 等表达 [34] .另外,在拟南芥中过表达葡萄( Vitis vinifera L.)ABA 受体 VvPYL1 促进根毛伸长 [35] . 因此,ABA受体也参与调控植物生长发育和果实成熟过程.
3 ABA受体的翻译后修饰
蛋白质翻译后修饰 (Post-translational Modifications, PTMs)指蛋白质翻译后的化学修饰,是真核细胞生命活动中的重要调节方式.在细胞内,蛋白质一般都是经过翻译后修饰才有功能.PTM不仅可以调控蛋白质结构,还能改变其定位、稳定性以及蛋白质功能.其中,常见PTM有磷酸化、糖基化、甲基化、酰基化、泛素化和硝基化等.本文将重点阐述ABA受体磷酸化、泛素化和氧化还原修饰在ABA信号转导中的作用及其最新研究进展(图3).
3.1 泛素化修饰
泛素是真核生物中高度保守的一类小肽,由76个氨基酸残基组成,它通过共价连接的方式把泛素小肽连接到底物蛋白质的赖氨酸残基上.泛素化过程通常经一系列的催化反应完成,由E1泛素激活酶、E2泛素结合酶和E3泛素连接酶将泛素连接到靶蛋白中 [36] .根据E3结构可以将其分为4大类: HECT(homology to E6-AP C-terminus)类、RING (really interesting new gene)类、U-box类以及CRL(cullin-ring)类 [37] .另外,泛素化修饰根据连接泛素的数量可分为单泛素化、多泛素化和多聚泛素化.单泛素化或多泛素化主要起修饰蛋白功能和调节蛋白定位等功能;而多聚泛素化通常偶联蛋白酶体(ubiquitin/26Sproteasome, Ub/26S蛋白酶体系)进行蛋白质的选择性降解,从而维持细胞内蛋白质的丰度.泛素化系统同样能够通过介导ABA受体RCARs在细胞水平的稳定性来调控植物体内对 ABA 信号的应答. 2014年首次发现ABA 受体PYL8/RCAR3受到了CLU4型多亚基E3连接酶DDA1(DET1-,DDB1-ASSOCIATED1)的调控,从而负调控ABA信号 [38] .本实验室也发现F-box型E3连接酶RIFP1泛素化RCAR3,从而调控干旱后RCAR3的水平 [39] .同样,PUB型泛素连接酶PUB22和PUB23通过降解RCAR1,从而负调控植物耐旱响应 [40] .多亚基CUL4-DDB1-DWD型E3连接酶AtRAE1同样也能泛素化RCAR1,进而参与ABA信号通路的调控 [41] .同样类型的E3连接酶RFA1和RFA4与E2结合酶UBC26互作后结合PYR1(RCAR11)、PYL4(RCAR10)、PYL5 (RCAR8)和PYL8(RCAR3)等ABA受体 [42] .
泛素化修饰后经蛋白酶体途径是较普遍的一种内源蛋白质降解方式.不过,植物在进化过程中,为了适应多变以及复杂的环境,进化出不依赖于26S蛋白酶体,称之为非26S蛋白酶体内膜转运体系,包括胞内体转运和自噬泡途径.同样,ABA受体也有通过非26S蛋白酶体的方式降解,维持其体内的动态平衡.定位于质膜上RING型E3连接酶RSL1与RCAR10/11在质膜上互作,进而调控它们的半衰期 [43] . 进一步研究发现RSL1和RCAR10的互作发生在细胞质膜和高尔基体反面网络/初级内体(TGN/EE)上,用囊泡运输抑制剂BFA处理后,RCAR10在微粒体中的积累增加,表明RCAR10不仅通过Ub/26S体系降解,同时还存在其它降解途径 [43] .随后的研究发现转运必需内体分选复合体组分FYVE1/FREE1与RCAR10互作,通过液泡途径降解RCAR10 [44] .另外,内膜运输途径的ESCRT-I 复合体组分VPS23A 识别RCAR10,促进RCAR10进入内膜运输途径,从而进入液泡进行降解,最终调控ABA受体的定位和稳定性 [45] .进一步的研究发现FYVE1、VPS23A和 ESCRT-Ⅲ相关蛋白质ALIX (PROTEIN-X)互作,形成复合物后识别RCAR10,促进其降解 [46] .2020年,谢旗课题组的研究揭示E3泛素连接酶XBAT35可以降解VPS23A,从而反馈调控ABA受体的稳定性 [47] .该课题组进一步研究发现去泛素连接酶UBP12/13通过去泛素化VPS23A,从而稳定内膜分选复合体组分VPS23A,进而调控ABA受体的稳定性,最终调控植物耐旱性,另外UBP12\\13也能稳定E3连接酶XBAT35 [48] . 这些研究表明,植物在ABA响应过程中进化出精密而复杂的调控网络,保证植物的繁衍以及扩张.
3.2 硝基化修饰
一氧化氮(NO)可能会抑制ABA信号转导,因为NO缺乏植株对ABA超敏感,而经NO处理后,受体结合ABA能力减弱 [49] .因而推测NO处理后植物RCARs的酪氨酸残基被硝基化,引发受体泛素化修饰,从而导致受体被26S蛋白酶体识别并降解.后来的研究发现,NO通过调节ABA受体的稳定来抑制植物下胚轴伸长 [50] .另外,二氧化氮(NO 2 )可诱导PYR/PYL/RCAR的酪氨酸硝化降解,并上调雷帕霉素靶蛋白(TOR)以刺激植物生长 [51] .
3.3 磷酸化修饰
磷酸化修饰是一种普遍的蛋白质翻译后修饰方式,在细胞信号转导的过程中起重要作用.同样,ABA受体RCARs受到不同类型的蛋白质激酶磷酸化.2018年,朱健康团队研究揭示了植物雷帕霉素靶蛋白(Target of Rapamycin, TOR)激酶磷酸化RCAR10的114位保守的丝氨酸(S)位点,导致RCAR10不能结合ABA以及抑制磷酸酶PP2C活性,从而阻断了ABA信号传递 [52] .另外,ABA激活核心蛋白激酶SnRK2s,随后磷酸化TOR复合体中的组分Raptor B,促进TOR复合体解离,抑制TOR活性 [52] .同年,本实验发现类受体蛋白激酶CARK1磷酸化RCAR3的T77位点和RCAR11的T78位点,从而抑制PP2C活性,进而促进ABA信号传导,最终正调控植物抗旱响应 [53] .进一步研究发现CARK1/3/6偏好于磷酸化ABA受体的第三亚家族成员RCAR11-14 [54-56] .深入研究解析发现,CARKs家族成员之间能形成同源或异源二聚体,因此偏好于磷酸化二聚体态的RCARs,进而解离ABA受体的二聚态,增强ABA结合能力;另外,还发现ABI5能调控 CARK1/3 转录 [57] .因此,CARKs-RCARs-ABI5形成调控环,协同调控植物耐旱响应.此外,蛋白激酶AEL磷酸化 RCAR12 S136\\182 磷酸化位点,促进其泛素化,使其被26S蛋白酶体降解 [58] .跟TOR不同,CEPR2 磷酸化RCAR10的S54位点,使其稳定性降低,促进其降解,从而参与植物抗 逆过程 [59] .因此,ABA受体受到多种蛋白质激酶的磷酸化调控,不同的蛋白质激酶调控机制不同,即RCARs被磷酸化后稳定降低或者是结构改变促进ABA结合.
4 总结与展望
在调控植物的生长发育以及对环境胁迫的适应性响应方面,ABA扮演了一个非常重要的角色.自ABA受体被鉴定后,大量的分子生物学、生物化学、遗传学和生理学研究解析了ABA受体的功能以及ABA信号途径在植物生长发育和应对胁迫的作用. RCARs蛋白质翻译后修饰对它们的功能具有重要的调控.多聚泛素化修饰可以维持RCARs在细胞水平的动态平衡,但是目前为止没有去泛素化的报道;RCARs硝基化的研究尚浅,需要更多的数据阐述它在ABA信号通路中的功能;RCARs磷酸化修饰,不同的蛋白质激酶靶向不同的磷酸化位点,从而引起不同响应:可能影响它们的稳定性,也可能改变它们的结构.目前RCARs的乙酰化修饰、糖基化修饰还未被发现,因此,利用免疫沉淀联动质谱分析或者酵母双杂交技术,将找出更多RCARs的上游组分及其功能特征.在作物抗逆方面,可以利用编辑技术来平衡RCARs受体在生长发育和抗逆中的作用,在增强作物的耐旱性的同时提高产量.综上所述,ABA作为细胞内重要的激素分子,解析ABA信号通路在植物特别是农作物生长发育以及逆境胁迫应答具有重要意义.
参考文献:
[1] Park S Y, Fung P, Nishimura N, et al . Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins [J]. Science, 2009, 324: 1068.
[2] Melcher K, Ng L M, Zhou X E, et al . A gate-latch-lock mechanism for hormone signalling by abscisic acid receptors [J]. Nature, 2009, 462: 602.
[3] Fujii H, Chinnusamy V, Rodrigues A, et al . In vitro reconstitution of an abscisic acid signalling pathway [J]. Nature, 2009, 462: 660.
[4] Miyazono K, Miyakawa T, Sawano Y, et al . Structural basis of abscisic acid signalling[J]. Nature, 2009, 462: 609.
[5] Noriyuki N, Kenichi H, Arvai A S, et al . Structural mechanism of abscisic acid binding and signaling by dimeric PYR1 [J]. Science, 2009, 326: 1373.
[6] Santiago J, Dupeux F, Round A, et al .The abscisic acid receptor PYR1 in complex with abscisic acid[J]. Nature, 2009, 462: 665.
[7] Zhang X, Zhang Q, Xin Q, et al. Complex structures of the abscisic acid receptor PYL3/RCAR13 reveal a unique regulatory mechanism[J]. Structure, 2012, 20: 780.
[8] Szostkiewicz I, Richter K, Kepka M, et al . Closely related receptor complexes differ in their ABA selectivity and sensitivity [J]. Plant J, 2010, 61: 25.
[9] Santiago J, Rodrigues A, Saez A, et al . Modulation of drought resistance by the abscisic acid receptor PYL5 through inhibition of clade A PP2Cs[J]. Plant J, 2009, 60: 575.
[10] Gonzalez-Guzman M, Pizzio G A, Antoni R, et al . Arabidopsis PYR/PYL/RCAR receptors play a major role in quantitative regulation of stomatal aperture and transcriptional response to abscisic acid[J].Plant Cell, 2012, 24: 2483.
[11] Li X, Li G, Li Y, et al. ABA receptor subfamily Ⅲ enhances abscisic acid sensitivity and improves the drought tolerance of Arabidopsis [J]. Int J Mol Sci, 2018, 19: 1938.
[12] Chen Y, Feng L, Wei N, et al . Overexpression of cotton PYL genes in Arabidopsis enhances the transgenic plant tolerance to drought stress[J]. Plant Physiol Biochem, 2017, 115: 229.
[13] 颜彦, 铁韦韦, 丁 泽红, 等. 木薯MePYL8基因克隆及表达分析[J]. 分子植物育种, 2018, 16: 4498.
[14] Kim H, Hwang H, Hong J W, et al . A rice orthologue of the ABA receptor, OsPYL/RCAR5, is a positive regulator of the ABA signal transduction pathway in seed germination and early seedling growth [J]. J Exp Bot, 2012, 63: 1013.
[15] Yang Z, Chan Z, Gao J, et al . ABA receptor PYL9 promotes drought resistance and leaf senescence[J]. Proc Natl Acad Sci USA, 2016, 113: 1949.
[16] Mao H, Jian C, Cheng X, et al . The wheat ABA receptor gene TaPYL1-1B contributes to drought tolerance and grain yield by increasing water-use efficiency [J]. Plant Biotechnol J, 2021, 20: 846.
[17] Ren C, Kuang Y, Lin Y, et al . Overexpression of grape ABA receptor gene VaPYL4 enhances tolerance to multiple abiotic stresses in Arabidopsis [J]. BMC Plant Biol, 2022, 22: 271.
[18] Nai G, Liang G, Ma W, et al . Overexpression VaPYL9 improves cold tolerance in tomato by regulating key genes in hormone signaling and antioxidant enzyme [J]. BMC Plant Biol, 2022, 22: 344.
[19] Zhao H, Nie K, Zhou H, et al. ABI5 modulates seed germination via feedback regulation of the expression of the PYR/PYL/RCAR ABA receptor genes [J]. New Phytol, 2020, 228: 596.
[20] Aleman F, Yazaki J, Lee M, et al. An ABA-increased interaction of the PYL6 ABA receptor with MYC2 transcription factor: a putative link of ABA and JA signaling [J]. Sci Rep, 2016, 6: 28941.
[21] Rodriguez L, Gonzalez-Guzman M, Diaz M, et al. C2-Domain abscisic acid-related proteins mediate theinteraction of PYR/PYL/RCAR abscisic acid receptors with the plasma membrane and regulate abscisic acid sensitivity in Arabidopsis [J]. Plant Cell, 2014, 26: 802.
[22] Diaz M, Sanchez-Barrena M J, Gonzalez-Rubio J M, et al. Calcium-dependent oligomerization of CAR proteins at cell membrane modulates ABA signaling [J]. Proc Natl Acad Sci USA, 2016, 113: E396.
[23] Li D, Li Y, Zhang L, et al. Arabidopsis ABA receptor RCAR1/PYL9 interacts with an R2R3-Type MYB transcriptionfactor, AtMYB44 [J]. Int J Mol Sci, 2014, 15: 8473.
[24] Zhao Y, Xing L, Wang X, et al. The ABA receptor PYL8 promotes lateral root growth by enhancing MYB77-dependent transcription of auxin-responsive genes [J]. Sci Signal, 2014, 7: ra53.
[25] Xing L, Zhao Y, Gao J, et al. The ABA receptor PYL9 together with PYL8 plays an important role in regulating lateral root growth[J]. Sci Rep, 2016, 6: 27177.
[26] Zhao Y, Zhang Z, Gao J, et al. Arabidopsis Duodecuple mutant of PYL ABA receptors reveals PYL repression of ABA-independent SnRK2 activity [J]. Cell Rep, 2018, 23: 3340.
[27] Miao C, Xiao L, Hua K, et al. Mutations in a subfamily of abscisic acid receptor genes promote rice growth and productivity[J]. Proc Natl Acad Sci USA, 2018, 115: 6058.
[28] Qi L, Liu S, Li C, et al. PHYTOCHROME-INTERACTING FACTORS interact with the ABA receptors PYL8 and PYL9 to orchestrate ABA signaling in darkness [J]. Mol Plant, 2020, 13: 414.
[29] Liu Z, Yan J, Li D, et al . UGT71C5, a major glucosyltransferase mediates ABA homeostasis in Arabidopsis thaliana[J]. Plant Physiol, 2015, 167: 1659.
[30] Ma Y, Cao J, Chen Q, et al . Abscisic acid receptors maintain abscisic acid homeostasis by modulating UGT71C5 glycosylation activity[J]. J Integr Plant Biol, 2021, 63: 543.
[31] Chen D, He L, Lin M, et al . A ras-related small GTP-binding protein, RabE1c, regulates stomatal movements and drought stress responses by mediating the interaction with ABA receptors [J]. Plant Sci, 2021, 306: 110858.
[32] 颜志明, 王全智, 冯英娜, 等. FaPYL9基因调控草莓果实成熟的分子机理[J]. 西北植物学报, 2015, 35: 2379.
[33] Kai W, Wang J, Liang B, et al. PYL9 is involved in the regulation of ABA signaling during tomato fruit ripening [J]. J Exp Bot, 2019, 70: 6305.
[34] Gao Z, Li Q, Li J, et al . Characterization of the ABA receptor VlPYL1 that regulates anthocyanin accumulation in grape berry skin[J]. Front Plant Sci, 2018, 9: 592.
[35] Li H, Gao Z, Chen Q, et al. Grapevine ABA receptor VvPYL1 regulates root hair development in transgenic Arabidopsis [J]. Plant Physiol Biochem, 2020, 149: 190.
[36] Morreale F E, Walden H. Types of Ubiquitin Ligases [J]. Cell, 2016, 165: 248.
[37] Miricescu A, Goslin K, Graciet E. Ubiquitylation in plants: signaling hub for the integration of environmental signals [J]. J Exp Bot, 2018, 69: 4511.
[38] Irigoyen M L, Iniesto E, Rodriguez L, et al. Targeted degradation of abscisic acid receptors is mediated by the ubiquitin ligase substrate adaptor DDA1 in Arabidopsis [J]. Plant Cell, 2014, 26: 712.
[39] Li Y, Zhang L, Li D, et al .The Arabidopsis F-box E3 ligase RIFP1 plays a negative role in abscisic acid signalling by facilitating ABA receptor RCAR3 degradation[J]. Plant Cell Environ, 2015, 39: 571.
[40] Zhao J, Zhao L, Zhang M, et al . Arabidopsis E3 ubiquitin ligases PUB22 and PUB23 negatively regulate drought tolerance by targeting ABA receptor PYL9 for degradation [J]. Int J Mol Sci, 2017, 18: 1841.
[41] Li D, Zhang L, Li X, et al. AtRAE1 is involved in degradation of ABA receptor RCAR1 and negatively regulates ABA signaling in Arabidopsis [J]. Plant Cell Environ, 2017, 41: 231.
[42] Fernandez MA, Belda-Palazon B, Julian J, et al. RBR-type E3 ligases and the Ub-conjugating enzyme UBC26 regulate ABA receptor levels and signaling [J]. Plant Physiol, 2019,182: 1723.
[43] Bueso E, Rodriguez L, Lorenzo-Orts L, et al. The single-subunit RING-type E3 ubiquitin ligase RSL1 targets PYL4 and PYR1 ABA receptors in plasma membrane to modulate abscisic acid signaling[J]. Plant J, 2015, 80: 1057.
[44] Belda-Palazon B, Rodriguez L, Fernandez M A, et al . FYVE1/FREE1 interacts with the PYL4 ABA receptor and mediates its delivery to the vacuolar degradation pathway[J]. Plant Cell, 2016, 28: 2291.
[45] Yu F, Lou L, Tian M, et al. ESCRT-I component VPS23A affects ABA signaling by recognizing ABA receptors for endosomal degradation[J]. Mol Plant, 2016, 9: 1570.
[46] Garcia-Leon M, Cuyas L, Abd El-Moneim D, et al . Stomatal aperture and turnover of ABA receptors are regulated by Arabidopsis ALIX [J]. Plant Cell, 2019, 31: 2411.
[47] Yu F, Cao X, Liu G, et al . ESCRT-I component VPS23A is targeted by E3 ubiquitin ligase XBAT35 for proteasome-mediated degradation in modulating ABA signaling [J]. Mol Plant, 2020, 13: 1556.
[48] Liu G, Liang J, Lou L, et al . The deubiquitinases UBP12 and UBP13 integrate with the E3 ubiquitin ligase XBAT35.2 to modulate VPS23A stability in ABA signaling [J]. Sci Adv, 2022, 8: eabl5765.
[49] Castillo M C, Lozano-Juste J, González-Guzmán M, et al . Inactivation of PYR/PYL/RCAR ABA receptors by tyrosine nitration may enable rapid inhibition of ABA signaling by nitric oxide in plants[J]. Sci Signal, 2015, 8: ra89.
[50] Castillo M C, Coego A, Costa-Broseta , et al . Nitric oxide responses in Arabidopsis hypocotyls are mediated by diverse phytohormone pathways[J]. J Exp Bot, 2018, 69: 5265.
[51] Takahashi M, Morikawa H. Nitrogen dioxide at ambient concentrations induces nitration and degradation of PYR/PYL/RCAR receptors to stimulate plant growth: a hypothetical model [J]. Plants (Basel), 2019, 8: 198.
[52] Wang P, Zhao Y, Li Z, et al. Reciprocal regulation of the TOR kinase and ABA receptor balances plant growth and stress response[J]. Mol Cell,2018, 69: 100.
[53] Zhang L, Li X, Li D, et al. CARK1 mediates ABA signaling by phosphorylation of ABA receptors [J]. Cell Discov, 2018, 4: 30.
[54] Wang H H, Qiu Y, Yu Q, et al . Close arrangement of CARK3 and PMEIL affects ABA-mediated pollen sterility in Arabidopsis thaliana [J]. Plant Cell Environ, 2020, 43: 2699.
[55] Wang J, Zhang Q, Yu Q, et al. CARK6 is involved in abscisic acid to regulate stress responses in Arabidopsis thaliana [J]. Biochem Biophys Res Commun, 2019, 513: 460.
[56] Li X, Kong X, Huang Q, et al. CARK1 phosphorylates subfamily Ⅲ members of ABA receptors[J]. J Exp Bot,2019, 70: 519.
[57] Li X, Xie Y, Zhang Q, et al. Monomerization of abscisic acid receptors through CARKs-mediated phosphorylation [J]. New Phytol, 2022, 235: 533.
[58] Chen H H, Qu L, Xu Z H, et al. EL1-like casein kinases suppress ABA signaling and responses by phosphorylating and destabilizing ABA receptors PYR/PYLs in Arabidopsis [J]. Mol Plant, 2018, 11: 706.
[59] Yu Z, Zhang D, Xu Y, et al. CEPR2 phosphorylates and accelerates the degradation of PYR/PYLs in Arabidopsis [J]. J Exp Bot, 2019, 70: 5457.
