新兴免疫阻断分子在肝细胞癌发生发展中的作用
2023-04-29陶莹廖长秀
陶莹 廖长秀
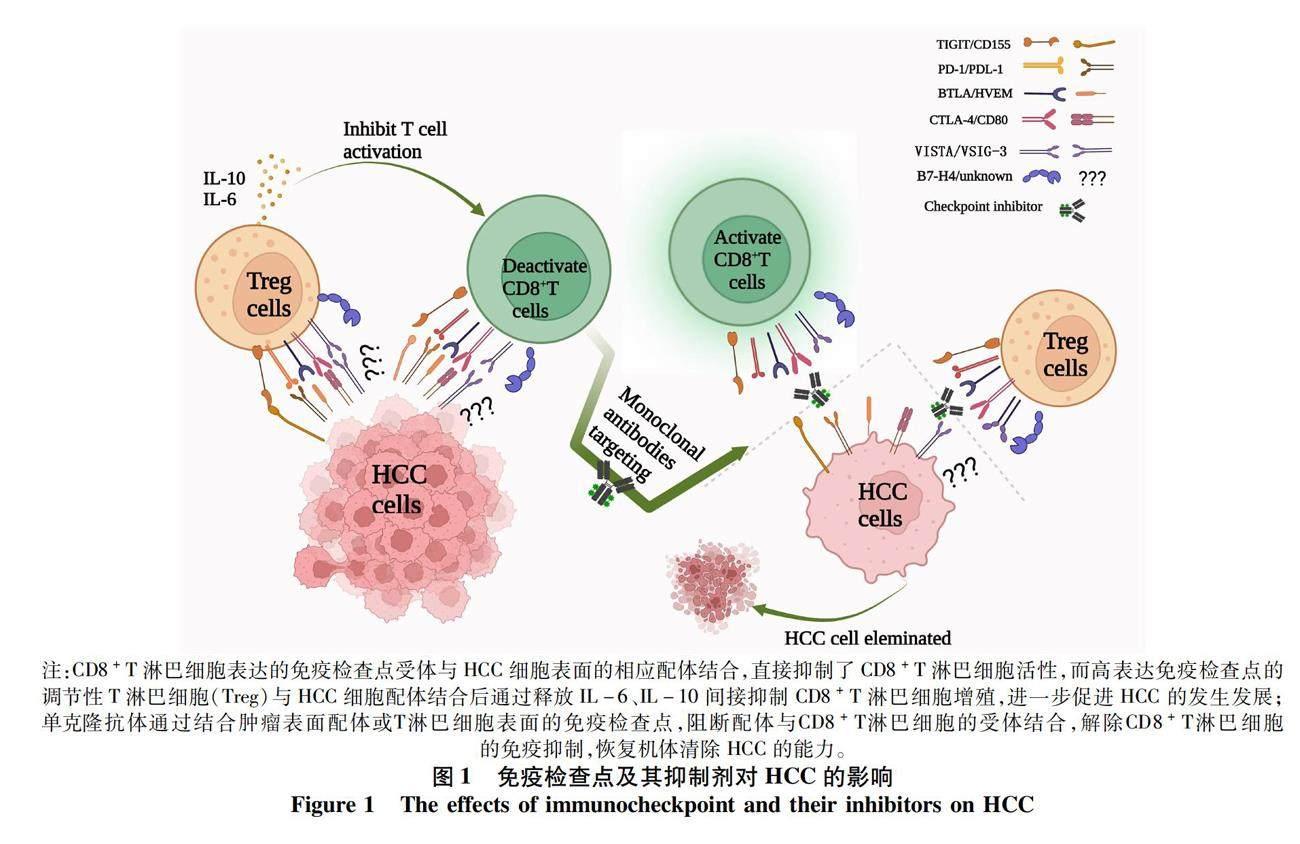
摘要:肝細胞癌(HCC)是世界范围内最常见的恶性肿瘤之一。程序性死亡受体1及其配体和细胞毒T淋巴细胞相关蛋白4等免疫检查点抑制剂的面世为HCC的治疗带来了重大突破。但由于HCC为高异质性肿瘤,单药治疗仅对少部分患者有效且可能因耐药而无法持久获益,因此仍需探索新的免疫检查点抑制剂在HCC防治中的潜力。本文分析和归纳了新型免疫检查点T淋巴细胞免疫球蛋白和免疫受体酪氨酸抑制基序结构域(TIGIT)、T淋巴细胞激活抑制物免疫球蛋白可变区结构域(VISTA)、B和T淋巴细胞弱化因子(BTLA)及含V-set域T淋巴细胞激活抑制因子(B7-H4)的生物学特性以及在HCC癌组织中的表达与功能。分析表明TIGIT、VISTA、BTLA和B7-H4在HCC癌组织中高表达,与HCC患者预后差相关,靶向阻断相应通路可有效抑制HCC进展,是极具潜力的肿瘤治疗靶点,深入研究可为HCC免疫治疗提供新方向。
关键词:癌, 肝细胞; 免疫抑制剂; 分子靶向治疗
基金项目:国家自然科学基金(81660642); 广西学位与研究生教育改革课题(JGY2022278)
Role of new potential immune blocking molecules in the development and progression of hepatocellular carcinoma
TAO Ying1,2, LIAO Zhangxiu1. (1. School of Pharmacy, Youjiang Medical University for Nationalities, Bose, Guangxi 533000, China; 2. School of Basic Medical Sciences, Youjiang Medical University for Nationalities, Bose, Guangxi 533000, China)
Corresponding author: LIAO Zhangxiu, liaozhangxiu@163.com (ORCID:0000-0001-5130-0642)
Abstract:
Hepatocellular carcinoma (HCC) is one of the most common malignant tumors around the world. The emergence of immune checkpoint inhibitors targeting programmed death-1/programmed death-ligand 1 and cytotoxic T lymphocyte-associated antigen-4 has brought great breakthroughs in the treatment of HCC. However, since HCC is a type of tumor with high heterogeneity, monotherapy is only effective for a small number of patients and may not be able to achieve long-lasting benefits due to drug resistance, and therefore, it is necessary to explore the potential of new immune checkpoint inhibitors in the prevention and treatment of HCC. This article analyzes and summarizes the biological characteristics of the new immune checkpoints T cell immunoglobulin and ITIM domain (TIGIT), V-domain immunoglobulin suppressor of T-cell activation (VISTA), B and T lymphocyte attenuator (BTLA), and B7 homologous protein-4 (B7-H4) and their expression and function in HCC. The analysis shows that TIGIT, VISTA, BTLA, and B7-H4 are highly expressed in HCC tissue and are associated with the prognosis of HCC patients, and targeted blocking of corresponding pathways can effectively inhibit the progression of HCC, suggesting that these molecules are potential targets for tumor treatment and that in-depth studies can provide new directions for HCC immunotherapy.
Key words:
Carcinoma, Hepatocellular; Immunosuppressive Agents; Molecular Targeted Therapy
Research funding:
National Natural Science Foundation of China (81660642); Degree and Graduate Education Reform Project in Guangxi (JGY2022278)
根据2020年世界癌症报告[1]显示,全球原发性肝癌的新发病例数为905 677例,其中我国新发病例数为410 038例[2],约占全球的45.3%,肝细胞癌(HCC)为主要发病类型(占75%~85%),我国已成为全球HCC负担最重的国家之一。早期HCC治疗首选手术切除,但大多数患者初诊时已为晚期,失去手术治疗的机会,中位生存期不足1年[3],严重影响患者的生命安全。HCC免疫原性较高,在病毒及肿瘤抗原的不断刺激下,其表面负性共刺激分子表达水平升高,细胞因子分泌减少,致使免疫微环境失衡,肿瘤中心的T淋巴细胞数量较少,出现T淋巴细胞耗竭,促进免疫逃逸的发生和HCC发生发展[4-5]。
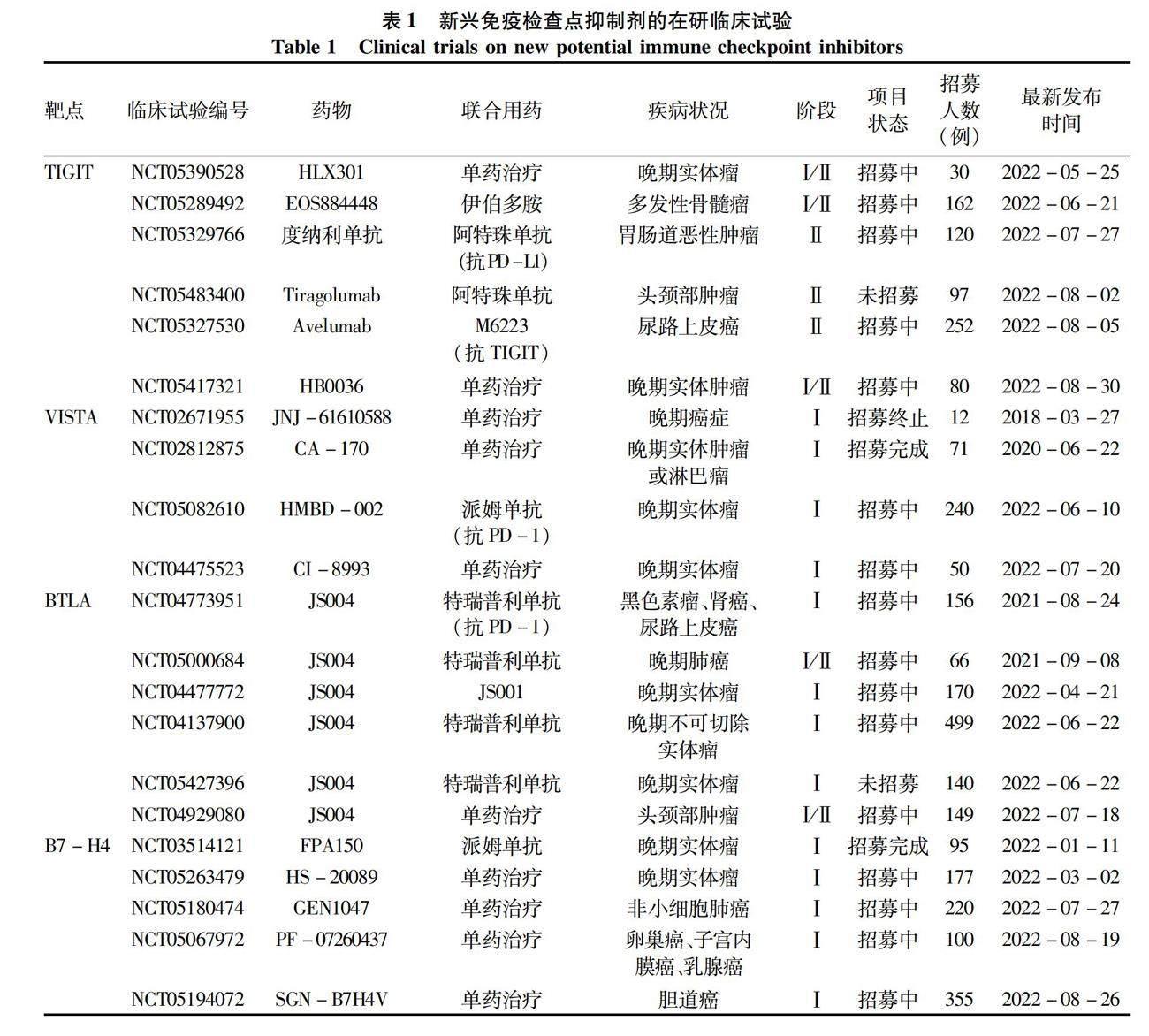
免疫负性共刺激分子是一类重要的免疫调节蛋白,与配体结合产生抑制信号,抑制免疫细胞的过度活化和增殖,并在免疫应答期间保护周围组织免受损伤[6]。目前研究较多的负性共刺激分子有程序性死亡受体1(programmed death-1, PD-1)、细胞毒T淋巴细胞相关蛋白4(cytotoxic T lymphocyte associated antigen-4, CTLA-4)、淋巴细胞活化基因-3(lymphocyte activation gene-3, LAG-3)和T淋巴细胞免疫球蛋白黏蛋白-3(T cell immune globulin-and mucin domain containing molecule-3, TIM-3)。以抗PD-1及其配体(PD-L1)抗体(纳武单抗、派姆单抗、阿特珠单抗)和抗CTLA-4抗体(伊匹单抗、曲美木单抗)为代表的经典免疫检查点抑制剂在HCC治疗中展现出不俗的优势[7-8],但由于部分患者存在天然耐受、后期耐药及免疫不良反应等问题,导致其对免疫检查点抑制剂无法产生持久的反应[9]。近年来新型免疫检查点分子T淋巴细胞免疫球蛋白和免疫受体酪氨酸抑制基序结构域(T cell immunoglobulin and ITIM domain, TIGIT)、T淋巴细胞激活抑制物免疫球蛋白可变区结构域(V-domain immunoglobulin suppressor of T-cell activation, VISTA)、B/T淋巴细胞弱化因子(B and T lymphocyte attenuator, BTLA)及含V-set域T淋巴细胞激活抑制因子(B7 homologous protein-4, B7-H4)的出现,拓展了HCC治疗靶点的范围,免疫检查点单克隆抗体通过阻断免疫受体与配体的结合,增强机体抗癌效应(图1)。这些新出现的免疫检查点抑制剂中,部分已针对肿瘤治疗开展临床试验(表1,数据来源于clinicaltrials.gov),是未来HCC免疫检查点抑制剂联合治疗中不可或缺的一部分。本文就当前新兴的免疫阻断分子在HCC中的研究进展进行阐述。
1 TIGIT在HCC中的研究进展
TIGIT,也称为Vsig9、Vstm3,是一种与PD-1和TIM-3类似的共抑制分子,在T淋巴细胞和自然杀伤细胞(NK细胞)中表达,并抑制这些细胞的活化[10]。其基因定位于染色体3q13.31,由免疫球蛋白可变片段、Ⅰ型跨膜蛋白结构域和免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif, ITIM)3个功能部分组成[11]。研究[12]表明,ITIM基序是一个关键结构域,其负责TIGIT在NK细胞上的表达并抑制NK细胞杀伤力。TIGIT的配体包括脊髓灰质炎病毒受体(也被称为CD155)、脊髓灰质炎病毒受体相关蛋白2和脊髓灰质炎病毒受体相关蛋白3,其中CD155亲和力最强。TIGIT可通过与CD155结合产生IL-10从而抑制CD8+T淋巴细胞增殖和IFNγ、TNFα以及IL-17的产生,进而降低机体抗肿瘤效应[12]。
多项研究均发现TIGIT在HCC中表达增高。HCC患者组织样本的肿瘤浸润性CD8+T淋巴细胞检测到TIGIT表达[13]。HCC患者外周血中同样发现TIGIT在CD4+T淋巴细胞、CD8+T淋巴细胞上表达增高,且高表达TIGIT的T淋巴细胞凋亡率明显增加[14]。HBV感染是我国肝癌的主要诱因,有研究[15]在HBV携带小鼠NK细胞和T淋巴细胞中也发现了TIGIT的高表达。进一步研究表明,高表达的TIGIT参与HCC中T淋巴細胞耗竭和肝癌细胞的生物学功能。Ostroumov等[13]首次通过小鼠肝癌模型转录组分析将TIGIT鉴定为T淋巴细胞衰竭的标志物,与PD-1相比,TIGIT可导致细胞因子TNFα和IFNγ的水平下降,造成T淋巴细胞耗竭,并能识别处于不同分化阶段耗竭的CD8+T淋巴细胞。刘娟喜[14]在探讨TIGIT负性共刺激分子调控肝癌细胞、免疫细胞生物学功能的机制研究发现,将TIGIT siRNA、CD155 siRNA分别转染至肝癌细胞后均可显著抑制肝癌细胞体外的增殖、迁移和侵袭能力,促进肝癌细胞凋亡。
以上研究表明,TIGIT在HCC发生发展过程中具有重要作用,抑制TIGIT将可能恢复CD8+T淋巴细胞而达到抗HCC的作用。Ge等[16]发现对抗PD-1无应答的HCC肿瘤浸润淋巴细胞在进行TIGIT/PD-1双阻断后,CD8+T淋巴细胞的增殖、细胞因子的产生和细胞毒作用均有所增加。Ostroumov等[13]联合使用PD-1和TIGIT抑制剂可协同抑制小鼠体内肝癌的生长。以上研究提示TIGIT/PD-1共阻断可增强机体抗肿瘤能力。此外,也有研究[15]发现抗体阻断HBV携带小鼠TIGIT后,小鼠血清HBsAg转阴率增高,肝脏中NK细胞及T淋巴细胞数量增加。以上研究提示,在HBV免疫治疗中靶向阻断TIGIT,或可抑制由HBV发展而来的HCC发展。
许多临床试验正在评估抗TIGIT单克隆抗体作为单一疗法或与PD-1/PD-L1联合阻断治疗各种癌症的安全性和有效性。自2019年以来关于抗TIGIT治疗肿瘤的临床试验共有33项,其中2022年注册的研究有6项(表1)。一项 Ⅱ 期CITYSCAPE试验[17]研究了抗TIGIT 抗体Tiragolumab联合抗PD-L1抗体Atezolizumab在PD-L1阳性非小细胞肺癌中的显著缓解率,结果显示,联合组与单药组相比,客观缓解率显著提高(37% vs 21%),无进展生存期延长(5.6个月vs 3.9个月,风险比为0.58)。综上所述,抑制TIGIT将是一种很有前景的抗肿瘤免疫治疗策略。
2 VISTA在HCC中的研究进展
VISTA是一种抑制性B7家族免疫检查点分子,由位于10号染色体基因VISIR编码[18]。VISTA蛋白主要表达于外周血和正常脾脏的髓系中,在多种髓系造血细胞(如单核细胞、巨噬细胞、树突状细胞)、T淋巴细胞(如CD4+T淋巴细胞、FoxP3+ Treg、TCRγδ T淋巴细胞、CD8+T淋巴细胞)和NK细胞表面表达[19]。VISTA为Ⅰ型跨膜蛋白,N末端为免疫球蛋白(Ig)V结构域,柄由30个氨基酸组成,胞质尾有95个氨基酸。VISTA蛋白分子量为55~65 kD。VISTA亦被称为PD-1同源物,但与PD-1不同的是,VISTA结构不包含经典胞质结构中的ITIM或免疫受体酪氨酸转换基序(immunoreceptor tyrosine-based switch motif, ITSM),而在胞内尾部包含2个潜在的蛋白激酶C结合位点和可能起作用的脯氨酸富集区作为对接位点,提示VISTA可能同时具有受体和配体的功能[20]。最新研究[21]发现含V-set和lg结构域3(V-set and immunoglobulin domain containing 3, VSIG-3)为VISTA的配体,VSIG-3或VISTA的多点突变会削弱二者之间的相互作用。当VISTA在T淋巴细胞表面表达时,可发挥受体的作用,接受免疫刺激信号,增强原始T淋巴细胞的免疫沉默[22],并直接抑制CD4+T淋巴细胞、CD8+T淋巴细胞、TCRγδ T淋巴细胞的激活与功能,促进Treg的分化[23]。
目前,VISTA在HCC中的表达及影响相关研究持续深入。HCC中VISTA主要表达于肝间质淋巴细胞,该分子高表达患者肿瘤体积更大、总体生存期缩短,是HCC患者死亡的独立风险因素[24]。Shrestha等[25]通过HCC患者公共数据库对不同免疫检查点是否可作为预测HCC预后的生物标志物进行综合评估,结果显示VISTA高表达的HCC患者其总生存期和无复发生存期显著降低,预后明显更差。然而,另有研究[26]揭示肿瘤微环境中VISTA高表达的HCC患者与VISTA低表达患者的预后未见显著性差异,但VISTA阳性的患者总生存期比阴性表达者显著延长(74个月 vs 41个月,P=0.037);VISTA+/CD8+双阳性患者的总生存期比其他免疫分型显著延长(74个月 vs 53个月,P=0.023)。VISTA评估HCC患者预后价值不同的原因尚需要更多的研究去阐明,深入研究VISTA在HCC中的作用对于抗肿瘤免疫治疗具有重要意义。
已有研究[27-28]发现VISTA和PD-1/CTLA4联合阻断可抑制荷瘤小鼠的肿瘤生长,目前进入临床试验的抗VISTA单克隆抗体及小分子抑制剂主要有JNJ-61610588、CI-8993、HMBD-002和CA-170(表1),其中JNJ-61610588的临床试验因细胞因子释放综合征相关副作用而终止研究;CA-170是一种双重靶向VISTA和PD-L1的口服制剂,针对CA-170在晚期实体瘤和淋巴瘤患者的Ⅰ/Ⅱ期临床试验(NCT02812875)正在進行中[29]。目前尚无抗VISTA抗体用于治疗HCC的临床试验研究。但基于前述VISTA对HCC发生发展的影响,未来VISTA很可能会成为HCC免疫治疗中极具潜力的治疗靶点。
3 BTLA在HCC中的研究进展
BTLA是重要的免疫协同信号分子之一,属于CD28超家族[30],基因定位于3号染色体q13.2区,由5个外显子组成,核酸片段全长870 bp。BTLA广泛表达于淋巴结、胸腺和脾脏,在心脏、肾脏、大脑和肝脏等脏器中鲜少表达[31]。在免疫细胞上,CD4+T淋巴细胞比CD8+T淋巴细胞检测出更高的BTLA表达[32],此外,BTLA还高表达于瘤周区的T淋巴细胞和巨噬细胞中[33]。BTLA蛋白在结构上与PD-1和CTLA-4相似[34],主要分为胞外结构域、胞质结构域和跨膜结构域3个部分[35]。胞质结构域包含生长因子受体结合蛋白-2结合基序、ITSM和ITIM。目前疱疹病毒侵入介体(herpes virus entry mediator, HVEM)是唯一可在人类细胞中检测到的BTLA配体,属于肿瘤坏死因子受体超家族。BTLA在肿瘤浸润淋巴细胞中高表达后激活胞质区的ITIM,使酪氨酸磷酸化,吸引含有Src同源结构域2的蛋白酪氨酸磷酸酶SHP-1和SHP-2向BTLA聚集,抑制T淋巴细胞受体激活,从而介导免疫抑制作用[33,36]。
BTLA上调可促进HCC的发展并与预后相关。Liu等[37]研究观察到HCC患者的肿瘤浸润性CD4+T淋巴细胞中BTLA的表达显著增加,IFNγ分泌减少。赵绮毅等[38]进一步研究发现正常情况下BTLA和HVEM可顺式结合成复合异二聚体从而抑制相邻细胞间的信号传递,维持幼稚T淋巴细胞的稳定及机体免疫的平衡;而HCC患者出现CD4+T BTLA高表达、CD8+T HVEM低表达的失衡状态,使得BTLA与HVEM之间形成反式构象后无法维持免疫稳态。阻断BTLA/HVEM信号通路后机体可通过循环CD4+T淋巴细胞促进IFNγ分泌,使免疫功能增强,提示BTLA/HVEM通路在HCC患者的外周血T淋巴细胞抑制中具有重要作用[33,37]。
Dong等[33]抽取53例晚期HCC患者索拉非尼治疗第1周、第2周和第4周的血浆样本,并使用多重荧光免疫测定法检测可溶性BTLA(sBTLA)的浓度。多变量分析显示,高sBTLA水平是总生存率差的独立预测因子(P=0.038)。另有研究[38]发现肝癌中超过85%的BTLA+CD4+T淋巴细胞同时表达PD-1分子,在抗PD-1单抗治疗中,这种新型BTLA+PD-1+耗竭T淋巴细胞亚群对PD-1单抗的反应最为敏感。目前进入临床试验的抗BTLA单抗药物只有上海君实公司生产的TAB004(JS004),6项临床试验多为针对晚期实体瘤、头颈部鳞癌、黑色素瘤和晚期肺癌的研究(表1),尚无抗BTLA单抗用于治疗HCC的临床试验研究。
4 B7-H4在HCC中的研究进展
属于B7家族第三类分子,也称为VTCN1[39]。其基因位于1号染色体,由5个内含子和6个外显子组成,B7-H4的开放阅读框全长849 bp。编码的蛋白具有Ⅰ型跨膜蛋白的整体结构,含282个氨基酸残基。B7-H4在小鼠和人类同源基因间的一致性较高(约87%),表明B7-H4在进化上高度保守。与其他B7家族严格的mRNA表达模式不同,B7-H4 mRNA广泛表达于人体大部分器官中,但在新分离的人类T淋巴细胞、B淋巴细胞、单核细胞和树突状细胞的表面则不表达,利用脂多糖、植物血凝素、IFNγ或离子霉素刺激分离细胞后,可诱导以上细胞表达B7-H4[39]。有研究[40]发现B7-H4可被IL-6、IL-10和肿瘤相关巨噬细胞诱导,并通过分泌IL-6和IL-10保护肿瘤细胞免受T淋巴细胞的攻击。在癌细胞缺氧后,缺氧诱导因子1α与B7-H4启动子内近端缺氧反应元件位点结合,促进肿瘤细胞生长[41]。现有研究尚未确定B7-H4的配体[42]。
近年B7-H4在肝癌预后评估中的价值也是不可忽视的。有研究[43]发现在HCC组织样本中,B7-H4在HCC组织中的表达明显高于癌旁组织,且HCC中B7-H4表达越高,患者越容易复发。HCC患者的外周血血清中同样发现B7-H4水平显著高于健康对照组,且与HCC患者血清AFP水平和TNM分期呈正相关,随访发现高血清B7-H4组HCC患者预后结局差,5年总体生存率较低(P=0.028)[44]。体外和体内实验均证明B7-H4下调抑制了肝癌细胞的增殖和迁移[45],并可通过PI3K信号通路促进肝癌细胞凋亡和自噬。
B7-H4单克隆抗体及抗体-药物偶联物(antibody drug conjugate, ADC)均具有良好的抗肿瘤效果。目前有关B7-H4抗体抗肿瘤的临床试验为5项(表1),其中SGN-B7H4V和FPA150为单抗,PF-07260437与GEN1047为靶向CD3和B7-H4的双特异性抗体;HS-20089为国内首个针对B7-H4的ADC,利用单克隆抗体的靶向识别作用和人体细胞的内吞作用将药物送入肿瘤细胞内,达到更高效的杀死体内肿瘤的目的[46]。虽然目前尚未查询到关于抗B7-H4抗体治疗HCC的临床试验,但以上研究均表明B7-H4在HCC中高表达并促进了癌症的发展,而下调其表达后疾病得到了有效控制,因此B7-H4是值得深入研究的靶点。
5 小结与展望
综上所述,TIGIT、VISTA、BTLA及B7-H4在HCC中高表达并与患者预后密切相关,是HCC免疫治疗中重要的靶点。而这些新兴免疫检查点抑制剂应用于治疗HCC的临床试验较少的原因可能与一些问题尚未解决有关,如未识别B7-H4的配体,基因多态性是如何影响VISTA和配体VSIG-3的相互作用等,这些问题可能是充分了解其治疗潜力的关键。此外,单药治疗结果虽令人欣喜,但仍需要寻找合理的免疫治疗组合增强HCC的抗肿瘤效应。可以预见,免疫检查点抑制剂联合治疗是扩大病理反应率和避免耐药性的潜在策略。未来有理由期待新辅助免疫检查点抑制剂在臨床试验证据的指引下走向新的高度。目前对这些潜力分子的了解尚处于早期阶段,如何使更多的候选药物转化为临床用药,如何优化用药配比以及减少免疫不良反应的发生,为HCC患者带来新的希望,是临床研究者日后砥砺奋斗的共同目标。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:陶莹负责选题,拟定写作思路,论文初稿撰写及修改;廖长秀负责选题,拟定写作思路,论文审阅及修订。
参考文献:
[1]SUNG H, FERLAY J, SIEGEL RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI: 10.3322/caac.21660.
[2]CAO W, CHEN HD, YU YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J (Engl), 2021, 134(7): 783-791. DOI: 10.1097/CM9.0000000000001474.
[3]General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer (2022 edition)[J]. J Clin Hepatol, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.
国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.
[4]FLECKEN T, SCHMIDT N, HILD S, et al. Immunodominance and functional alterations of tumor-associated antigen-specific CD8+ T-cell responses in hepatocellular carcinoma[J]. Hepatology, 2014, 59(4): 1415-1426. DOI: 10.1002/hep.26731.
[5]CHANG YY, YAN B, LI R. Research progress in the mechanism of T cell exhaustion and its application in the immunotherapy for cancer[J]. Current Immunol, 2022, 42(2): 170-174.
常媛媛, 顏波, 李榕. T细胞耗竭发生机制及其在免疫治疗中的研究进展[J]. 现代免疫学, 2022, 42(2): 170-174.
[6]HUANG C, ZHU HX, YAO Y, et al. Immune checkpoint molecules. Possible future therapeutic implications in autoimmune diseases[J]. J Autoimmun, 2019, 104: 102333. DOI: 10.1016/j.jaut.2019.102333.
[7]SCHEINER B, KIRSTEIN MM, HUCKE F, et al. Programmed cell death protein-1 (PD-1)-targeted immunotherapy in advanced hepatocellular carcinoma: efficacy and safety data from an international multicentre real-world cohort[J]. Aliment Pharmacol Ther, 2019, 49(10): 1323-1333. DOI: 10.1111/apt.15245.
[8]SANGRO B, GOMEZ-MARTIN C, DE LA MATA M, et al. A clinical trial of CTLA-4 blockade with tremelimumab in patients with hepatocellular carcinoma and chronic hepatitis C[J]. J Hepatol, 2013, 59(1): 81-88. DOI: 10.1016/j.jhep.2013.02.022.
[9]ZHAO RP, LUO HF, CHEN LJ, et al. Observation and nursing of common adverse reactions of PD-1 inhibitor in the treatment of liver cancer[J]. Chin Gen Pract Nurs, 2022, 20(7): 975-977. DOI: 10.12104/j.issn.1674-4748.2022.07.030.
赵汝平, 骆惠芬, 陈柳坚, 等. PD-1抑制剂治疗肝癌常见不良反应的观察与护理[J]. 全科护理, 2022, 20(7): 975-977. DOI: 10.12104/j.issn.1674-4748.2022.07.030.
[10]ZHANG C, WANG Y, XUN X, et al. TIGIT can exert immunosuppressive effects on CD8+ T cells by the CD155/TIGIT signaling pathway for hepatocellular carcinoma in vitro[J]. J Immunother, 2020, 43(8): 236-243. DOI: 10.1097/CJI.0000000000000330.
[11]YU X, HARDEN K, GONZALEZ LC, et al. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells[J]. Nat Immunol, 2009, 10(1): 48-57. DOI: 10.1038/ni.1674.
[12]STANIETSKY N, SIMIC H, ARAPOVIC J, et al. The interaction of TIGIT with PVR and PVRL2 inhibits human NK cell cytotoxicity[J]. Proc Natl Acad Sci U S A, 2009, 106(42): 17858-17863. DOI: 10.1073/pnas.0903474106.
[13]OSTROUMOV D, DUONG S, WINGERATH J, et al. Transcriptome profiling identifies TIGIT as a marker of T-cell exhaustion in liver cancer[J]. Hepatology, 2021, 73(4): 1399-1418. DOI: 10.1002/hep.31466.
[14]LIU JX. Study on the mechanism of negative co-stimulatory molecule TIGIT regulating the biological functions liver cancer cells and immune cells[D]. Yinchuan: Ningxia Medical University, 2020.
刘娟喜. TIGIT负性共刺激分子调控肝癌细胞、免疫细胞生物学功能的机制研究[D]. 银川: 宁夏医科大学, 2020.
[15]LU Y, SUN R, TIAN ZG, et al. Study on role of TIGIT in HBV immunotherapy[J]. Chin J Immunol, 2022, 38(2): 129-134. DOI: 10.3969/j.issn.1000-484X.2022.02.001.
卢杨, 孙汭, 田志刚, 等. TIGIT分子在HBV免疫治疗中的作用探究[J]. 中国免疫学杂志, 2022, 38(2): 129-134. DOI: 10.3969/j.issn.1000-484X.2022.02.001.
[16]GE Z, ZHOU G, CAMPOS CARRASCOSA L, et al. TIGIT and PD1 co-blockade restores ex vivo functions of human tumor-infiltrating CD8+ T cells in hepatocellular carcinoma[J]. Cell Mol Gastroenterol Hepatol, 2021, 12(2): 443-464. DOI: 10.1016/j.jcmgh.2021.03.003.
[17]Tiragolumab impresses in multiple trials[J]. Cancer Discov, 2020, 10(8): 1086-1087. DOI: 10.1158/2159-8290.CD-NB2020-063.
[18]WANG L, RUBINSTEIN R, LINES JL, et al. VISTA, a novel mouse Ig superfamily ligand that negatively regulates T cell responses[J]. J Exp Med, 2011, 208(3): 577-592. DOI: 10.1084/jem.20100619.
[19]SLATER BT, HAN X, CHEN L, et al. Structural insight into T cell coinhibition by PD-1H (VISTA)[J]. Proc Natl Acad Sci U S A, 2020, 117(3): 1648-1657. DOI: 10.1073/pnas.1908711117.
[20]FLIES DB, WANG S, XU H, et al. Cutting edge: A monoclonal antibody specific for the programmed death-1 homolog prevents graft-versus-host disease in mouse models[J]. J Immunol, 2011, 187(4): 1537-1541. DOI: 10.4049/jimmunol.1100660.
[21]XIE X, CHEN C, CHEN W, et al. Structural basis of VSIG3: The ligand for VISTA[J]. Front Immunol, 2021, 12: 625808. DOI: 10.3389/fimmu.2021.625808.
[22]ELTANBOULY MA, ZHAO Y, NOWAK E, et al. VISTA is a checkpoint regulator for nave T cell quiescence and peripheral tolerance[J]. Science, 2020, 367(6475): eaay0524. DOI: 10.1126/science.aay0524.
[23]WANG G, TAI R, WU Y, et al. The expression and immunoregulation of immune checkpoint molecule VISTA in autoimmune diseases and cancers[J]. Cytokine Growth Factor Rev, 2020, 52: 1-14. DOI: 10.1016/j.cytogfr.2020.02.002.
[24]XIANG J. Expression and clinical significance of negative immune checkpoint regulator VISTA in hepatocellular carcinoma[D]. Fuzhou: Fujian Medical University, 2018.
向娟. 負性共刺激分子VISTA在肝细胞肝癌中的表达及其临床价值的研究[D]. 福州: 福建医科大学, 2018.
[25]SHRESTHA R, PRITHVIRAJ P, ANAKA M, et al. Monitoring immune checkpoint regulators as predictive biomarkers in hepatocellular carcinoma[J]. Front Oncol, 2018, 8: 269. DOI: 10.3389/fonc.2018.00269.
[26]ZHANG M. Expression of immune checkpoint protein VISTA in hepatocellular carcinoma and its effect on tumor microenvironment and prognosis of patients with liver cancer[D]. Guangzhou: Southern Medical University, 2018.
張明. 免疫检查点蛋白VISTA在肝细胞癌中的表达及对肿瘤微环境和肝癌患者预后的影响[D]. 广州: 南方医科大学, 2018.
[27]LIU J, YUAN Y, CHEN W, et al. Immune-checkpoint proteins VISTA and PD-1 nonredundantly regulate murine T-cell responses[J]. Proc Natl Acad Sci U S A, 2015, 112(21): 6682-6687. DOI: 10.1073/pnas.1420370112.
[28]KONDO Y, OHNO T, NISHII N, et al. Differential contribution of three immune checkpoint (VISTA, CTLA-4, PD-1) pathways to antitumor responses against squamous cell carcinoma[J]. Oral Oncol, 2016, 57: 54-60. DOI: 10.1016/j.oraloncology.2016.04.005.
[29]DEMPKE W, FENCHEL K, UCIECHOWSKI P, et al. Second- and third-generation drugs for immuno-oncology treatment-The more the better?[J]. Eur J Cancer, 2017, 74: 55-72. DOI: 10.1016/j.ejca.2017.01.001.
[30]CEERAZ S, NOWAK EC, NOELLE RJ. B7 family checkpoint regulators in immune regulation and disease[J]. Trends Immunol, 2013, 34(11): 556-563. DOI: 10.1016/j.it.2013.07.003.
[31]CHEUNG TC, OBORNE LM, STEINBERG MW, et al. T cell intrinsic heterodimeric complexes between HVEM and BTLA determine receptivity to the surrounding microenvironment[J]. J Immunol, 2009, 183(11): 7286-7296. DOI: 10.4049/jimmunol.0902490.
[32]DEL RIO ML, KAYE J, RODRIGUEZ-BARBOSA JI. Detection of protein on BTLAlow cells and in vivo antibody-mediated down-modulation of BTLA on lymphoid and myeloid cells of C57BL/6 and BALB/c BTLA allelic variants[J]. Immunobiology, 2010, 215(7): 570-578. DOI: 10.1016/j.imbio.2009.09.008.
[33]DONG MP, ENOMOTO M, THUY L, et al. Clinical significance of circulating soluble immune checkpoint proteins in sorafenib-treated patients with advanced hepatocellular carcinoma[J]. Sci Rep, 2020, 10(1): 3392. DOI: 10.1038/s41598-020-60440-5.
[34]PAULOS CM, JUNE CH. Putting the brakes on BTLA in T cell-mediated cancer immunotherapy[J]. J Clin Invest, 2010, 120(1): 76-80. DOI: 10.1172/JCI41811.
[35]GONZALEZ LC, LOYET KM, CALEMINE-FENAUX J, et al. A coreceptor interaction between the CD28 and TNF receptor family members B and T lymphocyte attenuator and herpesvirus entry mediator[J]. Proc Natl Acad Sci U S A, 2005, 102(4): 1116-1121. DOI: 10.1073/pnas.0409071102.
[36]GAVRIELI M, WATANABE N, LOFTIN SK, et al. Characterization of phosphotyrosine binding motifs in the cytoplasmic domain of B and T lymphocyte attenuator required for association with protein tyrosine phosphatases SHP-1 and SHP-2[J]. Biochem Biophys Res Commun, 2003, 312(4): 1236-1243. DOI: 10.1016/j.bbrc.2003.11.070.
[37]LIU J, LI J, HE M, et al. Distinct changes of BTLA and HVEM expressions in circulating CD4+ and CD8+ T cells in hepatocellular carcinoma patients[J]. J Immunol Res, 2018, 2018: 4561571. DOI: 10.1155/2018/4561571.
[38]ZHAO QY, HUANG ZL, WU ZB, et al. New BTLA+ PD-1+ depleted T cells predict the treatment of liver cancer with PD-1 monoclonal antibody[Z]. The Third Affiliated Hospital of Sun Yat-sen University, 2020.
趙绮毅, 黄湛镰, 邬喆斌, 等. 新型BTLA+PD-1+耗竭T细胞预测PD-1单抗治疗肝癌[Z]. 中山大学附属第三医院, 2020.
[39]SICA GL, CHOI IH, ZHU G, et al. B7-H4, a molecule of the B7 family, negatively regulates T cell immunity[J]. Immunity, 2003, 18(6): 849-861. DOI: 10.1016/s1074-7613(03)00152-3.
[40]CHE F, HENG X, ZHANG H, et al. Novel B7-H4-mediated crosstalk between human non-Hodgkin lymphoma cells and tumor-associated macrophages leads to immune evasion via secretion of IL-6 and IL-10[J]. Cancer Immunol Immunother, 2017, 66(6): 717-729. DOI: 10.1007/s00262-017-1961-7.
[41]JEON YK, PARK SG, CHOI IW, et al. Cancer cell-associated cytoplasmic B7-H4 is induced by hypoxia through hypoxia-inducible factor-1α and promotes cancer cell proliferation[J]. Biochem Biophys Res Commun, 2015, 459(2): 277-283. DOI: 10.1016/j.bbrc.2015.02.098.
[42]JOHN P, WEI Y, LIU W, et al. The B7x immune checkpoint pathway: from discovery to clinical trial[J]. Trends Pharmacol Sci, 2019, 40(11): 883-896. DOI: 10.1016/j.tips.2019.09.008.
[43]HAO TT. Study on the effect and mechanism of B7-H4 on apoptosis and autophagy of liver cancer cells[D]. Chongqing: Chongqing Medical University, 2020.
郝团团. B7-H4对肝癌细胞凋亡和自噬的影响及机制研究[D]. 重庆: 重庆医科大学, 2020.
[44]CHEN FS, ZHANG SA, WU ZX, et al. Diagnostic and prognostic prediction value of serum B7-H4 level for hepatocellular carcinoma[J]. Prog Mod Biomed, 2018, 18(10): 1960-1964. DOI: 10.13241/j.cnki.pmb.2018.10.032.
陈丰穗, 张世安, 吴志贤, 等. 血清B7-H4水平对肝细胞癌的诊断及预后价值[J]. 现代生物医学进展, 2018, 18(10): 1960-1964. DOI: 10.13241/j.cnki.pmb.2018.10.032.
[45]HE T, HU H, XIE N, et al. The expression of B7-H4 in liver cancer and its effect on cell invasion and migration[J]. Anhui Med Pharm J, 2019, 23(9): 1774-1778, back insert 3. DOI: 10.3969/j.issn.1009-6469.2019.09.019.
何涛, 胡洪, 谢楠, 等. B7-H4在肝癌组织中的表达及其对肝癌细胞侵袭、迁移的影响[J]. 安徽医药, 2019, 23(9): 1774-1778, 后插3. DOI: 10.3969/j.issn.1009-6469.2019.09.019.
[46]TARANTINO P, CARMAGNANI PESTANA R, CORTI C, et al. Antibody-drug conjugates: Smart chemotherapy delivery across tumor histologies[J]. CA Cancer J Clin, 2022, 72(2): 165-182. DOI: 10.3322/caac.21705.
收稿日期:
2022-08-03;录用日期:2022-09-07
本文编辑:葛俊
