血液中胎儿血红蛋白水平与早产儿视网膜病发病的关系
2023-04-29卫红利张璐璐孙梦雅徐彤赖春池姜红
卫红利 张璐璐 孙梦雅 徐彤 赖春池 姜红

[摘要] 目的 探討出生时胎龄<32周早产儿生后早期动脉血胎儿血红蛋白(HbF)水平与早产儿视网膜病(retinopathy of prematurity,ROP)发病的关系。方法 选择2019年3月—2022年2月我院新生儿科收治的出生时胎龄<32周的早产儿99例,根据是否诊断为ROP,分为ROP组(34例)和非ROP组(65例)。比较两组患儿的临床资料,采用Logistic回归法分析患儿生后2周动脉血HbF水平与ROP的相关性。结果 ROP组患儿出生时胎龄以及出生体质量均显著低于非ROP组(t=3.371、3.218,P<0.05),出生时胎龄<28周患儿构成比、出生体质量<1 000 g患儿构成比、顺产患儿构成比、生后2周内输血患儿构成比,以及用氧时间与住院时间均显著高于或长于非ROP组(χ2=4.390~11.579,Z=3.283、5.207,P<0.05)。ROP组患儿生后2周动脉血血红蛋白(Hb)水平及HbF比例均显著低于非ROP组(t=-2.791、-3.599,P<0.05)。Logistic回归法分析显示,动脉血HbF比例降低是ROP发生的危险因素(OR=0.915,95%CI=0.849~0.987,P<0.05)。结论 出生时胎龄<32周早产儿生后2周动脉血HbF比例降低是ROP发生的危险因素,维持较高的动脉血HbF水平可能对临床ROP的发生具有预防作用。
[关键词] 胎儿血红蛋白;早产儿视网膜病;婴儿,早产
[中图分类号] R774.1;R722.6 [文献标志码] A
[ABSTRACT] Objective To investigate the association between fetal hemoglobin (HbF) level in arterial blood early after birth and the onset of retinopathy of prematurity (ROP) in preterm infants with a gestational age of <32 weeks. Methods A total of 99 preterm infants with a gestational age of <32 weeks who were admitted to Department of Neonatology in our hospital from March 2019 to February 2022 were enrolled, and according to whether they were diagnosed with ROP, they were divided into ROP group with 34 infants and non-ROP group with 65 infants. Clinical data were compared between the two groups, and the logistic regression method was used to investigate the association between HbF level in arterial blood and ROP at 2 weeks after birth. Results Compared with the non-ROP group, the ROP group had significantly lower gestational age and birth weight (t=3.371,3.218,P<0.05), significantly higher constituent ratios of infants with a gestational age of <28 weeks, infants with a birth weight of <1 000 g, infants born by vaginal delivery, and infants receiving blood transfusion within 2 weeks after birth, and significantly longer oxygen supply time and length of hospital stay (χ2=4.390-11.579,Z=3.283,5.207,P<0.05). Compared with the non-ROP group, the ROP group had significantly lower hemoglobin level and HbF ratio in arterial blood at 2 weeks after birth (t=-2.791,-3.599,P<0.05). The logistic regression analysis showed that the reduction in HbF ratio in arterial blood was a risk factor for ROP (OR=0.915,95%CI=0.849-0.987,P<0.05). Conclusion The reduction in HbF ratio in arterial blood at 2 weeks after birth is a risk factor for ROP in preterm infants with a gestational age of <32 weeks, and maintaining a high HbF level in arterial blood may have a preventive effect on ROP.
[KEY WORDS] Fetal hemoglobin; Retinopathy of prematurity; Infant, premature
随着围生医学以及新生儿医学技术的发展,极早早产儿的存活率逐年增加,早产儿视网膜病(retinopathy of prematurity,ROP)的发病率也逐年增高[1]。既往研究表明,早产儿生后多次输血是ROP发生的危险因素之一[2]。输注的血液中含有大量成人血红蛋白(HbA),而新生儿红细胞中胎儿血红蛋白(HbF)占主要成分[3],其对氧的亲和力更高[4]。血液中HbF水平降低可使氧解离曲线右移,血浆中溶解的氧比例增高,使未成熟组织暴露于氧的程度增加[5]。高浓度氧可使视网膜血管收缩,视网膜缺氧诱导血管生长因子生成,导致新生血管形成,引起ROP[6]。本研究回顾性分析99例出生时胎龄<32周的早产儿生后2周动脉血HbF比例等相关指标,探讨其与ROP发生的相关性,旨在为早产儿输血及ROP的防治提供新思路。现将结果报告如下。
1 资料与方法
1.1 一般资料
选择2019年3月—2022年2月我院新生儿科收治的出生时胎龄<32周的新生儿99例,根据是否诊断为ROP[7]分为ROP组和非ROP组。纳入标准:①出生时胎龄<32周者;②生后24 h内入院者;③生后1 d检测动脉血气分析,且生后2周内动脉血气分析结果≥2次者;④住院期间完成了ROP筛查者。排除标准:①各器官系统先天性发育畸形者(先天性心脏病、唇腭裂等面部畸形、消化道畸形等);②先天性遗传代谢病者;③住院期间放弃治疗者;④临床资料不完整者。
1.2 研究方法
收集并比较两组患儿的临床资料,包括出生时胎龄、出生体质量、性别、分娩方式、是否多胎、生后2周内是否输血、生后2周内是否有创通气、用氧时间、住院时间,以及生后2周内每次动脉血气分析结果[动脉血血红蛋白(Hb)水平、HbF比例]。所有患儿住院期间持续经皮氧饱和度监测,报警高限设置为95%,低限设置为90%,根据需要补充氧气。
1.3 统计学方法
使用SPSS 26.0统计学软件进行分析。符合正态分布的计量资料以±s表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用秩和检验;计数资料以例(率)表示,统计处理采用χ2检验。采用Logistic回归法进行危险因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患儿一般资料比较
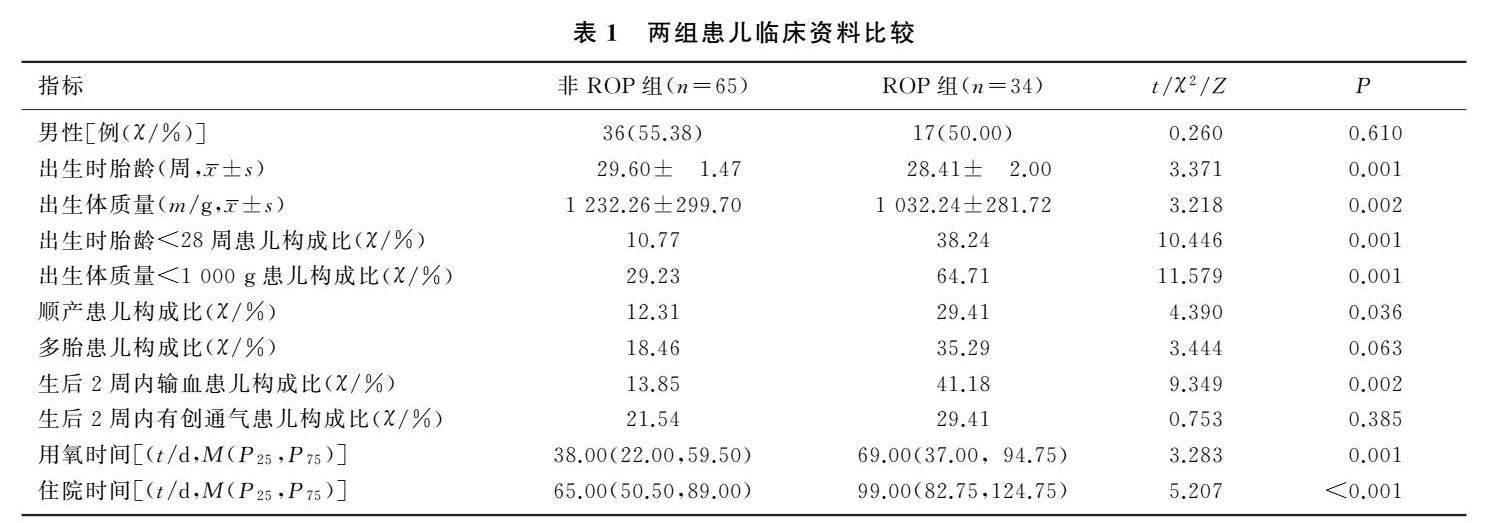
本研究共收集99例新生儿的临床资料,其中ROP组34例,非ROP组65例。ROP组患儿出生时胎龄及出生体质量均显著低于非ROP组(t=3.371、3.218,P<0.05),出生时胎龄<28周患儿构成比、出生体质量<1 000 g患儿构成比、顺产患儿构成比、生后2周内输血患儿构成比、用氧时间及住院时间均显著高于或长于非ROP组(χ2=4.390~11.579,Z=3.283、5.207,P<0.05)。两组性别、多胎患儿构成比及生后2周内有创机械通气患儿构成比比较差异无显著性(P>0.05)。见表1。
2.2 两组患儿生后2周内动脉血血气分析结果比较及Logistic回归分析结果
ROP组患儿生后2周动脉血Hb水平及HbF比例均显著低于非ROP组(t=-2.791、-3.599,P<0.05)。见表2。Logistic回归分析结果显示动脉血HbF比例降低是ROP发生的危险因素(OR=0.915,95%CI=0.849~0.987,P<0.05)。见表3。
3 讨 论
ROP是各种因素参与下的微血管变性、新生血管增生从而诱发视网膜剥脱的疾病[8]。随着早产儿存活率的明显提高,ROP的发病率随之升高,许多早产儿因ROP导致严重视力障碍甚至失明,目前ROP已成为世界范围内儿童致盲的首位原因[9]。研究顯示ROP发生的根本原因是视网膜血管本身不成熟[10],出生时胎龄和出生体质量已是目前公认的ROP高危因素[11]。出生时胎龄越小,出生体质量越低,视网膜发育越不成熟,ROP发生率越高,病情越严重。一项对877例超低出生体质量儿的研究显示,发生ROP患儿出生时胎龄和出生体质量明显低于未发生ROP新生儿,且发生重度ROP的患儿出生时胎龄和出生体质量低于轻度ROP患儿[12]。
本研究对99例出生时胎龄<32周的早产儿进行分析,ROP组患儿出生时胎龄和出生体质量均低于非ROP组,与上述研究结果一致。
许多早产儿出生后早期因病情危重需输血治疗以挽救生命。既往研究表明,输血是ROP发生的危险因素之一[13]。有研究者对44例出生体质量<1 250 g的早产儿进行前瞻性对照研究发现,患有ROP的早产儿出生后第1周内和出生后第2个月内的输血量均显著高于未患ROP的早产儿[14]。本研究中,ROP组患儿中生后2周内输血患儿构成比明显高于非ROP组。早产儿输注的红细胞通常从成人献血者血液中获得,含有近100%的HbA。而新生儿血液中HbF占Hb的比例可达70%以上。研究发现,若血液中氧分压为90 mmHg且HbF及HbA的氧饱和度均达到100%,视网膜血管中两种血红蛋白释放氧气至分压平衡(即30mmHg)时,HbA与HbF分别释放80%和35%的氧[15]。HbF被HbA替代后产生更多的氧,可被相关的视网膜受体感知为高氧状态,由此引起的血管收缩甚至闭塞则导致视网膜相对缺氧,在活性因子作用下视网膜大量新生血管形成,从而导致ROP。有研究表明,HbF还可发挥氧化还原作用,抵抗活性氧以及清除过氧化氢[16]。HbF产生一氧化氮的能力显著强于HbA,在调节血管张力和血流速度方面起重要作用[17]。此外,HbF还能更加有效地维持自身血红蛋白的四聚体完整性,阻止有毒游离血红素的释放[18]。本研究中,ROP组患儿生后2周动脉血平均Hb水平及平均HbF比例明显低于非ROP组,对ROP组的患儿进行Logistic回归分析,结果显示动脉血HbF比例降低是ROP发生的危险因素。HELLSTRM等[19]对452例出生时胎龄<30周的早产儿进行分析,结果显示ROP发病率与生后第1周的HbF比例呈负相关,当HbF比例为90%时,ROP发病率为10%,而HbF比例为40%时发病率则接近60%,这与本研究结果一致。
早產儿行ROP筛查时,一旦发现3期及以上病变,应及时开始治疗。目前ROP的治疗主要是对症治疗,包括激光治疗、玻璃体内注射抗血管内皮生长因子药物、巩膜环扎术及玻璃体切除术[20-21],而输注脐带血或为减轻早产儿视网膜病变严重程度的新方法。有研究指出,输注脐带血中提取的浓缩红细胞可减少输血导致的新生儿HbF耗竭[22]。该研究监测了25例出生时胎龄≤30周或出生体质量≤1 000 g早产儿的生后HbF比例,结果显示接受脐带血红细胞输注者在矫正胎龄32周时可检测到HbF的比例较高,且在矫正胎龄36周时HbF比例差异更为明显。但输注脐带血以减轻视网膜病变的治疗方法目前缺乏临床可行性及安全性的研究。
综上所述,出生时胎龄<32周的早产儿生后2周动脉血HbF比例降低是ROP发生的危险因素,维持较高的HbF比例可能对ROP的发生具有预防作用。本研究还存在许多局限性,如回顾性病例对照研究纳入的早产儿群体具有异质性,且样本量不足。另外,后期还需进一步探讨提升HbF水平及输注脐带血红细胞改善ROP的具体机制。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属医院医学伦理委员会的审核批准(文件号QYFYWZLL27275)。所有试验过程均遵照《人体医学研究的伦理准则》 的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:卫红利、张璐璐、孙梦雅参与了研究设计;卫红利、徐彤、赖春池、姜红参与了论文的写作和修改。所有作者均阅读并同意发表该论文。所有作者均声明不存在利益冲突。
[参考文献]
[1] FREITAS A M, MRSCHBCHER R, THORELL M R, et al. Incidence and risk factors for retinopathy of prematurity: A retrospective cohort study[J]. Int J Retina Vitreous, 2018,4:20.
[2] WANG Y C, CHAN O W, CHIANG M C, et al. Red blood cell transfusion and clinical outcomes in extremely low birth weight preterm infants[J]. Pediatr Neonatol, 2017,58(3):216-222.
[3] KHANDROS E, BLOBEL G A. Heterogeneity of fetal hemoglobin production in adult red blood cells[J]. Curr Opin Hematol, 2021, 28(3):164-170.
[4] MANNING J M, MANNING L R, DUMOULIN A, et al. Embryonic and fetal human hemoglobins: Structures, oxygen binding, and physiological roles[J]. Subcell Biochem, 2020, 94:275-296.
[5] PRITIANAC E, URLESBERGER B, SCHWABERGER B, et al. Fetal hemoglobin and tissue oxygenation measured with near-infrared spectroscopy-a systematic qualitative review[J]. Front Pediatr, 2021, 9:710465.
[6] PODRAZA W, PODRAZA H, JEZIERSKA K, et al. The role of hemoglobin variant replacement in retinopathy of prematurity[J]. Indian J Pediatr,2011, 78(12):1498-1502.
[7] THE COMMITTEE FOR THE CLASSIFICATION OF RETINOPATHY OF PREMATURITY. An international classification of retinopathy of prematurity[J]. Arch Ophthalmol, 1984,102(8):1130-1134.
[8] FAGERHOLM R, VESTI E. Retinopathy of prematurity-from recognition of risk factors to treatment recommendations[J]. Duodecim, 2017,133(4):337-344.
[9] KOGOLEVA L V, KATARGINA L A, SUDOVSKAYA T V, et al. Results of long-term observation of extremely premature babies with retinopathy[J]. Vestn Oftalmol, 2020,136(5):39-45.
[10] 石文静. 早产儿视网膜病发病机制的研究进展[J]. 国外医学(儿科学分册), 2001,28(6):322-324.
[11] ALAJBEGOVIC-HALIMIC J, ZVIZDIC D, ALIMANOVIC-HALILOVIC E, et al. Risk factors for retinopathy of prematurity in premature born children[J]. Med Arch, 2015,69(6):409-413.
[12] SOOD B G, MADAN A, SAHA S, et al. Perinatal systemic inflammatory response syndrome and retinopathy of prematurity[J]. Pediatr Res, 2010,67(4):394-400.
[13] MOSCUZZA F,BELCARI F,NARDINI V,et al. Correlation between placental histopathology and fetal/neonatal outcome: Chorioamnionitis and funisitis are associated to intraventricular haemorrage and retinopathy of prematurity in preterm newborns[J]. Gynecol Endocrinol,2011,27(5):319-323.
[14] DANI C,REALI M F,BERTINI G,et al. The role of blood transfusions and iron intake on retinopathy of prematurity[J]. Early Hum Dev,2001,62(1):57-63.
[15] PODRAZA W. A new approach to neonatal medical management that could transform the prevention of retinopathy of prematurity: Theoretical considerations[J]. Med Hypotheses, 2020,137:109541.
[16] KETTISEN K, STRADER M B, WOOD F, et al. Site-direc-ted mutagenesis of cysteine residues alters oxidative stability of fetal hemoglobin[J]. Redox Biol, 2018,19:218-225.
[17] SIMONS M, GRETTON S, SILKSTONE G G A, et al. Comparison of the oxidative reactivity of recombinant fetal and adult human hemoglobin: Implications for the design of hemoglobin-based oxygen carriers[J]. Biosci Rep, 2018,38(4):BSR20180370.
[18] REEDER B J. The redox activity of hemoglobins: From phy-siologic functions to pathologic mechanisms[J]. Antioxid Re-dox Signal, 2010,13(7):1087-1123.
[19] HELLSTRM W, MARTINSSON T, MORSING E, et al. Low fraction of fetal haemoglobin is associated with retinopathy of prematurity in the very preterm infant[J]. Br J Ophthalmol, 2022,106(7):970-974.
[20] ALDO B M, SCHADE R. Retinopathy of the premature: Update in screening and treatment[J]. Rev Chil Pediatr, 2020, 91(1):122-130.
[21] CHAN J J T, LAM C P S, KWOK M K M, et al. Risk of recurrence of retinopathy of prematurity after initial intravitreal ranibizumab therapy[J]. Sci Rep, 2016,6:27082.
[22] TEOFILI L, PAPACCI P, ORLANDO N, et al. Allogeneic cord blood transfusions prevent fetal haemoglobin depletion in preterm neonates. Results of the CB-TrIP study[J]. Br J Haematol, 2020,191(2):263-268.
(本文編辑 范睿心 耿波 厉建强)
