外源褪黑素对镉胁迫下棉花种子萌发、抗氧化酶活性及渗透调节物质含量的影响
2023-04-29马鑫颖宋晨孟妍君刘连涛张科张永江孙红春白志英李存东
马鑫颖 宋晨 孟妍君 刘连涛 张科 张永江 孙红春 白志英 李存东
摘要:【目的】鎘(cadmium, Cd)是严重的环境污染物之一,Cd胁迫影响种子萌发。褪黑素(melatonin, MT)作为1种抗氧化剂,能够促进种子萌发。本研究通过分析外源MT对Cd胁迫下棉花种子萌发性状、抗氧化酶活性以及渗透调节物质含量的影响,明确MT对Cd胁迫下棉花种子萌发的调控效应。【方法】试验以转基因抗虫棉农大棉601种子为材料,筛选出Cd胁迫浓度(100 μmol·L-1)以及MT浓度(50 μmol·L-1),设置4个处理CK(纯水对照)、MT(褪黑素)、Cd(镉胁迫)、CM(镉胁迫+褪黑素),研究了不同处理下棉花种子的发芽势、发芽率、幼苗生物量以及抗氧化酶活性、渗透调节物质含量。【结果】100 μmol·L-1 Cd胁迫下棉花种子的发芽势、发芽率、胚根和胚芽长度以及胚根生物量显著降低,但对胚芽生物量没有显著影响;Cd胁迫下棉花种子中超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)活性降低,可溶性蛋白含量降低,脯氨酸、可溶性糖含量、丙二醛含量升高。施用50 μmol·L-1 MT提高了Cd胁迫下棉花种子的发芽势和发芽率,提高了种子中SOD、POD、CAT活性,提高了可溶性蛋白、可溶性糖、脯氨酸含量,降低了丙二醛含量,显著提高了胚根和胚芽长度以及胚根的生物量。【结论】施加50 μmol·L-1 MT能够有效缓解100 μmol·L-1 Cd胁迫对棉花种子萌发的抑制作用。
关键词:棉花;褪黑素;镉;萌发;抗氧化酶;渗透调节物质
Effects of exogenous melatonin on germination, antioxidant enzymes activity, and osmotic adjustment substance content of cotton seed under cadmium stress
Ma Xinying1, 2, Song Chen1, 2, Meng Yanjun1, 2, Liu Liantao2, Zhang Ke2, Zhang Yongjiang2, Sun Hongchun2, Bai Zhiying1, 2*, Li Cundong2*
(1. College of Life Science, Hebei Agricultural University, Baoding, Hebei 071000, China; 2. College of Agronomy, Hebei Agricultural University/State Key Laboratory of North China Crop Improvement and Regulation/Key Laboratory of Crop Growth Regulation of Hebei Province, Baoding, Hebei 071000, China)
Abstract: [Objective] Cadmium (Cd) is one of the serious environmental pollutants, and Cd stress affects seed germination. Melatonin (MT), as an antioxidant, and can promotes seed germination. In this study, the effects of MT on cotton seed germination, antioxidant activity, and osmotic adjustment content under Cd stress were analyzed to clarify the regulatory effect of MT on cotton seed germination under Cd stress. [Method] Seeds of the transgenic insect-resistant cotton variety Nongdamian 601 were used as material, Cd concentration and MT concentration were screened. And four treatments, CK (control, water), MT (melatonin treatment, 50 μmol·L-1), Cd (cadmium stress 100 μmol·L-1 treatment), CM (cadmium + melatonin treatment) were set. The germination potential, germination rate, seedling biomass, antioxidant enzyme activity, and osmotic adjustment content of cotton seed under different treatments were studied. [Result] Cd stress of 100 μmol·L-1 significantly decreased the germination potential, the germination rate, the length of radicle and plumule, the fresh and dry mass of radicle, but had no significant effect on the fresh or dry mass of plumule. Under the stress of Cd, the activity of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), and soluble protein content of cotton seed were decreased. The content of proline, soluble sugar and malondialdehyde (MDA) were increased. Application of MT (50 μmol·L-1) increased the germination potential and germination rate of cotton seed under Cd stress, the activity of SOD, POD and CAT, the content of soluble protein, soluble sugar and proline, while decreased the content of MDA, significantly increased the length of radicle and plumule, and significantly increased radicle biomass. [Conclusion] Exogenous MT (50 μmol·L-1) could effectively alleviate the inhibitory effeet of Cd stress (100 μmol·L-1) on cotton seed germination.
Keywords: cotton (Gossypium hirsutum L.); melatonin; cadmium; germination; antioxidant enzyme; osmotic adjustment
镉(cadmium, Cd)是严重的环境污染物之一,也是植物生长过程中的非必需重金属元素,具有稳定性强、易于积累、不易消除等特点,易被植物吸收转运。近年来,由于冶炼采矿以及废水灌溉、化肥农药的不合理施用,造成土壤Cd污染加重[1]。棉花是1种易于富集Cd的作物,且对Cd耐受性低。种子萌发是棉花生长发育过程的敏感阶段,易受到Cd胁迫,进而影响棉花的后期生长[2]。6 mg·L-1 Cd处理对棉花种子萌发产生一定的促进作用,但30 mg·L-1 Cd处理抑制种子萌发,且增加了棉花叶片中可溶性糖、脯氨酸含量[3]。100 μmol·L-1 Cd处理下棉苗干物质质量、根系总根长、总表面积和总体积呈下降趋势[4]。200 μmol·L-1 Cd胁迫显著降低棉花籽棉产量、铃数以及铃重[5]。10 μmol·L-1 Cd胁迫下,豌豆种子的发芽势、发芽率升高;随着Cd浓度的升高,种子发芽势和发芽率、胚根长以及胚芽长显著降低[6]。100 mg·L-1 Cd胁迫降低了水稻胚根的鲜物质质量及干物质质量,且Cd浓度越大、作用时间越长,抑制效应愈加明显[7]。
Cd胁迫导致植物体内活性氧(reactive oxygen species, ROS)积累,超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)活性提高以抵御Cd胁迫对植物造成的氧化损伤[8]。当重金属浓度较低时,植物抗氧化酶活性被激活,可减轻活性氧自由基对细胞膜的伤害;当重金属浓度超过植物耐受值时,活性氧自由基大量产生,抗氧化酶活性受到抑制,从而阻碍植物生长发育[9]。在逆境胁迫下,植物会通过提高渗透调节物质含量保持细胞水势,从而维持植物的正常代谢[10]。研究发现,200 mg·L-1 Cd胁迫下,辣椒种子萌发过程中抗氧化酶活性呈先升高后降低的变化趋势,丙二醛(malondialdehyde, MDA)含量则呈逐渐降低趋势[11]。2 mg·kg-1 Cd胁迫抑制了烟草种子萌发,抗氧化酶SOD活性和CAT活性、可溶性糖含量随Cd2+浓度的增加呈先增后降的趋势,脯氨酸含量则随Cd2+浓度的增加而增加[12]。100 μmol·L-1 Cd胁迫下,棉花幼苗叶片SOD、POD、CAT活性显著降低[13]。Cd2+浓度达到10 μmol·L-1时,小麦种子萌发受到抑制,CAT活性降低[14]。
褪黑素(melatonin, MT)属于吲哚杂环类化合物,极易进入种子内部,具有显著的抗氧化功能,能够促进逆境下种子的萌发和幼苗生长[15-16]。100 μmol·L-1 MT促进10 μmol·L-1 Cd胁迫下豌豆种子萌发,增加幼根、幼芽长度,提高抗氧化酶活性和渗透调节物质含量,降低MDA含量[6]。MT可通过调节氧化还原稳态,缓解Cd胁迫对油菜生长的抑制[17]。MT还可通过增强POD活性、提高可溶性蛋白含量,降低萝卜叶片中Cd2+含量,缓解Cd胁迫产生的毒害[18]。施加100 μmol·L-1 MT可提高400 μmol·L-1 Cd胁迫下苘麻可溶性蛋白含量,维持细胞的正常水分状态[19]。
近年来,国内外专家对Cd胁迫下小麦[20]、水稻[21]、蔬菜[8]种子萌发进行了研究,但有关MT对Cd胁迫下棉花种子萌发影响的研究鲜见报道。因此,本研究以转基因抗虫棉品种农大棉601为材料,研究外源MT对Cd胁迫下棉花种子萌发、抗氧化酶活性和渗透调节物质含量的影响,为MT的应用以及棉花逆境栽培提供理论依据。
1 材料与方法
1.1 供试材料
试验以转基因抗虫棉农大棉601为材料,种子由河间国欣农村技术服务总会提供。试验于2022―2023年在河北农业大学光温高效利用室进行。
1.2 镉胁迫浓度的筛选
选择饱满健康、胚完整的农大棉601种子,用75%(体积分数)酒精消毒15 min,用蒸馏水冲洗干净,加入超纯水在恒温培养箱中避光浸种24 h,随后在通风处晾干,恢复初始含水量(浸种前后种子质量无明显差异)。依据文献[4, 6]以及前期的预试验,设置了6个Cd胁迫浓度,分别为0、10、50、100、150、200 μmol·L-1的CdCl2·2.5H2O溶液。将种子放于铺有2层滤纸的培养皿中,每个培养皿放30粒种子,盖上一层滤纸,用移液枪分别加入不同浓度的CdCl2·2.5H2O溶液10 mL,每个处理重复3次。在25 ℃恒温培养箱中避光培养7 d,每天定时加入8 mL对应浓度的Cd溶液,依据发芽势和发芽率筛选出Cd胁迫的浓度。
1.3 褪黑素浓度的筛选
選择饱满健康、胚完整的棉花种子对其进行消毒后,依据文献[6]及预试验结果,利用0、10、20、50、100 μmol·L-1不同浓度的MT溶液浸种24 h,随后在通风处晾干,恢复初始含水量(浸种前后种子质量无明显差异)。将种子放于培养皿中,每个培养皿30粒种子,分别加入上述5个浓度的MT溶液和筛选出的Cd溶液,共6个处理,其中CK为纯水对照;Cd为100 μmol·L-1的Cd胁迫处理;MT1(100 μmol·L-1 Cd+10 μmol·L-1 MT)、MT2(100 μmol·L-1 Cd+20 μmol·L-1 MT)、MT3(100 μmol·L-1 Cd+50 μmol·L-1 MT)、MT4(100 μmol·L-1 Cd+100 μmol·L-1 MT),每个处理重复3次。在25 ℃恒温培养箱中避光培养7 d,每天定时加入8 mL Cd溶液和对应浓度的MT溶液,依据发芽势和发芽率的变化筛选出适宜的MT浓度。
1.4 试验处理
种子消毒处理后,晾干,以预试验筛选出的100 μmol·L-1 CdCl2·2.5H2O溶液为Cd胁迫浓度,50 μmol·L-1 MT浓度为缓解Cd胁迫的适宜浓度,设置4个处理(每个重复30粒种子):CK,蒸馏水浸种,培养过程中补充水分;MT,50 μmol·L-1 MT浸种,培养过程中补充MT溶液;Cd,蒸馏水浸种,培养过程中补充100 μmol·L-1 CdCl2·2.5H2O溶液;CM,50 μmol·L-1 MT浸种,培养过程中补充100 μmol·L-1 CdCl2·2.5H2O和50 μmol·L-1 MT混合溶液。每个处理重复3次。不同处理的棉花种子在25 ℃恒温培养箱中避光培养7 d,每天定时补充8 mL对应的溶液。
1.5 发芽势、发芽率、发芽指数、活力指数测定
以胚根突破种皮、达到棉花种子长度一半时视为发芽[22]。在种子萌发第3 天测定棉花种子的发芽势(germination potential),第7天测定棉花种子的发芽率(germination rate),另外计算发芽指数(germination index, GI)和活力指数(vigor index)。发芽势=第3天总发芽种子数/种子总数×100%;发芽率=第7天总发芽种子数/种子总数×100%;发芽指数=Σ(Gt/Dt),其中,Gt为第t天时的总发芽粒数,Dt为相应发芽时间(d);活力指数=发芽指数×第7 天的平均根长。
1.6 胚根和胚芽的长度测定及质量测定
种子萌发第7天,每个处理选取30粒棉花种子,用游标卡尺测量棉花胚根和胚芽长度。然后,用吸水纸将表面水分吸干,用分析天平测定棉花种子的胚根和胚芽鲜物质质量。最后105 ℃杀青15 min、80 ℃烘干至质量恒定,用分析天平测定胚根和胚芽的干物质质量。
1.7 抗氧化酶活性、渗透调节物质及MDA含量测定
分别在萌发的第1、3、5、7天取整粒种子,用锡纸包好在液氮中速冻,之后放置于-80 ℃冰箱中保存,每个处理重复3次,每个重复约0.2 g。用购自南京建成生物公司的试剂盒测定抗氧化酶SOD、POD、CAT活性、渗透调节物质(可溶性蛋白、可溶性糖、脯氨酸)含量和MDA含量。
1.8 数据分析
数据分析采用SPSS 27.0.1数据处理系统进行单因素方差分析,用邓肯新复极差法进行差异显著性分析,采用GraphPad Prism 8.0作图。
2 结果与分析
2.1 镉胁迫浓度的筛选
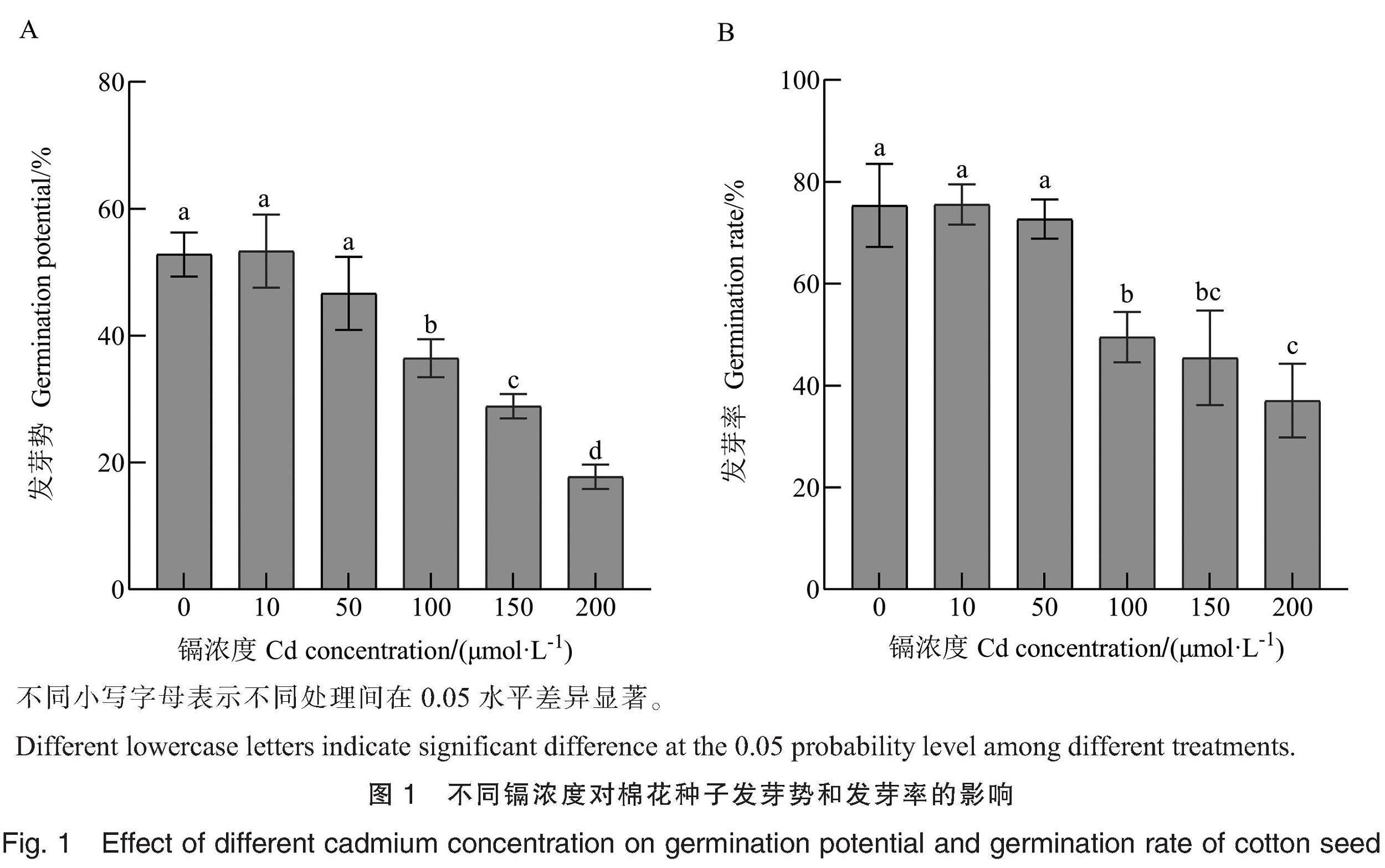
由图1可知,Cd胁迫影响棉花种子萌发。无Cd胁迫(0 μmol·L-1 Cd)时,棉花种子的发芽势和发芽率分别为52.80%和75.37%;当Cd浓度为10 μmol·L-1時,棉花种子的发芽势和发芽率分别为53.34%和75.53%,与0 μmol·L-1 Cd处理相比略高,但无显著差异;当Cd浓度达到50 μmol·L-1时,棉花种子的发芽势和发芽率分别为42.66%和72.68%,与0 μmol·L-1 Cd处理无显著差异,表明低浓度Cd溶液对棉花种子萌发无显著抑制效应。当Cd浓度达到100 μmol·L-1时,棉花种子的发芽势和发芽率分别为36.43%和49.50%,与0 μmol·L-1Cd处理相比分别显著降低16.37和25.87百分点;当Cd浓度为150~200 μmol·L-1时,棉花种子的发芽势显著降低为17.78%~28.89%、发芽率显著降低为37.04%~45.43%,表明高浓度Cd溶液显著抑制棉花种子萌发。根据棉花种子的发芽势和发芽率,筛选出Cd胁迫适宜浓度为100 μmol·L-1。
2.2 褪黑素浓度的筛选
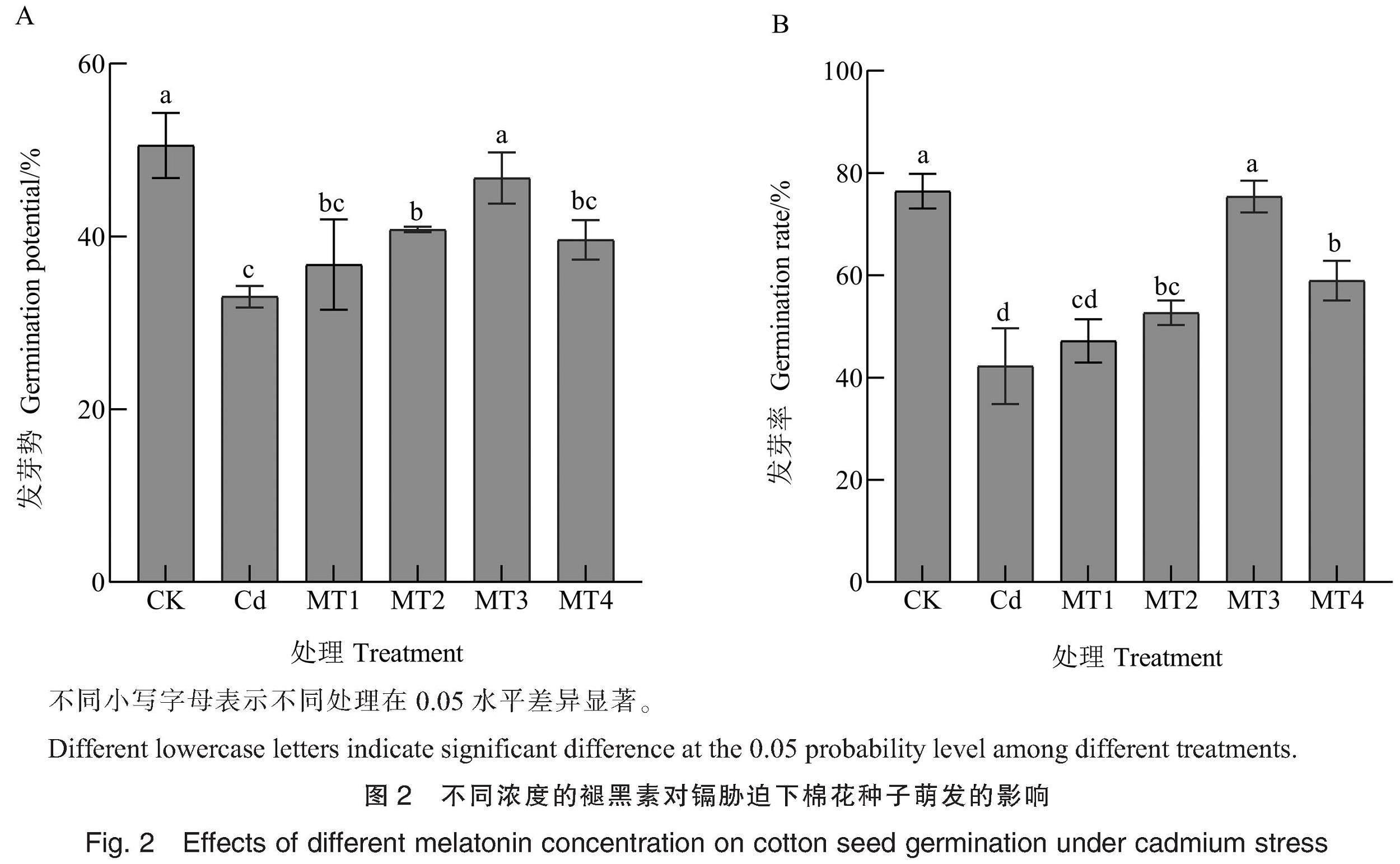
Cd胁迫下,施加不同浓度的褪黑素对棉花种子萌发产生了不同影响(图2)。Cd胁迫下棉花种子的发芽势和发芽率分别为33.03%和42.22%,与CK相比分别显著降低17.51和34.27百分点。施加MT能提高棉花种子的发芽势和发芽率,MT1(10 μmol·L-1 MT)处理下棉花种子的发芽势和发芽率与Cd胁迫下相比虽略有升高,但无显著差异;MT2(20 μmol·L-1 MT)处理下棉花种子的发芽势和发芽率分别为40.81%和52.71%,与Cd胁迫相比分别显著提高7.78和10.49百分点;MT3(50 μmol·L-1 MT)处理下棉花种子的发芽势和发芽率分别为46.76%和75.37%,与Cd胁迫相比显著提高13.73和33.15百分点,与CK(无Cd胁迫)无显著差异;MT4(100 μmol·L-1 MT)处理下棉花种子的发芽势和发芽率分别为39.60%和58.97%,与CK和MT3处理相比显著降低。因此,选择50 μmol·L-1 MT作为缓解Cd胁迫的最适浓度处理。
2.3 褪黑素处理对镉胁迫下棉花种子萌发性状的影响
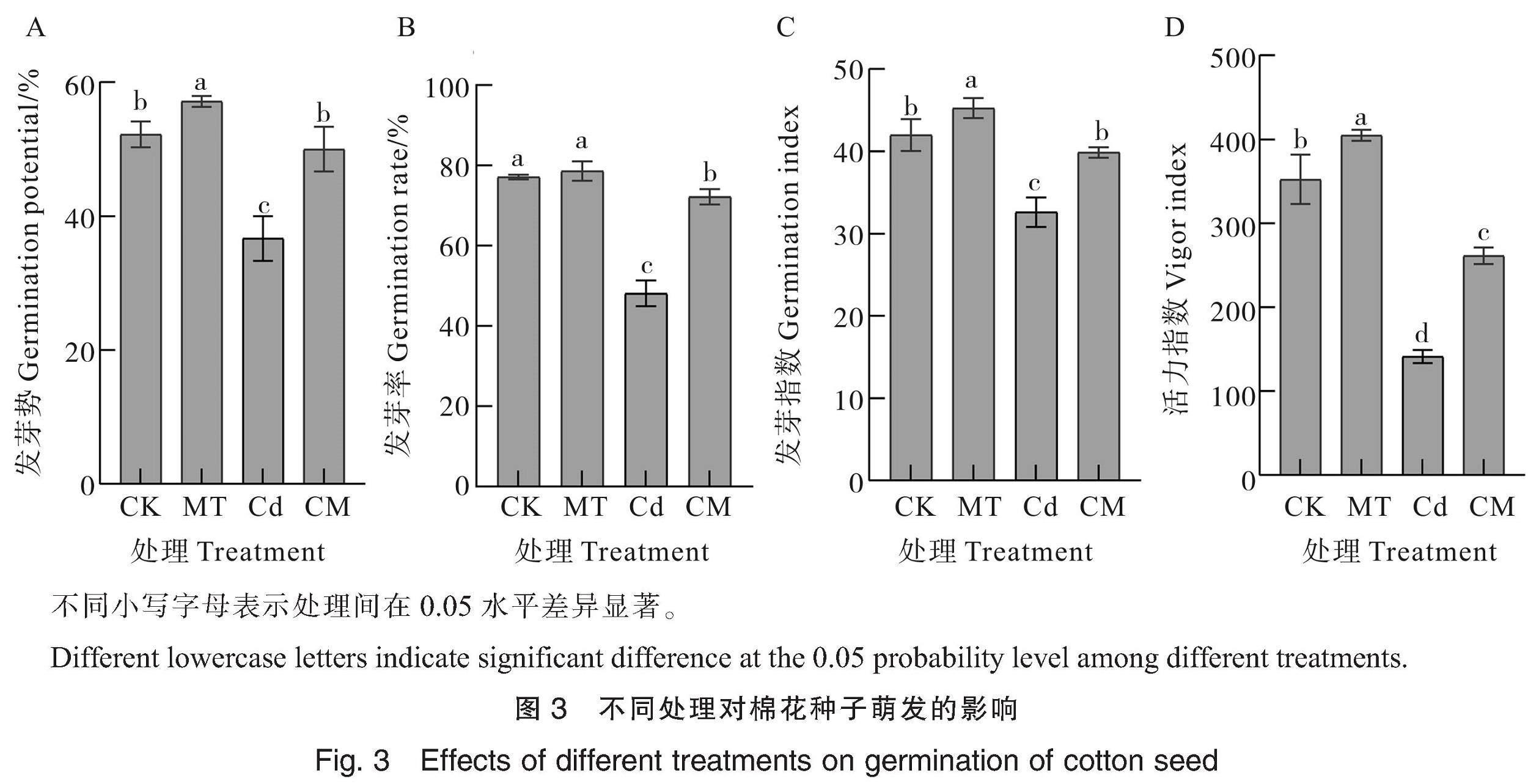
由图3A和3B可知,MT处理棉花种子的发芽势和发芽率分别为57.13%和78.62%;Cd处理下种子的发芽势和发芽率分别为36.67%和48.15%,与CK相比分别显著降低15.55和28.97百分点,表明Cd胁迫抑制种子萌发;CM(Cd胁迫下施加MT)处理后棉花种子的发芽势和发芽率分别为48.89%和71.11%,与Cd处理相比分别显著提高12.22和22.96百分点,发芽势与CK无显著差异。
分析发芽指数(图3C)和活力指数(图3D)可知,MT处理下棉花种子的发芽指数和活力指数分别为42.26和404.73,均显著高于CK;Cd处理下棉花种子的发芽指数和活力指数分别为32.62和141.23,与CK相比分别显著降低22.28%和59.91%;CM处理下棉花种子的发芽指数和活力指数分别为39.86和261.21,分别比Cd处理显著提高22.19%和84.95%。以上结果表明MT能促进正常条件下棉花种子的萌发,并缓解Cd胁迫对棉花种子萌发的抑制作用。
2.4 褪黑素对镉胁迫下棉花种子胚根和胚芽长度及生物量的影响
由图4A可知,MT处理棉花种子的胚根长度最长,显著高于其他处理。Cd胁迫下棉花种子胚根和胚芽长度最短,分别为4.35 cm和5.65 cm,与CK相比分别显著降低47.90%和29.20%,表明Cd胁迫抑制棉花幼苗伸长生长。CM处理下棉花幼苗的胚根和胚芽长度分别为6.50 cm和6.70 cm,与Cd胁迫相比分别显著提高49.43%和18.58%。表明施用MT不仅能促进正常条件下棉花种子胚根的伸长,而且能促进Cd胁迫下胚根与胚芽的伸长生长。
分析棉花种子鲜物质质量(图4B)可知,CK处理下种子胚根和胚芽的鲜物质质量分别为0.58 g和3.06 g;MT处理下胚根和胚芽的鲜物质质量與CK处理无显著差异;Cd胁迫下种子胚根和胚芽的鲜物质质量分别为0.48 g和2.99 g,与CK处理相比,Cd胁迫显著降低了胚根鲜物质质量,但对胚芽鲜物质质量无显著影响。与Cd处理相比,CM处理下胚根鲜物质质量显著增加,而胚芽鲜物质质量无显著差异。Cd胁迫下胚根鲜物质质量和干物质质量显著低于其他处理,而4个处理的胚芽鲜物质质量和干物质质量均无显著差异(图4B和4C),表明MT的应用显著促进了Cd胁迫下棉花胚根的生长。
2.5 褪黑素对镉胁迫下棉花种子抗氧化酶和MDA的影响
由图5A可知,种子萌发过程中SOD活性呈现先升高再降低的变化趋势,各处理的SOD活性均在种子萌发第3天时较高。与CK相比,棉花种子萌发过程中MT处理下SOD活性提高了3.41%~20.82%,且在萌发的第1、5、7 天差异显著。与CK相比,Cd胁迫显著降低了种子萌发过程中SOD活性,在第1、3、5、7天时,分别显著降低15.20%、31.47%、19.30%、13.28%。与Cd胁迫相比,CM处理下种子SOD活性显著提高12.96%~22.87%。表明Cd胁迫抑制了种子SOD活性,施加MT增强了正常条件下及Cd胁迫下种子SOD活性。
由图5B可知,种子萌发过程中POD活性呈现逐渐升高趋势。MT处理下POD活性与CK处理无显著差异。Cd处理显著降低了棉花种子萌发过程中POD活性,在第1、3、5、7 天时,POD活性分别降低了34.17%、41.70%、18.20%、14.74%。与Cd处理相比,CM处理下种子萌发过程中POD活性显著提高20.33%~70.84%,且与CK无显著差异。由此表明,Cd胁迫显著抑制种子萌发过程中POD活性,施加MT能显著提高Cd胁迫下种子萌发过程中POD活性。
由图5C可知,种子萌发过程中CAT活性呈逐渐降低趋势。与CK相比,MT处理下种子萌发过程中CAT活性显著提高6.35%~30.62%。与CK相比,Cd胁迫下显著降低种子萌发过程中CAT活性,在种子萌发第1、3、5、7 天分别降低32.92%、42.49%、39.95%、38.25%。与Cd处理相比,CM处理下种子萌发过程中CAT活性显著提高32.57%~70.44%。表明Cd胁迫显著抑制种子CAT活性,施加MT能显著提高正常条件及Cd胁迫下种子的CAT活性。
由图5D可知,棉花种子萌发过程中MDA含量呈逐渐降低趋势。与CK相比,种子萌发过程中MT处理的MDA含量降低但差异不显著,降低1.89%~24.90%。与CK相比,Cd处理下MDA含量显著升高,在种子萌发第1、3、5、7 天,MDA含量分别提高了5.37%、13.51%、37.51%、15.04%,表明Cd胁迫导致种子膜脂过氧化程度显著提高。与Cd胁迫相比,CM处理下MDA含量显著降低21.46%~28.22%,表明施加MT显著降低Cd胁迫下种子萌发过程中MDA含量,缓解Cd胁迫导致的膜脂过氧化损害。
2.6 褪黑素对镉胁迫下棉花种子渗透调节物质含量的影响
由图6A可知,在种子萌发过程中可溶性蛋白含量呈现逐渐降低的变化趋势。与CK相比,MT处理下种子萌发过程中可溶性蛋白含量提高5.75%~21.48%。与CK相比,Cd处理下种子萌发过程中可溶性蛋白含量显著降低,在萌发第1、3、5、7 天分别降低23.70%、41.80%、31.03%、30.23%,表明Cd胁迫抑制种子萌发中可溶性蛋白积累。与Cd处理相比,CM处理下种子萌发过程中可溶性蛋白含量显著提高36.67%~46.48%。由此表明,施加MT显著提高Cd胁迫下种子萌发过程中的可溶性蛋白含量。
由图6B可知,与CK相比,MT处理下种子萌发过程中可溶性糖含量,提高了0.76%~27.24%。与CK相比,除萌发第1 天外,Cd处理下种子萌发中可溶性糖含量显著提高,在萌发第1、3、5、7 天分别提高4.68%、58.14%、30.04%、63.04%,表明Cd胁迫促进了萌发过程中可溶性糖的积累。与Cd处理相比,CM处理下种子中可溶性糖含量提高了1.45%~18.97%,表明施加MT提高了Cd胁迫下种子萌发过程中可溶性糖含量。
由图6C可知,种子萌发过程中脯氨酸含量呈现先升高再降低的变化趋势,在种子萌发第3天含量最高。萌发第1天,各处理的脯氨酸含量无显著差异。在萌发第3~7 天,与CK相比,MT处理下种子萌发过程中脯氨酸含量降低0.25%~27.67%。与CK相比,Cd处理下种子萌发过程中脯氨酸含量显著升高,在萌发第3~7 天分别提高13.51%、37.51%、15.04%,表明Cd胁迫促进种子萌发中脯氨酸的积累。与Cd处理相比,CM处理下种子萌发过程中脯氨酸含量提高17.73%~31.43%,表明Cd胁迫下,施加MT能显著提高种子萌发3~7 d的脯氨酸含量。
3 讨论
3.1 褪黑素对镉胁迫下棉花种子萌发的调控效应
Cd是1种重金属元素,严重污染环境。据报道,中国土壤中重金属点位的超标率已达16.1%,而Cd以7.0%的点位超标率位居第一[23]。种子萌发阶段受重金属影响较大,重金属在植物体内累积会影响植物的生长发育[6]。研究表明,低浓度(50 μmol·L-1和75 μmol·L-1)Cd处理能促进草地早熟禾的种子萌发,高浓度(100 μmol·L-1)Cd处理则抑制种子萌发[24]。在Cd胁迫下,小麦种子的发芽指数、活力指数显著降低,且Cd浓度越高抑制作用越强[14]。低浓度Cd能促进豌豆种子萌发,高浓度Cd显著降低种子发芽势和发芽率,而施加适宜浓度的MT则能提高Cd胁迫下豌豆种子的发芽势和发芽率[6]。本研究结果表明,10 μmol·L-1、50 μmol·L-1的Cd胁迫下,棉花种子的发芽势和发芽率与对照无显著差异;当Cd浓度达到100 μmol·L-1时,棉花种子的发芽势和发芽率显著降低,且随Cd浓度增加,种子的发芽势和发芽率持续降低。这与前人的研究结果较为一致,低浓度Cd会提高种子胚的生理活性,而高浓度Cd则会抑制种子的代谢过程,对种子胚、芽等产生毒害作用[25]。MT易进入种子内部,具有显著的抗氧化能力,因此施加MT后促进了Cd胁迫下棉花种子萌发。
胚根和胚芽的长度和生物量是评价植物抗逆能力的关键指标。研究表明,100 μmol·L-1 Cd胁迫显著降低早熟禾种子的胚根和胚芽长度[24]。Cd胁迫下,水稻芽和根的生长受到明显限制,施加10 μmol·L-1的MT能显著提高水稻根长[26]。Cd胁迫下,豌豆芽和根的鲜物质质量降低,适宜浓度MT处理能提高Cd胁迫下豌豆的芽长、根长、芽鲜物质质量和根鲜物质质量[6]。本研究结果表明,Cd胁迫显著降低棉花种子胚根和胚芽的长度、胚根的鲜物质质量和干物质质量。对胚根的抑制作用大于胚芽,这可能是由于根系直接吸收了大量Cd2+,抑制了根尖细胞的有丝分裂过程,使根系生长受到抑制,导致生物量減少;而且胚根是最早接受Cd毒害的部位,所以受到的影响更大[8, 27]。Cd胁迫下,施加MT能显著提高棉花种子胚根和胚芽长度、胚根的鲜物质质量和干物质质量,缓解了Cd胁迫对棉花种子萌发的抑制作用,这与前人的研究结果较为一致。
3.2 褪黑素对镉胁迫下棉花种子抗氧化能力的调控效应
Cd可抑制植物的抗氧化防御系统,导致ROS积累;或通过增加Fenton金属含量直接产生ROS,Cd2+可与Fe2+相互作用,从而导致植物膜脂过氧化程度加重、MDA含量增加[28]。植物在抵抗Cd胁迫过程中,可以通过调节SOD、POD、CAT活性来抵御伤害[8]。MT能够提高植物抗氧化酶活性,增强植物抵抗逆境胁迫的能力[17]。研究发现,MT处理显著提高了Cd胁迫下燕麦幼苗SOD、POD和CAT活性,降低了MDA的含量[29]。苏海兰等[30]研究发现,种子萌发过程中SOD、POD活性呈逐渐升高的趋势,而CAT活性呈现逐渐降低的趋势。本研究结果表明,Cd胁迫显著降低了棉花种子中抗氧化酶活性,这可能是由于100 μmol·L-1 Cd胁迫超过了棉花种子的耐胁迫能力,细胞膜结构被破坏,ROS的产生与清除系统失去平衡,抗氧化酶活性受到抑制[28]。MT具有亲脂性与亲水性,能够协助增强抗氧化酶对活性氧的清除作用[16]。棉花种子萌发过程中SOD活性呈现先升高再降低的趋势,POD活性呈逐渐升高的趋势,CAT活性呈逐渐降低的趋势,这可能是由于种子萌发需要较高的SOD活性,因此,SOD在萌发前期最先被激活。POD活性在种子萌发后期显著提高,说明较高的POD活性可以促进种子出苗。MDA含量反映植物膜脂过氧化程度,MDA含量越高其膜脂过氧化程度则越高[31]。黄承玲等[32]发现迷人杜鹃种子萌发过程中MDA含量逐渐降低,本研究结果与此一致,这可能是由于种子在萌发初期MDA含量较高,当种子吸胀萌动后,激活了抗氧化酶活性,从而使膜脂过氧化程度降低。
3.3 褪黑素对镉胁迫下棉花种子萌发中渗透调节物质的影响
可溶性蛋白、可溶性糖和脯氨酸是植物体内重要的渗透调节物质,当植物受到逆境胁迫时,这三者协调作用维持细胞的含水量和膨压势,从而使植物维持正常生长[33]。研究发现,当重金属浓度较低时,植物会通过渗透调节物质来调节细胞渗透平衡,抑制重金属进入细胞;当重金属浓度较高时会破坏细胞结构,导致渗透物质含量降低[34]。Cd胁迫下,燕麦幼苗可溶性蛋白含量降低,脯氨酸含量升高,施加MT后可溶性蛋白、脯氨酸和可溶性糖含量提高[29]。Cd胁迫下,侧柏幼苗可溶性蛋白含量、可溶性糖含量降低,脯氨酸含量升高[35]。本研究中Cd胁迫下棉花种子中可溶性蛋白含量降低、脯氨酸含量升高,这与前人的研究结果较为一致,这是由于植物细胞中可溶性蛋白能与Cd2+络合,导致蛋白质与氧自由基反应从而导致氨基酸结构改变、多肽链断裂、蛋白质水解,最终造成可溶性蛋白含量降低[36-37]。Cd胁迫下,棉花种子可能通过增加脯氨酸含量来维持细胞的正常水势,脯氨酸还可与Cd形成络合物,以降低细胞中Cd含量。逆境条件下,可溶性糖可调节细胞水势和细胞吸水能力[38]。本研究结果表明,Cd胁迫下棉花种子中可溶性糖含量升高,这与前人的研究结果并不一致,这可能是因为在Cd胁迫初期,碳水化合物积累,促进淀粉水解,导致可溶性糖含量增加,从而维持细胞的渗透平衡[39]。MT易于透过细胞膜进入细胞,并且其吸附在细胞膜上有利于维持细胞膜结构稳定[16]。因此,施加MT能够提高棉花种子中渗透调节物质的含量,提高棉花抗逆性,缓解Cd胁迫对棉花种子萌发的抑制作用。
3.4 褪黑素在镉污染超标棉田中的应用前景分析
棉花能够富集Cd,是镉污染农田的修复作物[2, 40]。Cd污染达到一定程度时会破坏细胞结构,抑制棉花种子萌发和根系的生长[4],降低棉花单株铃数、铃重,显著降低籽棉产量和皮棉产量[41]。本研究结果表明,施加50 μmol·L-1 MT能提高棉花种子抗氧化酶活性,增加渗透调节物质含量,降低MDA含量,有效缓解Cd胁迫对棉花种子萌发的抑制作用。前人研究发现,施加100 μmol·L-1 MT能提高Cd胁迫下豌豆种子中抗氧化酶活性,降低Cd积累量,促进种子萌发[6];施加MT能提高Cd胁迫下水稻幼苗根系活力,增强抗氧化酶活性,促进水稻种子萌发[26]。施加适宜浓度的MT均能促进Cd胁迫下多种植物种子的萌发,提高植物抗性。因此,对于棉花等易于富集Cd的作物来说,在萌发前期进行一定浓度的MT处理有利于种子萌发,促进壮苗。由此推测,在Cd污染超标棉田中,通过MT浸种能降低植株Cd积累量,促进棉花生长、提高棉花产量。上述推证有待于进一步研究。
4 结论
本研究结果表明,低浓度(10 μmol·L-1、50 μmol·L-1) Cd胁迫对棉花种子萌发无显著抑制作用,100 μmol·L-1及更高浓度的Cd胁迫显著抑制种子萌发,且Cd浓度越高抑制作用越强。Cd胁迫下,施加50 μmol·L-1 MT促进种子萌发效果最好。Cd胁迫抑制棉花种子胚根、胚芽生长,降低抗氧化酶活性和可溶性蛋白含量,增加可溶性糖、脯氨酸和MDA含量;Cd胁迫下施加MT能提高种子抗氧化酶活性,显著增加渗透物质含量,降低MDA含量,从而缓解Cd胁迫对棉花种子萌发的抑制作用,增强棉花抵御逆境的能力。
参考文献:
[1] Guo B, Liu C, Liang Y C, et al. Salicylic acid signals plant defence against cadmium toxicity[J/OL]. International Journal of Molecular Sciences, 2019, 20(12): 2960[2023-02-20]. https://doi.org/10.3390/ijms20122960.
[2] 李娟, 闫旭宇, 吴香, 等. 纤维类作物对农田土壤镉污染修复的研究进展[J/OL]. 中国农业科技导报, 2022, 24(11): 171-178[2023-05-06]. https://doi.org/10.13304/j.nykjdb.2021.0504.
Li Juan, Yan Xuyu, Wu Xiang, et al. Research progress on the remediation of cadmium contaminated farmland soil by fiber crops[J/OL]. Journal of Agricultural Science and Technology, 2022, 24(11): 171-178[2023-05-06]. https://doi.org/10.13304/j.nykjdb.2021.0504.
[3] 郑世英, 张秀玲, 王丽燕, 等. 铅和镉胁迫对棉花种子萌发及有机渗透调节物质的影响[J]. 中国棉花, 2007, 19(5): 16-17.
Zheng Shiying, Zhang Xiuling, Wang Liyan, et al. Effects of lead and cadmium stress on cotton seed germination and organic osmotic regulator[J]. China Cotton, 2007, 19(5): 16-17.
[4] 劉连涛, 陈静, 孙红春, 等. 镉胁迫对棉花幼苗生长效应及不同器官镉积累的影响[J]. 棉花学报, 2014, 26(5): 466-470.
Liu Liantao, Chen Jing, Sun Hongchun, et al. Effects of cadmium stress on growth and cadmium accumulation in cotton (Gossypium hirsutum L.) seedlings[J]. Cotton Science, 2014, 26(5): 466-470.
[5] 李玲. 镉胁迫对陆地棉生长发育、产量和品质的影响及其耐镉性的遗传研究[D]. 杭州: 浙江大学, 2013.
Li Ling. Effect of cadmium stress on growth, yield and quality in upland cotton and its genetic analysis for cadmium tolerance[D]. Hangzhou: Zhejiang University, 2013.
[6] 李冬, 王艳芳, 王悦华, 等. 外源褪黑素对镉胁迫下豌豆种子萌发、幼苗抗性生理及镉含量的影响[J/OL]. 核农学报, 2019, 33(11): 2271-2279[2023-02-20]. https://doi.org/10.11869/j.issn.100-8551.2019.11.2271.
Li Dong, Wang Yanfang, Wang Yuehua, et al. Effects of exogenous melatonin on seed germination, seedling resistance physiology and Cd content of pea under cadmium stress[J/OL]. Journal of Nuclear Agricultural Sciences, 2019, 33(11): 2271-2279[2023-02-20]. https://doi.org/10.11869/j.issn.100-8551.2019.11.2271.
[7] Li Y Z, Liang L X, Li W, et al. ZnO nanoparticle-based seed priming modulates early growth and enhances physio-biochemical and metabolic profiles of fragrant rice against cadmium toxicity[J]. Journal of Nanobiotechnology, 2021, 19(1): 75.
[8] Gill S S, Khan N A, Tuteja N. Differential cadmium stress tolerance in five Indian mustard(Brassica juncea L.) cultivars: an evaluation of the role of antioxidant machinery[J]. Plant Signaling & Behavior, 2011, 6(2): 293-300.
[9] Meng Y, Zhang L, Wang L Q, et al. Antioxidative enzymes activity and thiol metabolism in three leafy vegetables under Cd stress[J/OL]. Ecotoxicology and Environmental Safety, 2019, 17(3): 214-224[2023-02-14]. https://doi.org/10.1016/j.ecoenv.2019.02.026.
[10] Brahim L, Mohamed M. Effects of copper stress on antioxidative enzymes, chlorophyll and protein content in Atriplex halimus[J]. African Journal of Biotechnology, 2011, 10(50): 10143-10148.
[11] 龍春丽, 宋拉拉, 胡明文, 等. 镉胁迫对不同品种辣椒种子萌发及苗期抗性生理的影响[J]. 种子, 2021, 40(5): 105-109.
Long Chunli, Song Lala, Hu Mingwen, et al. Effects of cadmium stress on seed germination and seedling resistance physiology of different Capsicum annuum varieties[J]. Seed, 2021, 40(5): 105-109.
[12] 闫晶, 姬文秀, 石贤吉, 等. 镉胁迫对不同烟草品种生长发育的影响[J/OL]. 中国农业大学学报, 2019, 24(5): 30-38[2023-02-14]. https://doi.org/10.11841/j.issn.1007-4333.2019.05.04.
Yan Jing, Ji Wenxiu, Shi Xianji, et al. Effects of cadmium stress on the growth and development of different tobacco varieties[J/OL]. Journal of China Agricultural University, 2019, 24(5): 30-38[2023-02-14]. https://doi.org/10.11841/j.issn.1007-4333.2019.05.04.
[13] Khan A, Zheng J , Kong X J, et al. Pre-treatment of melatonin rescues cotton seedlings from cadmium toxicity by regulating key physio-biochemical and molecular pathways[J]. Journal of Hazardous Materials, 2023, 445: 130530.
[14] Zhang L, Gao B B. Effect of isosteviol on wheat seed germination and seedling growth under cadmium stress[J/OL]. Plants, 2021, 10(9): 1779[2023-05-17]. https://doi.org/10.3390/plants10091779.
[15] 陈莉, 刘连涛, 马彤彤, 等. 褪黑素对盐胁迫下棉花种子抗氧化酶活性及萌发的影响[J/OL]. 棉花学报, 2019, 31(5): 438-447[2023-02-20]. https://doi.org/10.11963/1002-7807.cllcd.20190905.
Chen Li, Liu Liantao, Ma Tongtong, et al. Effects of melatonin on the antioxidant activities and seed germination of cotton (Gossypium hirsutum L.) under salt stress conditions[J/OL]. Cotton Science, 2019, 31(5): 438-447[2023-02-20]. https://doi.org/10.11963/1002-7807.cllcd.20190905.
[16] Duan W J, Lu B, Liu L T, et al. Effects of exogenous melatonin on root physiology, transcriptome and metabolome of cotton seedlings under salt stress[J/OL]. International Journal of Molecular Sciences, 2022, 23(16): 9456[2023-05-04]. https://doi.org/10.3390/ijms23169456.
[17] Sami A, Shah F A, Abdullah M, et al. Melatonin mitigates cadmium and aluminum toxicity through modulation of antioxidant potential in Brassica napus L.[J/OL]. Plant Biology, 2020, 22(4): 679-690[2023-02-15]. https://doi.org/10.1111/plb.13093.
[18] 黄佳璟, 林立金, 陈发波, 等. 喷施褪黑素对萝卜生长及镉积累的影响[J/OL]. 四川农业大学学报, 2017, 35(3): 375-380[2023-02-15].https://doi.org/10.16036/j.issn.1000-2650.2017.03.014.
Huang Jiajing, Lin Lijin, Chen Fabo, et al. Effects of spraying melatonin on growth and cadmium accumulation of radish[J/OL]. Journal of Sichuan Agricultural University, 2017, 35(3): 375-380[2023-02-15]. https://doi.org/10.16036/j.issn.1000-2650.2017.03.014.
[19] 付靖雯. 褪黑素調节镉胁迫下苘麻幼苗生理与生化功能的机制[D]. 兰州: 西北师范大学, 2021
Fu Jingwen. Mechanism of melatonin regulating physiological and biochemical functions of Abutilon theophrasti Medicus seedings under cadmium stress[D]. Lanzhou: Northwest Normal University, 2021.
[20] 夏雪姣. 镉、铅胁迫对小麦形态发育和生理代谢的影响及富集特性研究[D]. 杨凌: 西北农林科技大学, 2018.
Xia Xuejiao. Effects of cadmium, lead stress on morphological development and physiological metabolism and research on their accumulation in wheat[D]. Yangling: Northwest Agriculture & Forestry University, 2018.
[21] 王燕宁, 黄涛, 吴光亮, 等. 水稻芽期响应镉胁迫的转录组分析[J]. 华北农学报, 2022, 37(5): 25-35.
Wang Yanning, Huang Tao, Wu Guangliang, et al. Transcriptome analysis of rice bud stage in response to cadmium stress[J]. Acta Agriculturae Boreali Sinica, 2022, 37(5): 25-35.
[22] 张同祯, 李永生, 张国旗, 等. 3种标准发芽试验方法对玉米种子发芽的影响[J]. 中国种业, 2014(12): 43-47.
Zhang Tongzhen, Li Yongsheng, Zhang Guoqi, et al. Effect of three standard germination test methods on germination of maize seeds[J]. China Seed Industry, 2014(12): 43-47.
[23] Zhang X Y, Zhong T Y, Liu L, et al. Impact of soil heavy metal pollution on food safety in China[J/OL]. PLoS ONE, 2015, 10(8): e0135182[2023-02-26]. https://doi.org/10.1371/journal.pone.0135182.
[24] 马志强, 史毅, 种培芳. 外源茉莉酸甲酯对镉污染下草地早熟禾种子萌发及幼苗生长的影响[J/OL]. 草地学报, 2022, 30(6): 1475-1484[2023-03-01]. https://doi.org/10.11733/j.issn.1007-0435.2022.06.019.
Ma Zhiqiang, Shi Yi, Chong Peifang. Effects of exogenous methyl jasmonate on seed germination and seedling growth of Kentucky Bluegrass under cadmium pollution[J/OL]. Acta Agrestia Sinica, 2022, 30(6): 1475-1484[2023-03-01]. https://doi.org/10.11733/j.issn.1007-0435.2022.06.019.
[25] Jaouani K, Karmous I, Ostrowaki M, et al. Cadmium effects on embryo growth of pea seeds during germination: investigation of the mechanisms of interference of the heavy metal with protein mobilization related factors[J/OL]. Journal of Plant Physiology, 2018, 226: 64-76[2023-03-02]. https://doi.org/10.1016/j.jplph.2018.02.009.
[26] 刘仕翔. 外源褪黑素对水稻镉毒害的缓解作用[D]. 武汉: 中国地质大学, 2017.
Liu Shixiang. Alleviation effects of exogenous melatonin on cadmium toxicity in rice[D]. Wuhan: China University of Geosciences, 2017.
[27] 喻望晨, 朱依晗, 徐倩, 等. 镉胁迫对不同繁穗苋种质萌发和生长的影响[J/OL]. 草业科学, 2022, 39(9): 1815-1822[2023-01-31]. https://doi.org/10.16590/j.cnki.1001-4705.2018.07.043.
Yu Wangchen, Zhu Yihan, Xu Qian, et al. Effect of cadmium stress on seed germination and growth of Amaranthus cruentus germplasms from different locations[J/OL]. Pratacultural Science, 2022, 39(9): 1815-1822[2023-01-31]. https://doi.org/10.16590/j.cnki.1001-4705.2018.07.043.
[28] Dukic ′ -C ′osic ′ D, Baralic ′ K, Javorac D, et al. An overview of molecular mechanisms in cadmium toxicity[J/OL]. Current Opinion in Toxicology, 2020, 19: 56-62[2023-03-02]. https://doi.org/10.1016/j.cotox.2019.12.002.
[29] Wang K, He J J, Gao Y, et al. Exogenous melatonin improved the growth and development of naked oat seedlings under cadmium stress[J/OL]. Environmental Science and Pollution Research, 2022, 29(58): 88109-88118[2023-02-21]. https://doi.org/10.1007/s11356-022-21798-3.
[30] 苏海兰, 周先治, 李希, 等. 七叶一枝花种子萌发不同阶段生理生化变化研究[J/OL]. 中草药, 2017, 48(22): 4755-4763[2023-03-07]. https://doi.org/10.7501/j.issn.0253-2670.2017.22.026.
Su Hailan, Zhou Xianzhi, Li Xi, et al. Physicochemical changes of Paris polyphylla var. chinensis seed during different stages of germination[J/OL]. Chinese Traditional and Herbal Drugs, 2017, 48(22): 4755-4763[2023-03-07]. https://doi.org/10.7501/j.issn.0253-2670.2017.22.026.
[31] 刘朝荣, 张柳青, 杨艳, 等. 珙桐幼苗生理生化指标对重金属铅、镉胁迫的响应[J]. 广西植物, 2021, 41(9): 1401-1410.
Liu Zhaorong, Zhang Liuqing, Yang Yan, et al. Effects of lead and cadmium on physiology and biochemical indexes of Davidia involucrata seedlings[J]. Guihaia, 2021, 41(9): 1401-1410.
[32] 黄承玲, 高贵龙, 陈训, 等. 迷人杜鹃种子萌发过程中的生理变化[J]. 种子, 2010, 29(5): 94-96.
Huang Chengling, Gao Guilong, Chen Xun, et al. Physiological changes of Rhododendron agastum Balf. f. et W. W. Sm during seed germination[J]. Seed, 2010, 29(5): 94-96.
[33] Anwar M H, Pukclai P, Teixeira A J S D, et al. Molecular mechanism of heavy metal toxicity and tolerance in plants: central role of glutathione in detoxification of reactive oxygen species and methylglyoxal and in heavy metal chelation[J/OL]. Journal of Botany, 2012: 1-37[2023-03-01]. https://doi.org/10.1155/2012/872875.
[34] 王明明, 肖鈺鑫, 庄伟伟. Pb胁迫对西北地区三种藓类植物生理生化的影响[J/OL ]. 生态学杂志, 2023, 42(7): 1618-1626[2023-03-07]. https://doi.org/10.13292/j.1000-4890.202307.005.
Wang Mingming, Xiao Yuxin, Zhuang Weiwei. Effects of Pb stress on physiology and biochemistry of three mosses in northwest China[J/OL]. Chinese Journal of Ecology, 2023, 42(7): 1618-1626[2023-03-07]. https://doi.org/10.13292/j.1000-4890.202307.005.
[35] Ou C, Cheng W, Wang Z, et al. Exogenous melatonin enhances Cd stress tolerance in Platycladus orientalis seedlings by improving mineral nutrient uptake and oxidative stress[J/OL]. Ecotoxicology and Environmental Safety, 2023, 252: 114619[2023-03-09]. https://doi.org/10.1016/j.ecoenv.2023.114619.
[36] Bartolf M, Brennan E, Price C A. Partial characterization of a cadmium binding protein from the roots of cadmium treated tomato[J/OL]. Plant Physiology, 1980, 66(3): 438-441[2023-03-09]. https://doi.org/10.1104/pp.66.3.438.
[37] 杨晓远, 王海娟, 王宏镔. 龙葵(Solanum nigrum L.)超富集镉的生理和分子机制研究进展[J/OL]. 生态毒理学报, 2020, 15(6): 72-81[2023-03-09]. https://doi.org/10.7524/AJE.1673-5897.20200107003.
Yang Xiaoyuan, Wang Haijuan, Wang Hongbin. Advances in physiological and molecular mechanisms of cadmium hyperaccumulation by Solanum nigrum L.[J/OL]. Asian Journal of Ecotoxicology, 2020, 15(6): 72-81[2023-03-09]. https://doi.org/10.7524/AJE.1673-5897.20200107003.
[38] 张义贤, 李晓科. 镉、铅及其复合污染对大麦幼苗部分生理指标的影响[J]. 植物研究, 2008(1): 43-46, 53.
Zhang Yixian, Li Xiaoke. Effects of Cd, Pb and their combined pollution on physiological indexes in leaf of the Hordeum vulgare seedling[J]. Bulletin of Botanical Research, 2008(1): 43-46, 53.
[39] 李德生, 何安, 彭玲, 等. 重金属对日本楤木内渗透调节物质的影响[J/OL]. 江苏农业科学, 2018, 46(1): 101-104[2023-03-09]. https://doi.org/10.15889/j.issn.1002-1302.2018.01.027.
Li Desheng, He An, Peng Ling, et al. The effect of heavy metals on osmotic regulating substances in Aralia elata var. inermis[J/OL]. Jiangsu Agricultural Sciences, 2018, 46(1): 101-104[2023-03-09]. https://doi.org/10.15889/j.issn.1002-1302.2018.01.027.
[40] 李玉军, 张志刚, 匡政成, 等. 植棉修复镉污染土壤研究进展[J/OL]. 中国棉花, 2017, 44(4): 8-10, 2[2023-03-21]. https://doi.org/10.11963/1000-632X.lyjchd.20170330.
Li Yujun, Zhang Zhigang, Kuang Zhengcheng, et al. Research progress in remediation of cadmium contaminated soils by planting cotton[J/OL]. China Cotton, 2017, 44(4): 8-10, 2[2023-03-21]. https://doi.org/10.11963/1000-632X.lyjchd.20170330.
[41] 陳悦, 李玲, 何秋伶, 等. 镉胁迫对三个棉花品种(系)产量、纤维品质和生理特性的影响[J/OL]. 棉花学报, 2014, 26(6): 521-530[2023-03-21]. https://doi.org/10.11963/cs140607.
Chen Yue, Li Ling, He Qiuling, et al. Effects of cadmium stress on yield, fiber quality, and physiological traits of three upland cotton cultivars (lines)[J/OL]. Cotton Science, 2014, 26(6): 521-530[2023-03-21]. https://doi.org/10.11963/cs140607.
