启动子低甲基化介导NOL9过表达促进肝癌细胞增殖
2023-04-27陈希瑶许镇邬喆斌张博翔彭亮谢婵
陈希瑶?许镇?邬喆斌?张博翔?彭亮?谢婵


【摘要】目的 探討核仁蛋白9(NOL9)在肝癌中的表达和对肝癌细胞增殖的影响,进一步阐明NOL9在肝癌中表达上调的分子机制。方法 选择7例肝癌患者的手术标本(癌组织和癌旁组织),通过蛋白免疫印迹法和反转录-实时荧光定量PCR(RT-qPCR)检测NOL9在癌组织和癌旁组织中的表达水平;分别转染小干扰RNA(si-RNA)到肝癌Huh7和HCCLM3细胞,采用RT-qPCR、蛋白免疫印迹法、细胞集落形成实验、细胞计数试剂盒-8(CCK-8)分析差异;利用TCGA数据库肝癌数据评估NOL9 mRNA表达水平和启动子的甲基化水平,同时评估NOL9和DNA甲基异位擦除蛋白家族(TET1、TET2和TET3)转录水平的相关性;采用RT-qPCR和蛋白免疫印迹法检测DNA去甲基化试剂5-Aza-Dc处理后Huh7和HCCLM3细胞中NOL9表达水平的变化;5-Aza-Dc预处理后再转染si-RNA,采用细胞集落形成实验和CCK-8分析细胞增殖的差异。结果 NOL9在肝癌组织中表达上调;敲低NOL9能抑制肝癌Huh7和HCCLM3细胞增殖以及细胞集落形成(P均 < 0.01);肝癌中NOL9启动子甲基化与其mRNA水平呈负相关,NOL9 mRNA水平和一个CpG区域(cg07997941)呈负相关;在肝癌中,NOL9与TET1、TET2和TET3的转录水平均呈正相关;在给予5-Aza-Dc处理后,NOL9的表达上调;5-Aza-Dc的处理能逆转敲低NOL9对肝癌细胞增殖以及克隆形成的抑制作用。结论 NOL9在肝癌组织中高表达,敲低NOL9抑制了肝癌细胞的增殖和克隆形成,其上调机制可能与启动子低甲基化相关。
【关键词】肝细胞癌;核仁蛋白9;增殖;甲基化
Promoter hypomethylation promotes proliferation of hepatocellular carcinoma cells by mediating NOL9 overexpression
Chen Xiyao, Xu Zhen, Wu Zhebin, Zhang Boxiang, Peng Liang, Xie Chan. Department of Infectious Disease,the Third Affiliated Hospital of Sun Yat-sen University,510630 Guangzhou,China
Corresponding author,Xie Chan,E-mail: xchan@mail.sysu.edu.cn
【Abstract】Objective To evaluate the expression of nucleolar protein 9 (NOL9) in hepatocellular carcinoma and the effect of NOL9 on the proliferation of hepatocellular carcinoma cells, aiming to elucidate the molecular mechanism of NOL9 overexpression in hepatocellular carcinoma. Methods Surgical specimens (cancerous and para-cancerous tissues) were obtained from 7 patients with hepatocellular carcinoma. The expression levels of NOL9 in the cancerous and para-cancerous tissues were determined by Western blot and RT-qPCR. Huh7 and HCCLM3 cell were transferred with NOL9 si-RNA. The differences between two groups were analyzed by RT-qPCR, Western blot, colony formation assay and CCK-8 assay. Hepatocellular carcinoma data from TCGA database were used to evaluate the expression level of NOL9 mRNA and promoter methylation level. The correlation between NOL9 and transcription levels of Ten-eleven-translocation enzymes (TET1, TET2 and TET3) was analyzed. After administration of 5-Aza-Dc, the expression level of NOL9 in Huh7 and HCCLM3 cells was detected by RT-qPCR and Western blot. The cells were pretreated with 5-Aza-Dc and transfected with si-RNA, and then colony formation assay and CCK-8 assay were used to analyze the difference of cell proliferation. Results The expression of NOL9 was up-regulated in hepatocellular carcinoma tissues compared with para-cancerous tissues. Knockdown of NOL9 could significantly inhibit cell proliferation and cell colony formation in Huh7 and HCCLM3 cells (all P < 0.01). The methylation level of NOL9 promoter was negatively correlated with its mRNA level in hepatocellular carcinoma. NOL9 mRNA level was negatively correlated with one CpG region (cg07997941). In hepatocellular carcinoma, NOL9 was positively correlated with the transcription levels of TET1, TET2 and TET3. After administration of 5-Aza-Dc, the expression level of NOL9 was up-regulated. Treatment with 5-Aza-Dc could reverse the inhibitory effect of NOL9 knockdown on cell proliferation and colony formation. Conclusion NOL9 is highly expressed in hepatocellular carcinoma tissues. Knockdown of NOL9 suppresses the proliferation and colony formation of hepatocellular carcinoma cells. The mechanism underlying NOL9 up-regulation may be related to promoter hypomethylation.
【Key words】Hepatocellular carcinoma; NOL9; Proliferation; Methylation
肝细胞癌(肝癌)是原发性肝癌的主要形式,占肝癌病例的75%~85%,且是全球癌症相关死亡的第三大原因[1]。自2019年Science一篇文献报道,核仁可以暂时性储存错误折叠的蛋白质,对于蛋白质的质量控制至关重要[2]。核仁蛋白(NOL)已成为恶性肿瘤相关领域的研究热点,Hong等[3]发现端粒酶以NOL1蛋白依赖的方式激活细胞周期蛋白D1基因的转录。Gu等[4]在前列腺癌中发现NOL8的上调及其的致癌作用。Chen等[5]根据Kaplan-Meier生存分析得出结论,NOL4的表达与子宫内膜癌的总生存时间相关。Liang等[6]发现NOL6在子宫内膜癌细胞中作为一种促癌基因。Heindl等(2010年)和Bielczyk等(2015年)发现,NOL9是一种多核苷酸5′-激酶,主要位于细胞核仁中,对核糖体RNA成熟至关重要。已有研究发现NOL9与多种恶性肿瘤密切相关,如三阴性乳腺癌和急性髓系白血病等[7-8]。Castle等(2012年)认为,NOL9参与重要癌症标志基因Las1L的组装和运输,且与细胞周期相关蛋白P53密切相关,可诱导细胞周期阻滞。这些都提示NOL9可能与肝癌的发生、发展过程密切相关。
本研究旨在阐明NOL9在肝癌中的具体作用和潜在机制,以期寻找肝癌诊断的生物标志物和潜在的治疗靶点。
材料与方法
一、研究对象
收集2020年9月至2021年12月在中山大学附属第三医院行肝癌切除术的7例患者肝脏肿瘤组织和癌旁组织样本,-80℃保存。肝癌组织均经病理学确诊。本研究经中山大学附属第三医院伦理委员会批准(批件号:中大附三申伦[2021]02-356),所有参与者均知情同意。
二、细胞及主要试剂
肝细胞癌Huh7和HCCLM3细胞均来自中山大学附属第三医院肝病实验室,胎牛血清、高糖DMEM培养基、0.25%乙二胺四乙酸(EDTA)胰蛋白酶溶液、青霉素加鏈霉素以及磷酸盐缓冲液(PBS)均购自美国Gibco公司,NOL9小干扰RNA(siRNA)及阴性对照购自广州汉一生物科技有限公司,转染试剂Lipofectamine 3000及Opti-MEM无血清培养基购自美国Thermo Fisher公司,反转录试剂盒、实时荧光定量PCR试剂盒购自日本TaKaRa公司,蛋白免疫印迹相关试剂均购自上海雅酶生物医药科技有限公司,DNA去甲基化试剂5-Aza-Dc购自美国Sigma公司,PCR所需引物均购自生工生物工程(上海)股份有限公司,第一抗体:NOL9(1∶1000, ab140597)和GAPDH(1∶3000, ab8245)以及第二抗体均购自英国Abcam公司,细胞计数试剂盒-8(CCK-8)试剂盒购自广州信研生物科技有限公司,结晶紫染液购自北京索莱宝科技有限公司。
三、方 法
1.细胞培养和转染
取对数生长期的肝癌HCCLM3和Huh7细胞用于实验。根据转染试剂Lipofectamine 3000脂质体说明书将NOL9 siRNA(si-NOL9#1和si-NOL9#2)和阴性对照si-RNA分别添加到肝癌HCCLM3和Huh7细胞,转染的细胞在恒温箱培养24~72 h后进行后续实验。根据转染物的不同,实验分为NOL9敲低组(si-NOL9#1和si-NOL9#2)和阴性对照组(si-nc)。
2. CCK-8检测
细胞转染24 h后,接种在96孔板中,细胞密度1×104/孔,每组设置6个复孔。使用CCK-8检测细胞增殖能力,根据CCK-8试剂盒说明书,在37℃下培养1 h后,酶标仪测量490 nm处各孔吸光度值,弃去最小值和最大值,计算细胞增殖指数。
3.细胞集落形成实验
细胞转染24 h后,接种在6孔板中,细胞密度500/孔,每组设置3个复孔。细胞培养14 d,每3 d更换培养基。细胞固定后采用结晶紫染色,并用Image J软件计算克隆形成数量。
4. RNA分离和RT-qPCR
按照TRIzol法提取细胞总RNA,采用紫外分光光度计NANODROP ONE检测RNA的浓度和纯度。接下来,根据反转录试剂盒说明书,将RNA逆转录成模板DNA(cDNA);再根据实时荧光定量PCR试剂盒说明书,将cDNA进行RT-qPCR检测。2-ΔΔCt法计算目的 mRNA 相对表达量。
表1 目的基因的引物序列
基 因 引物序列
NOL9 正向 5′-ATCTGTCGTGTGACTTGCCTC-3′
反向 5′-AAAAATTCTGCATCGACCAACG-3′
GAPDH 正向 5′-ACAACTTTGGTATCGTGGAAGG-3′
反向 5′-GCCATCACGCCACAGTTTC-3′
5.蛋白免疫印迹法
采用蛋白免疫印迹法检测NOL9蛋白的表达,采用化学发光法检测试剂盒进行显影,以GAPDH为对照,计算各蛋白的相对表达量。
6.生物信息学分析
利用癌症基因组图谱(TCGA)数据分析HCC中NOL9 mRNA和启动子甲基化水平。使用UALCAN检测HCC中NOL9启动子甲基化水平[9]。探针(cg07997941)信息从MEXPRESS获得[10]。
四、统计学处理
统计学分析和图形绘制分别使用SPSS 26.0版软件、GraphPad Prism 8.0。正态分布资料以 表示,比较采用t检验;多组间比较采用单因素方差(One-way ANOVA)分析,进一步组间两两比较用LSD-t检验;癌旁组织与癌组织间比较用配对t检验。P < 0.05为差异有统计学意义。
结果
一、肝癌和癌旁组织中NOL9 mRNA以及蛋白相对表达量比较
收集7例肝癌患者手术切除的新鲜组织标本,通过RT-qPCR和蛋白免疫印迹检测NOL9在癌组织和癌旁组织中的表达情况。与癌旁组织相比,癌组织的NOL9 mRNA(t = 11.76,P < 0.001)和蛋白(t = 2.52,P = 0.045)相对表达量均明显上调。见图1A~C。
二、NOL9的敲低对HCCLM3和Huh7细胞集落形成的影响
转染后的RT-qPCR检测结果显示,在HCCLM3细胞中,与si-nc组细胞相比,si-NOL9#1(t = 9.37,P < 0.001)和si-NOL9#2(t = 9.54,P < 0.001)组细胞的NOL9 mRNA和蛋白相对表达均明显下调;在Huh7细胞中,与si-nc组细胞相比,si-NOL9#1(t = 7.72,P < 0.001)和si-NOL9#2(t =
9.84,P < 0.001)组细胞的NOL9 mRNA和蛋白相对表达均明显下调。见图2A~C。
平板克隆形成实验结果显示,在HCCLM3中,si-NOL9#1组(t = 13.18,P < 0.001)和si-NOL9#2组(t = 14.79,P < 0.001)集落数均少于si-nc组;在Huh7中,si-NOL9 #1组(t = 6.59,P < 0.001)和si-NOL9#2组(t = 8.40,P < 0.001)集落数也均少于si-nc组。见图2D、E。
三、NOL9的敲低对HCCLM3和Huh7细胞增殖的影响
CCK-8结果显示,在HCCLM3细胞中,48 h
后,si-NOL9#1组(t = 7.34,P < 0.001)和si-NOL9#2组(t = 15.00,P < 0.001)细胞活力均低于si-nc组;72 h后,si-NOL #1组(t = 18.72,P < 0.001)和si-NOL9#2组(t = 29.47,P < 0.001)細胞活力仍低于si-nc组。在Huh7细胞中,48 h后,si-NOL9#1组(t = 13.64,P < 0.001)和si-NOL9#2组(t = 11.02,P < 0.001)细胞活力均低于si-nc组;72 h后,si-NOL9#1组(t = 12.74,P < 0.001)和si-NOL9#2组(t = 12.40,P < 0.001)细胞活力仍低于si-nc组。见图3A、B。
四、NOL9启动子甲基化水平
生物信息学分析表明,肝癌中NOL9 mRNA水平与一个CpG区域(cg07997941)呈负相关(R =
-0.25,P < 0.001)。此外,在肝癌中NOL9的表达上调,而其启动子甲基化水平下调(P均 < 0.001),见图4A~C。NOL9与TET1(R = 0.35,P < 0.001)、TET2(R = 0.52,P < 0.001)和TET3(R =
0.50,P < 0.001)的转录水平均呈正相关。见图4D~F。
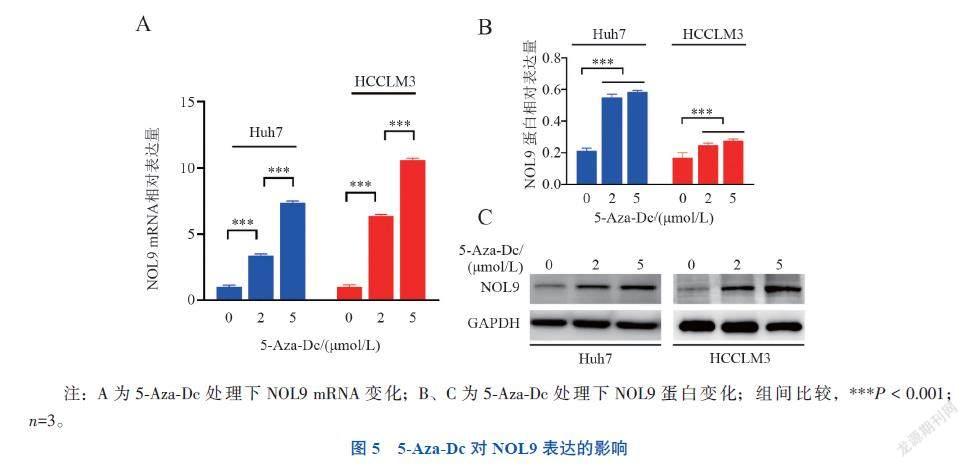
五、5-Aza-Dc对NOL9表达的影响
在给予不同浓度DNA去甲基化试剂5-Aza-Dc处理后,通过RT-qPCR检测,NOL9 mRNA水平呈浓度依赖性上调(P均 < 0.001),见图5A。蛋白免疫印迹法检测显示,不同浓度5-Aza-Dc处理后,NOL9蛋白表达上调(P均 < 0.001)。见图5B、C。
六、5-Aza-Dc对NOL9敲低细胞增殖的影响
CCK8实验结果显示,DNA去甲基化试剂5-Aza-Dc能逆转NOL9敲低对HCCLM3和Huh7细胞增殖的抑制作用(P均 < 0.001)。见图6。
讨论
由于高复发、高转移、预后差及5年生存率低,肝癌发生、发展的分子调控机制仍需进一步深入研究。在本研究中,我们揭示了NOL9在肝癌中表达上调,NOL9的敲低抑制细胞增殖和克隆形成,并证实了启动子低甲基化促进NOL9的表达。
众所周知,表观遗传修饰在基因表达的转录调控中起着关键作用,如乙酰化、甲基化、磷酸化以及泛素化等,其中DNA启动子甲基化水平与基因转录活性密切相关。表观遗传修饰通过对基因表达的精细调节参与调控许多关键的生物学过程,如细胞分化和胚胎发生。同时,许多研究表明表观遗传修饰在癌症相关基因动态转录调节中发挥重要作用[11]。TET蛋白家族可将5-甲基胞嘧啶转化为5-羟甲基胞嘧啶,该过程是DNA去甲基化的1个必要阶段[12]。已有研究表明,TET蛋白家族对癌基因或抑癌基因启动子甲基化的调控是肝癌进展中关键的表观遗传修饰因子[13-14]。本研究显示,在肝癌中NOL9启动子甲基化降低,而NOL9 mRNA表达被上调。此外,我们还观察到在肝癌中NOL9 与TET1、TET2及TET3在转录水平呈正相关。同时,体外实验进一步验证DNA甲基化在NOL9表达调控中的作用,我们用DNA去甲基化试剂5-Aza-Dc处理肝癌细胞,然后检测NOL9的表达。结果显示,5-Aza-Dc处理后NOL9的mRNA和蛋白表达明显上调。以上结果说明,NOL9启动子低甲基化可能是肝癌细胞系和肝癌组织中NOL9表达增加的关键因素。与此同时,本研究通过体外实验初步探讨了NOL9在肝癌中的作用。本研究首先将NOL9的siRNA转染至HCCLM3和Huh7细胞,通过调节NOL9的表达水平,利用集落形成实验及CCK-8观察细胞生长的变化。转染NOL9后细胞生长受到抑制。这说明NOL9可能通过促进肝癌细胞生长,在肝癌发生、发展中发挥癌基因的作用。接着在转染的细胞中加入5-Aza-Dc,细胞的增殖能力较未加入5-Aza-Dc升高,进一步证明对癌基因NOL9的去甲基化修饰促进肝癌细胞的生长,这与既往研究结论一致。因此,NOL9异常甲基化可用于肝癌细胞增殖的预测因子。
本研究有三点不足:①组织样本量不够大;②未进一步探究NOL9启动子甲基化的调控机制;③未通过动物模型对NOL9在肝癌发生、发展中的作用进行体内研究。后续相关实验验证将进一步阐明。
综上所述,NOL9作为癌基因促进肿瘤细胞增殖,其表达上调与启动子低甲基化有关。
参 考 文 献
[1] Sung H, Ferlay J, Siegel R L, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin,2021,71(3):209-249.
[2] Frottin F, Schueder F, Tiwary S, et al. The nucleolus functions as a phase-separated protein quality control compartment.Science,2019,365(6451):342-347.
[3] Hong J, Lee J H, Chung I K. Telomerase activates transcription of cyclin D1 gene through an interaction with NOL1. J Cell Sci,2016,129(8):1566-1579.
[4] Gu S, Hou P, Liu K, et al. NOL8, the binding protein for beta-catenin, promoted the growth and migration of prostate cancer cells. Chem Biol Interact,2018,294:40-47.
[5] Chen P, Yang Y, Zhang Y, et al. Identification of prognostic immune-related genes in the tumor microenvironment of endometrial cancer. Aging (Albany NY),2020,12(4):3371-3387.
[6] Liang J, Sun W, Song H, et al. NOL6 promotes the proliferation and migration of endometrial cancer cells by regulating TWIST1 expression. Epigenomics,2021,13(19):1571-1585.
[7] Weeks S E, Kammerud S C, Metge B J, et al. Inhibiting β-catenin disables nucleolar functions in triple-negative breast cancer. Cell Death Dis,2021,12(3):242.
[8] Han Y, Hu A, Qu Y, et al. Covalent targeting the LAS1-NOL9 axis for selective treatment in NPM1 mutant acute myeloid leukemia. Pharmacol Res,2023,189:106700.
[9] Chandrashekar D S, Bashel B, Balasubramanya S A H, et al.
UALCAN: a portal for facilitating tumor subgroup gene expression and survival analyses. Neoplasia, 2017, 19(8):649-658.
[10] Koch A, Jeschke J, Van Criekinge W, et al. MEXPRESS update 2019. Nucleic Acids Res,2019,47(1):W561-W565.
[11] Hanahan D. Hallmarks of cancer: new dimensions. Cancer Discov, 2022, 12(1):31-46.
[12] 石佳,匡野,宋杰. TET蛋白、TDG介導的DNA主动去甲基化的研究进展.新医学,2016,47(9):581-585.
[13] Dong Z R, Ke A W, Li T, et al. CircMEMO1 modulates the promoter methylation and expression of TCF21 to regulate hepatocellular carcinoma progression and sorafenib treatment sensitivity. Mol Cancer,2021,20(1):75.
[14] Cao L Q, Yang X W, Chen Y B, et al. Exosomal miR-21 regulates the TETs/PTENp1/PTEN pathway to promote hepatocellular carcinoma growth. Mol Cancer,2019,18(1):148.
(收稿日期:2022-11-25)
(本文编辑:杨江瑜)
