不同地点和复垦方式煤矸石山土壤中丛枝菌根真菌群落变化*
2023-04-26叶诚诚张永芳霍丽娟苏世鸣
李 侠,叶诚诚,张永芳,张 巽,霍丽娟,苏世鸣
不同地点和复垦方式煤矸石山土壤中丛枝菌根真菌群落变化*
李 侠1,叶诚诚2**,张永芳1,张 巽1,霍丽娟3,苏世鸣4
(1.山西大同大学农学与生命科学学院,大同 037009;2.温州市优质农产品开发服务中心,温州 325000;3.太原科技大学环境科学与工程学院,太原 030024;4.中国农业科学院农业环境与可持续发展研究所/农业农村部农业环境重点实验室,北京 100081)
以山西省大同市晋华宫人工复垦和自然恢复煤矸石山以及忻州窑自然恢复煤矸石山为研究对象,采用Illumina MiSeq高通量测序技术对三座煤矸石山土壤AM真菌群落组成进行分析,并测定其土壤理化性质,以探究不同地点煤矸石山不同复垦方式下土壤中丛枝菌根真菌(Arbuscular mycorrhizal fungi, AM真菌)群落组成的差异及其土壤影响因子。结果表明:晋华宫人工复垦煤矸石山和忻州窑自然恢复煤矸石山AM真菌多样性指数(Chao指数和香农−威纳指数)存在显著差异,但晋华宫人工复垦和自然恢复煤矸石山AM真菌群落的多样性指数差异不显著。试验共检测到67个AM真菌OTUs,可鉴定到3个AM真菌属级分类单元,其中球囊霉属()在晋华宫人工复垦煤矸石山、晋华宫自然恢复煤矸石山和忻州窑自然恢复煤矸石山中均为最优势菌,多样孢囊霉属()、类球囊霉属()仅出现在晋华宫自然恢复煤矸石山。多元置换方差分析和多维尺度分析结果表明,晋华宫两种恢复方式的煤矸石山之间AM真菌群落组成差异不显著,而晋华宫与忻州窑两个地点的煤矸石山AM真菌群落组成差异显著。AM真菌群落差异与土壤全氮、有机碳含量和AM真菌孢子密度相关。综上,晋华宫人工复垦(10~20a)煤矸石山土壤AM真菌群落可达到与自然恢复(50~60a)煤矸石山较为一致的效果。两个地点煤矸石山土壤AM真菌群落差异较大,土壤全氮、有机碳含量和AM真菌孢子密度是驱动AM真菌群落组成差异的主要因子。
煤矸石山;丛枝菌根真菌群落;球囊霉属;Illumina MiSeq高通量测序
煤矸石山由开采、洗选和利用煤炭的过程中产生的废弃煤矸石堆积而成[1],是煤炭生产过程中的必然产物,也是矿区的主要污染源之一。在矿山开采过程中,几乎所有的开采活动都超过了生态系统的自我恢复能力,依靠自身恢复是一个缓慢的过程,最少需要50~100a[2]。国内外有不少关于煤矿区土地复垦和生态重建的研究,植被重建被认为是修复矿区生态破坏与环境污染最经济有效的途径,也是目前国内外主要采取的措施[3−4]。然而煤矸石风化物颗粒粗、结构差,水分和养分含量少,微生物区系稀少且活性低及重金属含量高等严重制约了煤矸石山植被的恢复[5]。
土壤微生物具有丰度高、种类多、代谢快等特征,是土壤生态系统中重要的组成部分,在调节养分循环和稳定生态系统等方面发挥着十分重要的作用[6]。丛枝菌根真菌(Arbuscular mycorrhiza fungi,AM真菌)是一种广泛分布于陆地生态系统的土壤微生物,可以与大多数陆生植物共生[7]。AM真菌一方面侵染植物根系,另一方面可以延伸到土壤中,其庞大的根外菌丝网络极大地扩展了根系范围,吸收土壤中水分以及氮、磷等矿质元素,改善宿主植物水分和营养状况,促进植物生长[8],AM真菌还通过对土壤重金属的固定、隔离以及增加植物耐受性等方式提高植物抵抗重金属的能力[9]。AM真菌与植物这种互惠互利的共生关系,有利于克服煤矸石山生态重建中养分含量低、干旱、重金属含量高等逆境的潜力[10−11]。另外,AM真菌还可以通过分泌球囊霉素相关蛋白,以及菌丝的物理缠绕等方式促进土壤团聚体的形成,改良土壤结构[12],因此,在生态系统恢复初期,菌根植物常作为先锋植物在这些极端环境中优先生存下来。牛天心[13]对补连塔煤矿采陷区植物进行研究发现,在所调查的20种植物中,菌根植物共有16种,且共分离鉴定出AM真菌13种。近年来,人工扩繁的AM真菌菌剂也常被应用到退化生态系统和污染环境的生态恢复中,毕银丽等[1]在煤矸石山复垦区接种AM真菌13个月后发现,煤矸石山植被的成活率提高了15%。这些研究表明AM真菌对煤矿区生态环境恢复起重要的推动作用。
在生态系统中,植物群落演替、人类活动和环境条件变化会引发AMF真菌多样性和群落组成的时空变化[14−16]。植物、土壤和AM真菌及其相互关系在受干扰土壤生态系统功能恢复过程中起着重要作用[17],以往关于采煤区生态恢复的研究主要集中在植物群落的演替变化和重建过程中,而稳定的AM真菌群落组成对于提高生态系统生产力、维持生态平衡同样至关重要[18],其受植被、土壤、人为干扰、气候和地理距离等生物和非生物因子的影响[19]。山西省煤矿资源十分丰富,是闻名全国的“煤都”。但在过去长期的开采过程中,矿区生态被严重破坏,水土流失严重。近些年,对一些煤矸石山采取了人工修复和治理,植被生长和覆盖状况得到了很大改善。李侠等[20]研究发现短期人工修复(10~20a)的煤矸石山尽管植被种类远少于长期自然恢复(50~60a)的煤矸石山,但植被盖度两者无显著差异,甚至植被密度还高于长期自然恢复的煤矸石山,而不同地点的煤矸石山即使恢复年限较一致,但植物群落差异却较大。然而关于不同地点和恢复方式煤矸石山土壤中AM真菌群落的研究却少有报道。探明这些煤矸石山土壤中AM真菌群落组成状况及土壤驱动因子可为有效利用植物和AM菌种资源、合理制定煤矸石山修复方案提供重要的理论和实践指导意义。
1 材料与方法
1.1 研究区概况
研究样地大同市晋华宫矿位于山西省北部,地处N40°6’, E113°8’;忻州窑矿位于山西省北中部,地处N38°25’, E112°43’;两个矿均属温带大陆性半干旱季风气候,年均降水量约为400mm。晋华宫矿的煤矸石山分别为人工复垦和自然恢复样地,忻州窑矿的煤矸石山为自然恢复样地。晋华宫人工复垦煤矸石山采用覆土约20cm、人工种植紫苜蓿进行修复,取样时主要植被为中华草沙蚕、猪毛菜和紫苜蓿;晋华宫自然恢复煤矸石山未进行人为修复,取样时主要植被为中华草沙蚕、铁杆蒿和鹅绒藤;忻州窑自然恢复煤矸石山也未进行人为修复,取样时主要植物为菊叶香藜、独行菜和牛筋草[20]。
1.2 土壤样品采集
2016年6月,从大同市晋华宫人工复垦煤矸石山(排矸年龄10~20a,用JH-AR表示)、晋华宫自然恢复煤矸石山(排矸年龄50~60a,用JH-NR表示)、忻州窑自然恢复煤矸石山(排矸年龄50~60a,用XY-NR表示)三座煤矸石山上各选取三个样方。去除样方表面的杂草植被(约2cm的表层土),按五点法采集5个15cm×15cm×10cm的次样方,并将5个次样方的土壤充分混匀作为一个待测土壤样品。每个待测土壤样品分装成两部分,一部分新鲜土壤放置于−80℃保存,用于土壤DNA的提取;余下土壤样品自然风干后用于AM真菌孢子密度和土壤理化性质的测定。
1.3 项目测定
1.3.1 土壤AM真菌孢子密度
取风干土壤样品10g于2L的烧杯中,加水充分搅拌1min,使孢子脱落。土壤悬浊液双层筛(上筛20目,下筛400目)过滤,将400目下筛中的物质水洗转入50mL的大离心管4000r离心3min。倒掉上清液,加入60%的蔗糖溶液,再次离心(3000r,2min),将上清液倒入400目的筛子用水清洗,然后转至培养皿中在显微镜下观察并分格计数。
1.3.2 土壤理化性质测定
分别对风干土壤样品中速效磷、有机碳、全氮、pH值、EC等指标进行测定[21]。
1.4 土壤AM真菌多样性测定
1.4.1 土壤DNA的提取
取0.5g新鲜土壤样品采用E.Z.N.A.® soil DNA kit (Omega Bio-tek, Norcross, GA, U.S.) 试剂盒提取土壤基因组DNA,用1%琼脂糖凝胶电泳检测提取的DNA质量,并用NanoDrop2000检测DNA浓度和纯度。
1.4.2 PCR扩增与产物的纯化
使用AML1F(5’-ATCAACTTTCGATGGT-AGGATA GA-3’)-AML2R(5’-GAACCCAAACACTT- TGGTTTCC-3’) 引物进行第一轮PCR,扩增长度大约为795bp 的18S rRNA片段[22]。PCR反应体系按照TransStart®Fastpfu DNA Polymerase (AP221-02) 的说明书配置,每个样品重复3次。每个反应体系中加入1μL DNA模板,轻敲混匀后放入PCR仪(ABI GeneAmp® 9700)中,反应条件设置为,95℃初始变性3min;95℃变性30s,55℃退火30s,72℃延伸45s,共进行32个循环,然后72℃保温10min。第一次PCR产物稀释10倍作为第二次PCR反应的模板。第二次 PCR 使用的引物是加入带有barcode的AMV4.5NF(5’-AAGCTCGTAGTTGAATTTCG-3’)-AMDGR(5’-CCCAACTATCCCTATTAATCAT-3’),扩增长度约为300bp的18S rRNA片段[23],体系和反应条件与第一次PCR反应一致(循环数为30)。将同一样品的PCR产物混匀后用2%琼脂糖凝胶电泳进行检测,然后用AxyPrep DNA凝胶回收试剂盒切胶回收,并用Tris-HCl进行洗脱;之后用2%琼脂糖电泳检测。
1.4.3 MiSeq高通量测序
参照电泳的初步定量结果,将PCR产物用QuantiFluor™ -ST蓝色荧光定量系统进行检测定量,随后根据每个样本的测序量要求,进行相应比例混合。将相应比例混合的PCR产物交予相关生物公司进行Illumina MiSeq高通量测序。
1.4.4 序列处理
Illumina MiSeq高通量测序测得的原始数据使用Quantitative Insights Into Microbial Ecology(QIIME)进行筛选和优化序列。仅包含有完整的barcode和正向引物、质量得分≥25以及长度在200~300bp(不包括条形码和引物序列)的序列。使用Usearch v7.1优化序列,修剪后的序列依据97%的相似度划分OTUs。删除序列数低于5的OTUs,从每个OTUs中选择数量最多的序列作为代表序列。之后将物种代表序列与Maarj AM数据库(www.maarjam.botany. ut.ee)进行比对注释。原始数据提交到国际基因库GenBank保存,序列号为PRJNA818836。
1.5 数据分析
采用单因素方差分析检验不同煤矸石山土壤AM真菌多样性指数、属级分类单位的相对丰度和孢子密度的差异,采用Duncan多重比较检验不同煤矸石山差异的显著性水平。采用皮尔森(Pearson)相关分析检验AM真菌多样性指数、群落各属、孢子密度和土壤理化性质两两之间的相关性。以上分析在SPSS(22.0)中进行。
利用R(4.0.2),使用多维尺度分析(Nonmetric multidimensional scaling, NMDS)基于Bray-Curtis 距离算法分析不同煤矸石山AM真菌群落组成的差异,采用置换多元方差分析(Permutational multivariate analysis of variance)检验不同煤矸石山土壤AM真菌群落组成的差异性。
2 结果与分析
2.1 不同地点和复垦方式煤矸石山土壤AM真菌多样性指数对比
由表1可知,AM真菌测序的覆盖率均达到了99.99%以上,表明测序结果能够很好地反映土壤AM真菌群落组成的真实情况。晋华宫人工复垦煤矸石山土壤AM真菌Chao指数和香农−威纳指数显著高于忻州窑自然恢复煤矸石山,两者与晋华宫自然恢复煤矸石山差异不显著;三座煤矸石山间土壤AM真菌覆盖率、Ace指数以及Simpson指数差异均不显著。
2.2 不同地点和复垦方式煤矸石山土壤AM真菌Illumina MiSeq序列对比
由图1可知,三座煤矸石山土壤样本中AM真菌的OTUs稀释曲线都达到了平台区,表明试验的测序量足以覆盖每个样方的AM真菌群落。在晋华宫人工复垦煤矸石山的三个样方(JH-AR1、JH-AR2、JH-AR3)中分别测得31659条、33913条和40388条属于AM真菌的有效序列,在97%的相似度下分别划分为39、38和28个OTUs;在晋华宫自然恢复煤矸石山的三个样方(JH-NR1、JH-NR2、JH-NR3)中分别测得34567条、39217条、43967条属于AM真菌的有效序列,在 97%的相似度下分别划分为40、31和13个OTUs;在忻州窑自然恢复煤矸石山的三个样方(XY-NR1、XY-NR2、XY-NR3)中分别测得35130条、38728条和40661条属于AM真菌的有效序列,在97%的相似度下分别划分为11、19和12个OTUs。
试验在97%序列相似度下共得到67个AM真菌OTUs,其中晋华宫人工复垦和自然恢复煤矸石山分别有52和50个AM真菌OTUs,忻州窑自然恢复煤矸石山有23个OTUs。三座煤矸石山共有OTUs为15个;晋华宫人工复垦和自然恢复两座煤矸石山共有的OTUs为38个,分别占两座煤矸石山总OTUs的73%和76%;晋华宫自然恢复煤矸石山和忻州窑自然恢复煤矸石山共有的OTUs为19个,晋华宫人工复垦煤矸石山和忻州窑自然恢复煤矸石山共有的OTUs为16个。晋华宫人工复垦煤矸石山、晋华宫自然恢复煤矸石山和忻州窑自然恢复煤矸石山特有的OTUs分别为11、10和3个(图2)。
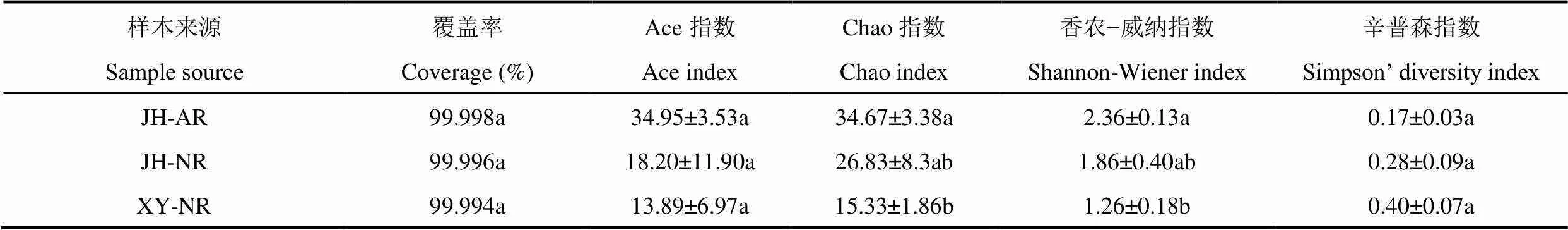
表1 不同煤矸石山土壤样本中AM真菌群落多样性指数的比较
注:数据为平均值±标准误(n=3)。同一列数据后不同小写字母表示三座煤矸石山之间差异显著(P<0.05)。JH-AR指晋华宫人工复垦煤矸石山,JH-NR指晋华宫自然恢复煤矸石山,XY-NR指忻州窑自然恢复煤矸石山。下同。
Note: Values are means ± stand error (n=3). Different lowercases in the same column represent significance among three different coal gangue hills according Duncan test following significant ANOVA (P<0.05). JH-AR is artificial restoration coal gangue hill of Jinhua palace in Datong city; JH-NR is natural restoration coal gangue hill of Jinhua palace in Datong city; XY-NR is natural restoration coal gangue hill of Xinzhou kiln. The same as below.
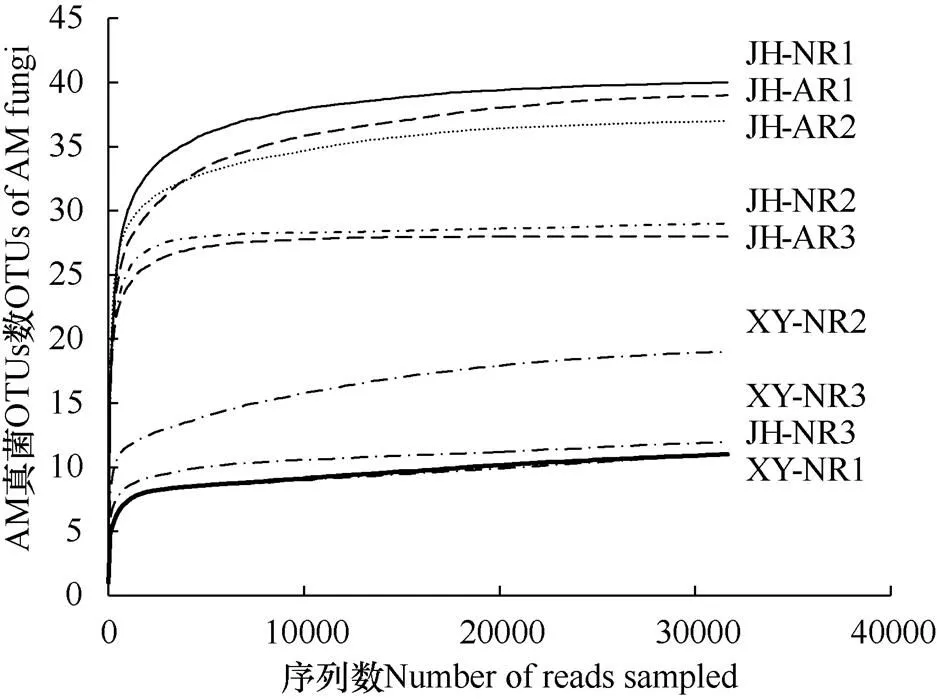
图1 不同煤矸石山土壤各平行样本中丛枝菌根真菌OTUs稀释曲线
注:JH-AR1、JH-AR2、JH-AR3分别为晋华宫人工复垦煤矸石山的三个平行样本;JH-NR1、JH-NR2、JH-NR3分别为晋华宫自然恢复煤矸石山的三个平行样本;XY-NR1、XY-NR2、XY-NR3分别为忻州窑自然恢复煤矸石山的三个平行样本。
Note: JH-AR1, JH-AR2, JH-AR3 are three parallel samples of artificial restoration coal gangue hill of Jinhua palace; JH-NR1, JH-NR2, JH-NR3 are three parallel samples of natural restoration coal gangue hill of Jinhua palace; JH-NR1, JH-NR2, JH-NR3 are three parallel samples of natural restoration coal gangue hill of Xinzhou kiln.
2.3 不同地点和复垦方式煤矸石山土壤AM真菌群落组成对比
试验共发现3个鉴定到属的AM真菌属级分类单元,包括球囊霉属()、多样孢囊霉属()和类球囊霉属(),不能分类到已知属名的OTUs被定义为Unknow。其中球囊霉属()在三座煤矸石山中均为最优势属。晋华宫人工复垦煤矸石山土壤中的球囊霉属()相对丰度显著高于忻州窑自然恢复煤矸石山,而晋华宫自然恢复煤矸石山土壤中的球囊霉属()相对丰度与前两者无显著差异;多样孢囊霉属()和类球囊霉属()仅在晋华宫自然恢复煤矸石山土壤中鉴定到(表2)。
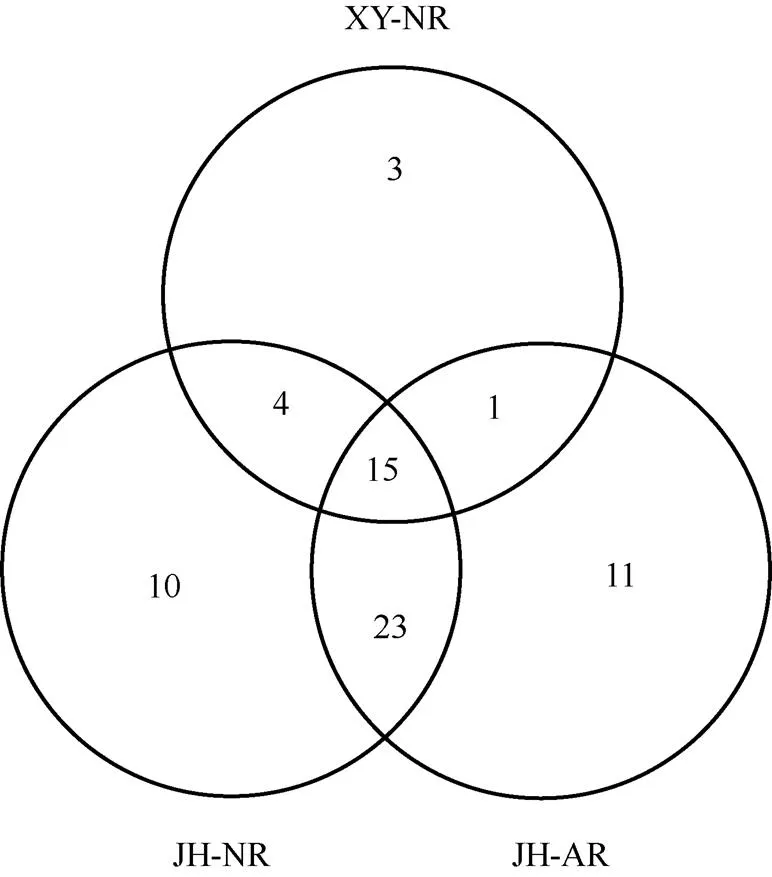
图2 不同地点煤矸石山土壤样本中AM真菌OTUs韦恩图
2.4 不同地点和复垦方式煤矸石山土壤AM真菌孢子密度对比
孢子作为真菌的一种重要繁殖体,其在土壤中的丰度常用孢子密度来反映,本试验中AM真菌孢子密度用每10g土壤中含有的孢子个数来表示。不同地点煤矸石山土壤样本中的AM真菌孢子密度差异显著,晋华宫人工复垦煤矸石山土壤的AM真菌孢子密度显著高于忻州窑自然恢复煤矸石山,晋华宫自然恢复煤矸石山土壤AM真菌孢子密度与其余两座煤矸石山差异不显著(图3)。

表2 不同煤矸石山土壤样本中AM真菌各属相对丰度
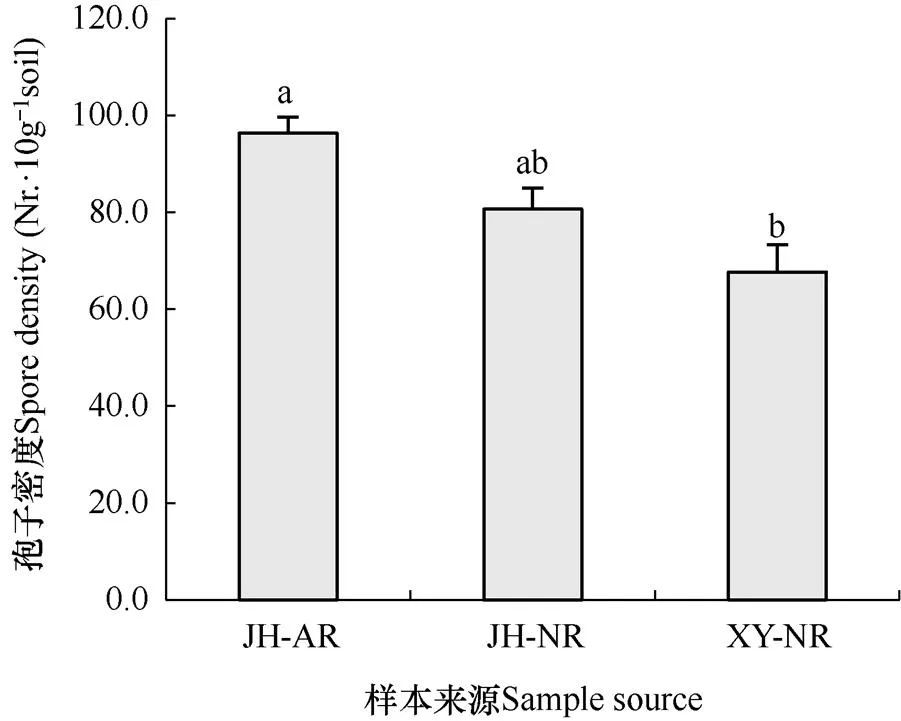
图3 不同煤矸石山土壤样本中AM真菌孢子密度
2.5 不同地点和复垦方式煤矸石山土壤环境因子影响对比
2.5.1 影响土壤AM真菌群落组成差异的因子分析
AM真菌群落的多维尺度分析(NMDS)和多元置换方差分析(PERMANOVA)结果表明,晋华宫两种恢复方式煤矸石山之间土壤AM真菌群落没有明显分开,差异也不显著;而两者与忻州窑煤矸石山之间土壤AM真菌群落明显分开,差异达到显著水平(R2=0.23,P=0.04)。土壤全氮(R2=0.63,P=0.045)、土壤有机碳(R2=0.75,P=0.009)和AM真菌孢子密度(R2=0.75,P=0.016)与煤矸石AM真菌群落组成显著相关(图4)。
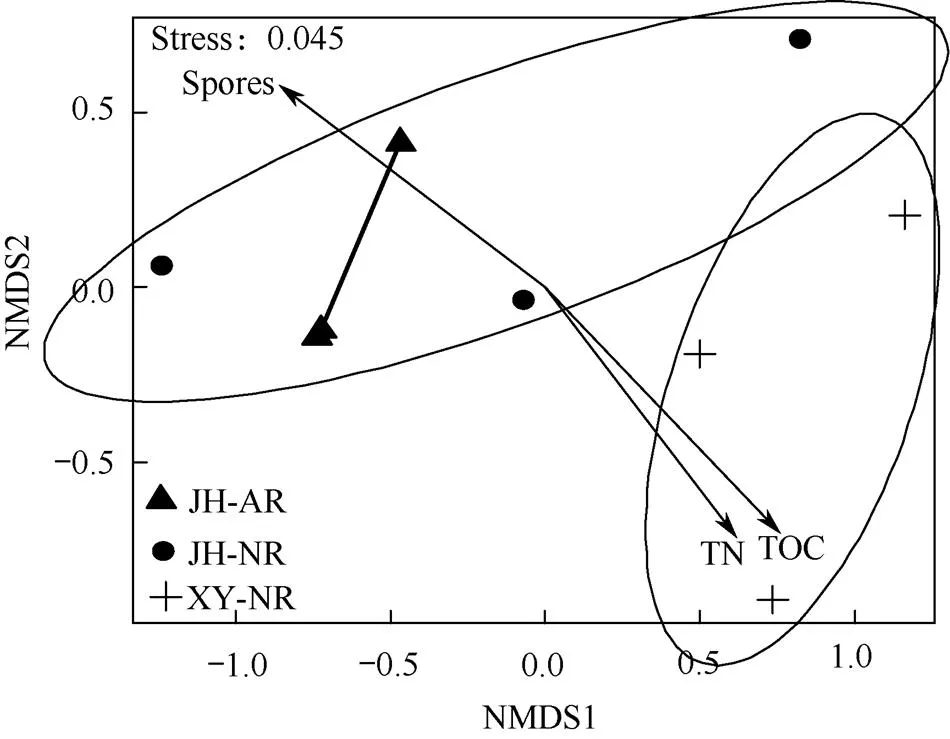
图4 不同煤矸石山土壤样本中AM真菌群落NMDS分布
注:椭圆代表不同煤矸石山土壤样本中AM真菌群落95%置信区间水平下的变异。TN表示全氮,TOC表示有机碳,Spores表示AM真菌孢子密度。
Note:Ellipses in the plots represent 95% confidence intervals around AM fungi community in different coal gangue hills.TN represents total nitrogen, TOC represents total organic carbon, Spores represent spore density.
2.5.2 影响AM真菌多样性、各属水平的土壤理化性质分析
煤矸石山土壤中AM真菌多样性、各属水平与土壤理化性质各指标之间的皮尔森(Pearson)相关性分析结果如表3所示。由表可知,AM真菌多样性指数(覆盖率、Ace指数、Chao指数和香农−威纳指数)与土壤速效磷(仅Chao指数和香农−威纳指数)和AM真菌孢子密度呈显著正相关关系,与土壤全氮(仅覆盖率和香农−威纳指数)、有机碳(Ace指数除外)呈显著负相关关系。球囊霉属()与土壤速效磷和AM真菌孢子密度均呈显著正相关关系,多样孢囊霉属()和类球囊霉属()与土壤理化性质及AM真菌群落多样性指数之间均无显著相关关系。
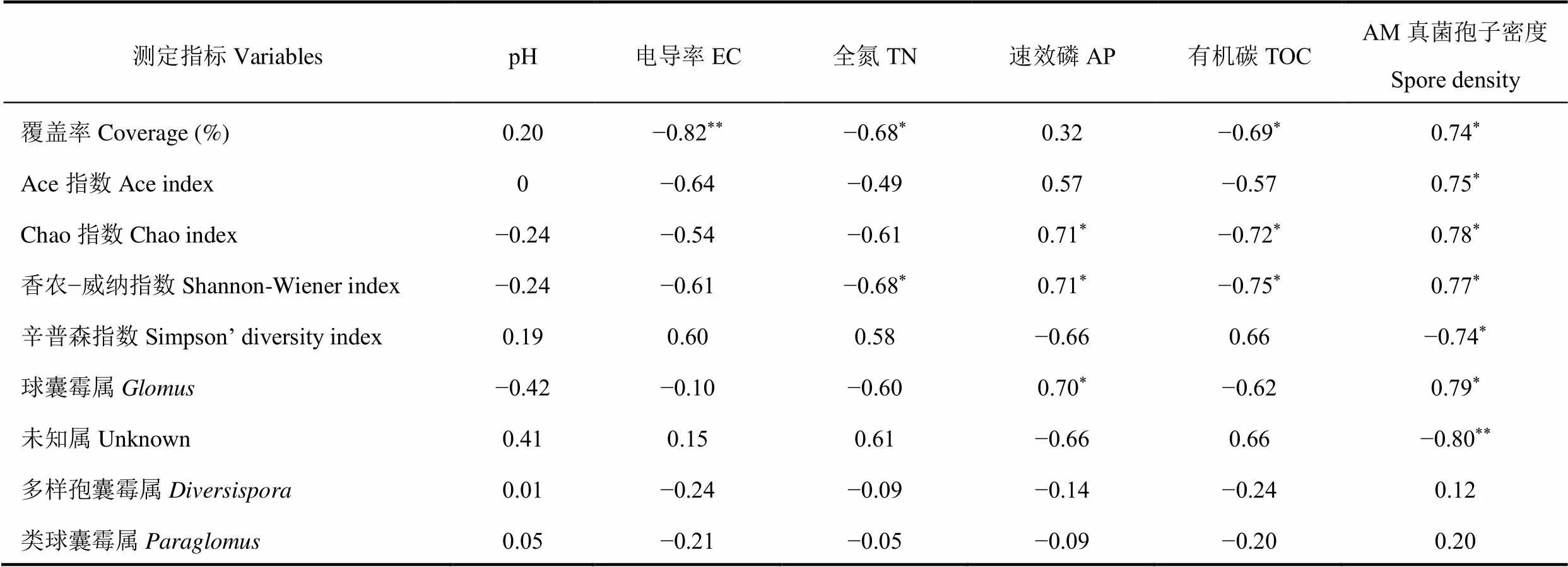
表3 不同煤矸石山土壤AM真菌多样性指数、各属水平及土壤理化性质指标之间相关性
注:*表示P≤0.05,**表示P≤0.01。
Note:*is P≤0.05,**is P≤0.01.
3 结论与讨论
3.1 讨论
无论采用传统的形态鉴定方法还是高通量测序技术研究都发现,球囊霉属()在大多数生态环境中其出现频率和相对丰度均为最高的AM真菌类群,为优势属[24−26]。本研究采用高通量测序技术,在调查的所有煤矸石山中,发现球囊霉属()相对丰度最高,为优势属。最近对晋华宫煤矸石山不同植物根际土壤AM真菌的研究也发现,球囊霉属()占据主导地位[26]。这些结果表明球囊霉属()具有广泛的环境适应性,这可能与球囊霉属()有较强的养分吸收能力、繁殖能力及侵染植物的能力有关[27]。
晋华宫人工复垦煤矸石山AM真菌仅鉴定出球囊霉属(),而自然恢复煤矸石山还鉴定出多样孢囊霉属(Diversispora)和类球囊霉属(Paraglomus),表明人工复垦方式由于修复年限较短,损失了一些稀有AM真菌属。Ezeokoli等[28]在采煤区根系和根际土壤中也发现了这两个AM真菌属,其相对丰度也较低,尽管不同复垦年限采煤区植物根际土壤AM真菌多样性无显著差异,而群落组成差异显著。然而,本研究中晋华宫两种恢复方式的煤矸石山之间AM真菌多样性和群落组成均无显著差异,且共有的AM真菌OTUs达到38个,占比较高,分别达到两座煤矸石山总OTUs的73%~76%,表明人工复垦10~20a煤矸石山土壤AM真菌群落可达到与自然恢复50~60a煤矸石山较为一致的效果。与本研究结果类似,侯湖平等[29]对徐州市不同复垦年限煤矸石山土壤细菌的研究发现,与未受煤矸石影响的对照土壤相比,复垦区土壤在各个分类水平上的细菌数量均减少,且群落多样性也降低;而随着复垦年限的增加,复垦区与对照土壤的贴近度越来越高。本课题组之前对煤矸石山植物群落的研究也发现,相比自然恢复50~60a的煤矸石山,尽管人工复垦10~20a煤矸石山植物种类较少,但两者植物群落差异不显著[20]。AM真菌是与植物共生的一种真菌,它只能利用宿主植物提供的碳,不能离体培养,其分布极大程度受植被类型的制约。Krüger等[17]在捷克采煤区的研究显示,相比非生物因素,AM真菌群落组成主要受植物群落影响。甄莉娜等[26]调查了大同市晋华宫矿煤矸石山区禾本科、菊科、豆科和藜科植物根际土壤的AM真菌多样性,发现禾本科和藜科根际AM真菌OTUs数量较多,而豆科和菊科根际AM真菌OTUs数较少;禾本科根际AM真菌Shannon指数和Chao1指数最高,多样性和丰富度最高。本研究中晋华宫两种恢复方式煤矸石山优势植物一致,均为禾本科中华草沙蚕,这可能是两座煤矸石山AM真菌群落差异不显著的原因。
一个地区的群落如何装配及哪些物种可以共存是生态学的中心问题。AM真菌的物种多样性及群落组成受多种生物和非生物因子如植被、土壤、人为干扰、气候和地理距离等的影响[19,30],但是它们的相对重要性极大地依赖于空间尺度,在不同尺度上,有不同的装配因子起作用。在较小的尺度上AM真菌群落主要是由植物种类决定,在较大尺度上AM真菌群落组成主要受空间距离、土壤、温度和植物群落类型等影响[15,31]。对全球1014个植物根部样品AM真菌空间分布格局的研究表明,空间距离是影响AM真菌群落组成的主要因素[15]。本研究中除晋华宫人工复垦煤矸石山AM真菌群落Chao指数、香农−威纳指数显著高于忻州窑自然恢复煤矸石山外,三座煤矸石山其余的AM真菌多样性指数间差异不显著,然而晋华宫两座煤矸石山与忻州窑自然恢复煤矸石山之间AM真菌群落明显分开,差异也达到显著水平,这表明相比AM真菌多样性,群落组成可能更敏感捕捉到环境的变化。另外,由于晋华宫自然恢复煤矸石山与忻州窑自然恢复煤矸石山恢复时间基本一致,表明空间距离可能对两座煤矸石山AM真菌群落组成产生重要影响。Jansa等[32]在瑞士农田土壤中发现,相比管理方式,土壤因子和空间距离是影响AM真菌群落主要因素,与本研究结果一致。空间距离较远的煤矸石山间由于各种气候条件等不同,导致其土壤因子、植被类型等有较大差异。之前研究发现晋华宫煤矸石山优势植物为中华草沙蚕,而忻州窑煤矸石山优势植物为菊叶香藜。另外,本研究发现土壤全氮、有机碳和AM真菌孢子密度是造成晋华宫和忻州窑两个地点煤矸石山AM真菌群落组成差异的主要驱动因子。李晓亮在西藏色季拉山研究发现海拔主要通过影响土壤pH和速效磷从而间接影响AM真菌多样性和群落组成;在森林、草地和农田土壤中发现,不同利用方式主要通过影响土壤pH从而影响AM真菌群落[25],本研究中,空间距离可能通过影响土壤全氮、有机碳和AM真菌孢子密度影响晋华宫和忻州窑两个地点煤矸石山AM真菌群落组成。
3.2 结论
在调查的所有煤矸石山中,球囊霉属()是相对丰度最高的AM真菌类群,为优势属。晋华宫人工复垦10~20a煤矸石山土壤AM真菌群落可达到与自然恢复50~60a煤矸石山较为一致的效果。晋华宫与忻州窑两个地点煤矸石山土壤AM真菌群落差异较大,土壤全氮、有机碳含量和AM真菌孢子密度是驱动AM真菌群落组成差异的主要因子。AM真菌作为生态系统重要的组成部分,其与植物、土壤环境变化息息相关,本研究结果表明AM真菌群落变化有潜力成为反映煤矸石山生态系统恢复力的一类生物指标。
[1] 毕银丽,吴王燕,刘银平.丛枝菌根在煤矸石山土地复垦中的应用[J].生态学报,2007,27(9):3738-3743.
Bi Y L,Wu W Y,Liu Y P.Application of arbuscular mycorrhizas in land reclamation of coal spoil heaps[J].Acta Ecologica Sinica,2007,27(9):3738-3743.(in Chinese)
[2] 魏远,顾红波,薛亮,等.矿山废弃地土地复垦与生态恢复研究进展[J].中国水土保持科学,2012,10(2):107-114.
Wei Y,Gu H B,Xue L,et al.Review of studies on reclamation and ecological restoration of abandoned land of mine[J]. Science of Soil and Water Conservation,2012,10(2):107- 114.(in Chinese)
[3] 张成梁.山西阳泉自然煤矸石山生境及植被构建技术研究[D].北京:北京林业大学,2008.
Zhang C L.The habitat and vegetation constructing for Spontaneous combustion gangue pile in Yangquan city, Shanxi province[D].Beijing:Beijing Forestry University, 2008.(in Chinese)
[4] Püschel D,Rydlová,Sudová R,et al.The potential of mycorrhizal inoculation and organic amendment to increase yields of Galegaorientalis and Helianthus tuberosus in a spoil-bank substrate[J].Journal of Plant Nutrition and Sol Science,2011,174(4):664-672.
[5] Sheoran V,Sheoran A S,Poonia P.Soil reclamation of abandoned mine land by revegetation a review[J]. International Journal of Soil,Sediment and Water,2010, 3(2):1-20.
[6] 岳衡,李闪闪,段雅欣,等.深松耕对宁南山区马铃薯田土壤细菌多样性的影响[J].中国农业气象,2021,42(12): 998-1008.
Yue H,Li S S,Duan Y X,et al.Effect of subsoil plowing on soil bacterial diversity in potato fields in mountainous areas of Southern Ningxia[J].Chinese Journal of Agrometeorology, 2021,42(12):998-1008.(in Chinese)
[7] Lanfranco L,Bonfante P,Genre A.The mutualistic interaction between plants and arbuscular mycorrhizal fungi[J]. Microbiology Spectrum,2016,4(6).
[8] Simard S W,Beiler K J,Bingham M A,et al.Mycorrhizal networks:mechanisms,ecology and modelling[J].Fungal Biology Reviews,2012, 26(1):39-60.
[9] 罗巧玉,王晓娟,林双双,等.AM真菌对重金属污染土壤生物修复的应用与机理[J].生态学报,2013,33(13):3898- 3906.
Luo Q Y,Wang X J,Lin S S,et al.Mechanism and application of bioremediation to heavy metal polluted soil using arbuscular mycorrhizal fungi[J].Acta Ecologica Sinica,2013,33(13):3898-3906.
[10] 毕银丽.丛枝菌根真菌在煤矿区沉陷地生态修复应用研究进展[J].菌物学报,2017,36(7):800-806.
Bi Y L.Research advance of application of arbuscular mycorrhizal fungi to ecological remediation in subsided land of coal mining areas[J].Mycosystema,2017,36(7): 800-806.(in Chinese)
[11] Omirou M,Ioannides M,Ehaliotis C.Mycorrhizal inoculation affects arbuscular mycorrhizal diversity in watermelon roots,but leads to improved colonization and plant response under water stress only[J].Applied Soil Ecology,2013, 63(1):112-119.
[12] Rillig M C,Mummey D L.Mycorrhizas and soil structure[J]. New Phytologist,2006,171(1):41-53.
[13] 牛天心.补连塔煤矿采陷区丛枝菌根真菌种类分布及土壤因子的研究[D].呼和浩特:内蒙古大学,2015.
Niu T X.The study on the distribution of AMF species and soil factors in mining subsidence area of bulianta coal mine[D].Hohhot:Inner Mongolia University,2015.(in Chinese)
[14] Cui X,Hu J,Wang J,et al.Reclamation negatively influences arbuscular mycorrhizal fungal community structure and diversity in coastal saline-alkaline land in Eastern China as revealed by Illumina sequencing[J].Applied Soil Ecology, 2016,98:140-149.
[15] Davison J,Moora M,Öpik M,et al.Global assessment of arbuscular mycorrhizal fungus diversity reveals very low endemism[J].Science,2015,349(6251):970-973.
[16] Roy J,Reichel R,Bruggemann N,et al.Succession of arbuscular mycorrhizal fungi along a 52-year agricultural recultivation chronosequence[J].FEMS Microbiology Ecology, 2017,93,fix102.
[17] Krüger C,Kohout P,Janoušková M,et al.Plant communities rather than soil properties structure arbuscular mycorrhizal fungal communities along primary succession on a mine spoil[J].Frontiers in Microbiology,2017(8):719.
[18] van der Heijden M G A,Klironomos J N,Ursic M,et al.Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity[J].Nature, 1998,396 (6706):69-72.
[19] 向丹,徐天乐,李欢,等.丛枝菌根真菌的生态分布及其影响因子研究进展[J].生态学报,2017,37(11):3597-3606.
Xiang D,Xu T L,Li H,et al.Ecological distribution of arbuscular mycorrhizal fungi and the influencing factors[J]. Acta Ecologica Sinica,2017,37(11):3597-3606.(in Chinese)
[20] 李侠,邵洋,王润梅,等.不同恢复方式煤矸石山植物群落差异及影响因子[J].土壤通报,2018,49(6):1370-1376.
Li X,Shao Y,Wang R M,et al.Plant community diversity and its impact factors in coal gangue hill under different restoration patterns[J].Chinese Journal of Soil Science, 2018,49(6):1370-1376.(in Chinese)
[21] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
Bao S D.Soil agro-chemistrical analysis[M].Beijing:China Agriculture Press,2000.(in Chinese)
[22] Lee J,Lee S,Young J P W.Improved PCR primers for the detection and identification of arbuscular mycorrhizal fungi[J].FEMS Microbiology Ecology,2008,65(2):339-349.
[23] Sato K,Suyama Y,Saito M,et al.A new primer for discrimination of arbuscular mycorrhizal fungi with polymerase chain reaction-denature gradient gel electrophoresis[J]. Grassland Science,2005,51(2):179-181.
[24] 王发园,刘润进,林先贵,等.几种生态环境中AM真菌多样性比较研究[J].生态学报,2003,23(12):2666-2671.
Wang F Y,Liu R J,Lin X G,et al.Comparison of diversity of arbuscular mycorrhizal fungi in different ecological environments[J].Acta Ecologica Sinica,2003,23(12):2666- 2671.(in Chinese)
[25] 李晓亮.藏东南地区海拔和土地利用方式对丛枝菌根真菌多样性和群落结构的影响[D].北京:中国农业大学,2015.
Li X L.Influence of elevation and land use types on diversity and community composition of arbuscular mycorrhizal fungi in southeast Tibet[D].Beijing:China Agricultural University,2015.(in Chinese)
[26] 甄莉娜,刘丽珍,牛艳,等.煤矸石山不同植物根际土壤AM真菌群落多样性分析[J].草地学报,2022,30(8):2009- 2018.
Zhen L N,Liu L Z,Niu Y,et al.Analysis of AM Fungi Community diversity in rhizosphere soil of different vegetation in Coal Gangue Mountain[J].Acta Agrestia Sinica, 2022,30(8):2009-2018.(in Chinese)
[27] Hassan S D,Boon E,St-Arnaud M.Molecular biodiversity of arbuscular mycorrhizal fungi in trace metal-polluted soils[J].Molecular Ecology,2011,16: 3469-83.
[28] Ezeokoli O T,Mashigo S K,Maboeta M S,et al.Arbuscular mycorrhizal fungal community differentiation along a post-coal mining reclamation chronosequence in South Africa:a potential indicator of ecosystem recovery[J]. Applied Soil Ecology,2020,147:103429.
[29] 侯湖平,王琛,李金融,等.煤矸石充填不同复垦年限土壤细菌群落结构及其酶活性[J].中国环境科学,2017,37(11): 4230-4240.
Hou H P,Wang C,Li J R,et al.Variation of bacterial community structure and enzyme activities in reclaimed soil filled with coal gangues along a relamation chronosequence[J].China Environmental Science,2017,37 (11):4230-4240.(in Chinese)
[30] 杨海水,熊艳琴,王琪,等.AM真菌物种多样性:生态功能、影响因素及维持机制[J].生态学报,2016,36(10):2826- 2832.
Yang H S,Xiong Y Q,Wang Q,et al.Arbuscular mycorrhizal fungal species diversity:ecological functioning, determinants and assembling mechanisms[J].Acta Ecologica Sinica, 2016,36(10):2826-2832.(in Chinese)
[31] Valyi K,Mardhiah U,Rillig M C,et al.Community assembly and coexistence in communities of arbuscular mycorrhizal fungi[J].The ISME Journal,2016,10(10):2341-2351.
[32] Jansa J,Erb A,Oberholzer H R,et al.Soil and geography are more important determinants of indigenous arbuscular mycorrhizal communities than management practices in Swiss agricultural soils[J].Molecular Ecology,2014,23(8): 2118-2135.
Community Response of Arbuscular Mycorrhizal Fungi to Restoration Managements and Sites in Coal Gangue Hills
LI Xia1, YE Cheng-cheng2, ZHANG Yong-fang1, ZHANG Xun1, HUO Li-juan3,SU Shi-ming4
(1.College of Agronomy and Life Science, Shanxi Datong University, Datong 037009, China; 2.Wenzhou Good Agri-Products Development Service Center, Wenzhou 325000; 3.School of Environmental Science and Engineering, Taiyuan University of Science andTechnology, Taiyuan 030024; 4.Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-Environment, Ministry of Agriculture and Rural, Beijing 100081)
Illumina MiSeq high-throughput sequencing approach was applied to investigate arbuscular mycorrhizal fungi (AM fungi) community and relevant soil factors were analyzed in coal gangue hills with different restoration patterns (i.e., artificial restoration and natural restoration coal gangue hill of Jinhua palace in Datong City; natural restoration coal gangue hill of Xinzhou kiln). The results showed: α-diversity (Chao index and Shannon-Weiner index) of AM fungi community differed significantly between artificial restoration coal gangue hill of Jinhua palace and natural restoration coal gangue hill of Xinzhou kiln, but comparable α-diversity was observed between artificial restoration and natural restoration coal gangue hill of Jinhua palace. A total of 67 AM fungal OTUs assigned to 3 genus were recovered withbeing the predominant genus in all three coal gangue hills, whileandpopulations were exclusive tonatural restoration coal gangue hill of Jinhua palace in Datong city. Integrated the permutational multivariate analysis and nonmetric multidimensional scaling analysis suggested that AM fungi community were similar between the two restorations of Jinhua palace coal gangue hill, while the community significantly differed between coal gangue hill of Jinhua palace and Xinzhou kiln. The AM fungal community appeared to significantly correlate with soil total nitrogen, soil organic matter and AM fungi spore density. In conclusion, artificial restoration for 10-20 years can exert a comparable effect on AM fungal community as natural restoration 50-60 years in coal gangue hill of Jinhua palace. AM fungal community of the two locations showed great variance, and soil total nitrogen, soil organic matter and soil AM fungi spore density were the main driving factors.
Coal gangue hill; Arbuscular mycorrhizal fungi community;; Illumina MiSeq high-throughput sequencing
10.3969/j.issn.1000-6362.2023.04.003
李侠,叶诚诚,张永芳,等.不同地点和复垦方式煤矸石山土壤中丛枝菌根真菌群落变化[J].中国农业气象,2023,44(4):285-294
2022−05−17
国家自然科学基金(41807130);山西省应用基础研究计划项目(201901D111306);大同市平城区重点研发计划项目(202003);大同市重点研发项目(2020044)
叶诚诚,农艺师,主要从事农产品加工与质量安全研究,E-mail:chchye@cau.edu.cn
李侠,E-mail:lixia810504@163.com
