基于线粒体控制区的海南岛3 种弹涂鱼的遗传多样性
2023-04-21柯宏基陈傅晓李向民樊佳伟王永波符书源
柯宏基,陈傅晓,李向民,樊佳伟,王永波,符书源,谭 围
(1.海南热带海洋学院/热带海洋生物资源利用与保护教育部重点实验室,海南 三亚 572022;2.海南省海洋与渔业科学院/海南省热带海水养殖工程技术研究中心,海口 571126)
弹涂鱼类栖息于海边滩涂处及红树林等区域[1],其肉质细嫩,味道鲜美,营养价值丰富[2],不仅有着较高的经济价值,作为沿海滩涂特色小型鱼类,还有着独特的生态研究价值。近年来由于海域环境的恶化,弹涂鱼的生存环境受到影响,资源数量下降,因此,保护弹涂鱼类资源势在必行。有关弹涂鱼类的群体研究一直是国内外研究热点,研究方法较多,如随机扩增多态性(RAPD)[3]、同工酶[4]、AFLP 技术[5]、线粒体基因片段[6]等,国外先后报道了银线弹涂鱼(Periophthalmus argentilineatus)、卡路弹涂鱼(Periophthalmus.kalolo)、澳氏弹涂鱼(Periophthalmus.waltoni)等鱼类的群体研究[7-8],国内研究对象主要集中在弹涂鱼(P.modestus)、大 弹 涂 鱼(Boleophthalmus pectinirostris)、大鳍弹涂鱼(P.magnuspinnatus)等[9-13]。大弹涂鱼因为其食用价值较高而倍受关注[14-16];大鳍弹涂鱼因体型外貌与弹涂鱼相似而常被误认为弹涂鱼[1]。近年来,线粒体基因应用范围越来越广泛,不仅在遗传多样性方面,也可应用于鉴别不同物种[17],王正琦等[18]通过cyt b基因序列建树区分出了大鳍弹涂鱼和弹涂鱼。线粒体控制区(Control Region,D-loop)是进化最快的部分,其基因变化速度比细胞核DNA 和其他细胞器的基因快5 倍。不同区段的进化速度不同,应用于不同级别的系统发育分析研究,是探讨近缘种间和种内遗传变异的良好指标[19-23],在弹涂鱼类研究上有了一定程度的应用。王丛涛[16]基于控制区研究我国大弹涂鱼群体,发现北海与其他群体存在分化,其余群体间基因交流频繁。张顺[9]基于Dloop对雷州半岛弹涂鱼类进行分析,结果表明,东西半岛的大弹涂鱼、弹涂鱼群体基因交流频繁,大鳍弹涂鱼基因交流少,存在遗传分化。国内关于海南岛弹涂鱼类的相关研究较少[11-12],目前还未见有关于利用线粒体控制区开展海南岛弹涂鱼类遗传多样性方面的研究报道。笔者以在海南岛采集到的弹涂鱼、大弹涂鱼和大鳍弹涂鱼为研究对象,通过D-loop标记,研究3 种弹涂鱼群体的遗传多样性程度、地理群体间遗传分化差异及种群历史动态,旨在为今后更好利用开发海南岛弹涂鱼资源及制定保护政策提供基础资料。
1 材料与方法
1.1 样 品来源及扩增测序2018-12-06—2019-10-16,分别在海口(HK)、文昌(WC)、澄迈(CM)、临高(LG)、儋州(DZ)、昌江(CJ)、东方(DF)、乐东(LD)、三亚(SY)野外人工捕捉弹涂鱼类群体(表1)。样本活体运输至海南省海洋与渔业科学院琼海科研基地,取背部肌肉组织,于75%的乙醇中保存 24 h,更换为 95%乙醇保存 24 h,最后于无水乙醇中常温保存。采用TAKARA DNA 提取试剂盒提取 DNA。DNA 样品经 1%的琼脂糖凝胶电泳检测后,保存于-20 ℃冰箱中备用。线粒体控制区基因扩增所用引物序列[9],DloopF1:5′-AGC TCCCAAAGCTAGC ATTCT-3′;D-loopR1:5′-TTTCTAGGGCCCATCTTAACA-3′。扩增程序为:94 ℃预变性 3 min;94 ℃变性 30 s、58 ℃退火 30 s、72 ℃延伸 2 min,35 个循环;72 ℃延伸 10 min。PCR 产物经电泳检测后,送至广州艾基生物技术有限公司进行双向测序。
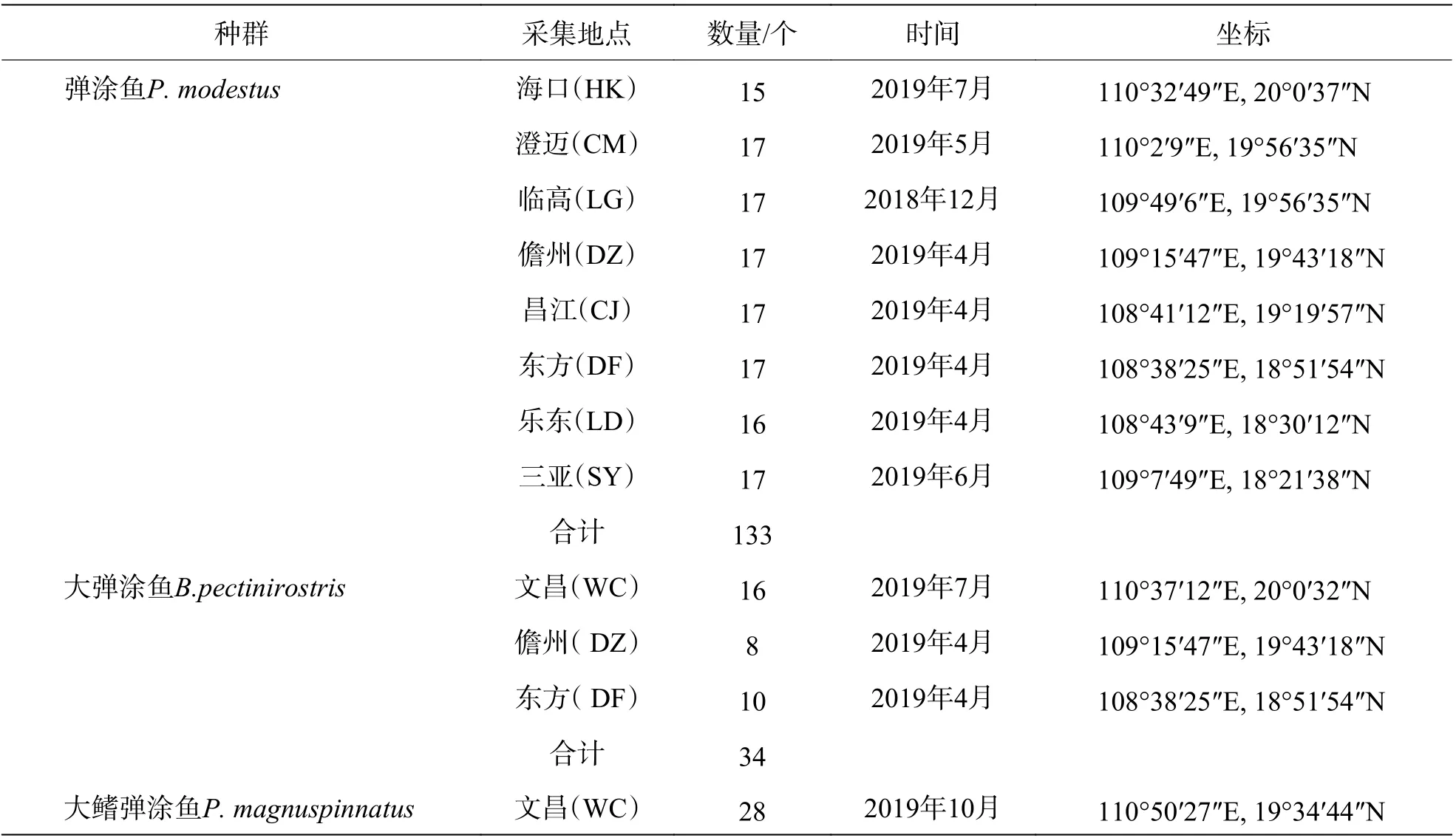
表1 3 种弹涂鱼采样情况
1.2 数据分析测序完成后,用SeqMan 拼装校对线粒体控制区基因序列。通过 MEGA7.0 软件对测序结果进行比对分析。采用软件DNASP6.0计算序列变异位点数、单倍型数目、单倍型多样性和核苷酸多样性等遗传参数;利用MEGA7.0 软件分析序列的碱基组成,基于Kimura 2-parameter 模型计算群体内及群体间的遗传距离,采用邻接法(Neighbor-Joining,NJ)构建弹涂鱼序列邻接关系进化树[24],节点支持率采用 Bootstrap 1 000 次重复检验置信度;利用 Arlequin3.11 软件计算两两群体间的遗传分化指数(Fst) ,并进行分子方差分析(Analysis of molecular variance,AMOVA),用于遗传变异和地理结构特点研究;使用核苷酸不配对分析( mismatch distribution) 和中性检验( neutrality tests) 来检测海南弹涂鱼的种群历史动态,利用Network5.0 软件构建单倍型网络图,分析单倍型之间的进化关系。种群扩张时间(T)利用公式τ=2ut进行估算。式中t表示种群扩张至今所经历的代数;T=t×代时,代时为研究对象的生殖周期;τ为扩张时间参数;u=μk,μ为线粒体控制区基因变异速率,k表示序列长度。
2 结果与分析
2.1 序列分析本研究获得的D-loop基因片段长度为836 bp,总变异位点244 个。共获得195个弹涂鱼类目的基因片段,即弹涂鱼133 个、大弹涂鱼34 个、大鳍弹涂鱼28 个。分析结果表明,弹涂鱼序列组成显示平均 A、T、G、C 碱基含量分别为 30.8%、33.3%、22.8%、14.1%,A+T(64.1%)含量高于G+C(36.9%)的含量。共检测到125 个单倍型,发现134 个变异位点(占总位点数的16.0%),其中50 个为单变异位点,而另外84 个为简约信息位点。大弹涂鱼序列组成显示平均 A、T、G、C 碱基含量分别为31.1%、34.3%、21.6%、13.0%,A+T(65.4%)含量高于G+C(34.6%)的含量。共检测到28 个单倍型,发现58 个变异位点(占总位点数的6.9%),其中36 个为单变异位点,而另外22 个为简约信息位点。大鳍弹涂鱼序列组成显示平均 A、T、G、C 碱基含量分别为31.9%、34.3%、20.7%、13.1%,A+T(66.2%)含量高于G+C(33.8%)的含量,共检测到21 个单倍型,发现52 个变异位点(占总位点数的6.2%),17 个为单变异位点,而另外35 个为简约信息位点。
2.2 遗传多样性3 种弹涂鱼的相关多样性数据见表2。弹涂鱼群体单倍型多样性在0.992~1.000 之间,核苷酸多样性在0.014 09~0.023 84之间。平均核苷酸差异数为11.184~18.831,其在LG 群体中最多为18.831 个,在SY 群体中最少为11.184 个。总体单倍型多样性为0.998 7,由单倍型参数可知,HK、CM、LG、DZ、CJ、DF 6 个群体单倍型多样性皆为1.000,同为最丰富群体;LD 和SY 群体单倍型多样性相比较低,为0.992和0.993。8 个群体的单倍型多样性水平大于0.5,属于高水平。总体核苷酸多样性为0.020 57,8 个群体中最为丰富的LG 群体的核苷酸多样性为0.023 84,核苷酸多样性最低的为SY 群体(0.014 09),8 个群体核苷酸多样均大于0.005,属于高水平。8 个群体均具有较高的遗传多样性,其中LG 群体遗传多样性最丰富,SY 群体遗传多样性较缺乏。大弹涂鱼群体单倍型多样性在0.933~0.992 之间,核苷酸多样性在 0.008 25~0.011 09 之间。平均核苷酸差异数为6.286~8.442;WC 群体中最多,为 8.442 个;DZ 群体中最少,为6.286 个。总体单倍型多样性为0.979。由单倍型参数可知,WC 群体最丰富,为0.992;DZ 群体最低,为0.933;3 个群体的数值都在0.5 之上,属高水平群体。总体核苷酸多样性为0.011 09,其中WC 群体多样性最丰富,为0.011 09;DZ 群体最低,为0.008 25,3 个群体核苷酸多样均大于0.005,属于高水平。3 个群体中,WC 群体遗传多样性最为丰富,DZ 群体遗传多样性较缺乏。大鳍弹涂鱼单倍型多样性数值为0.971,大于0.5,属于高水平;核苷酸多样性数值为0.016 08,大于0.005,属于高水平。平均核苷酸差异数为12.783。
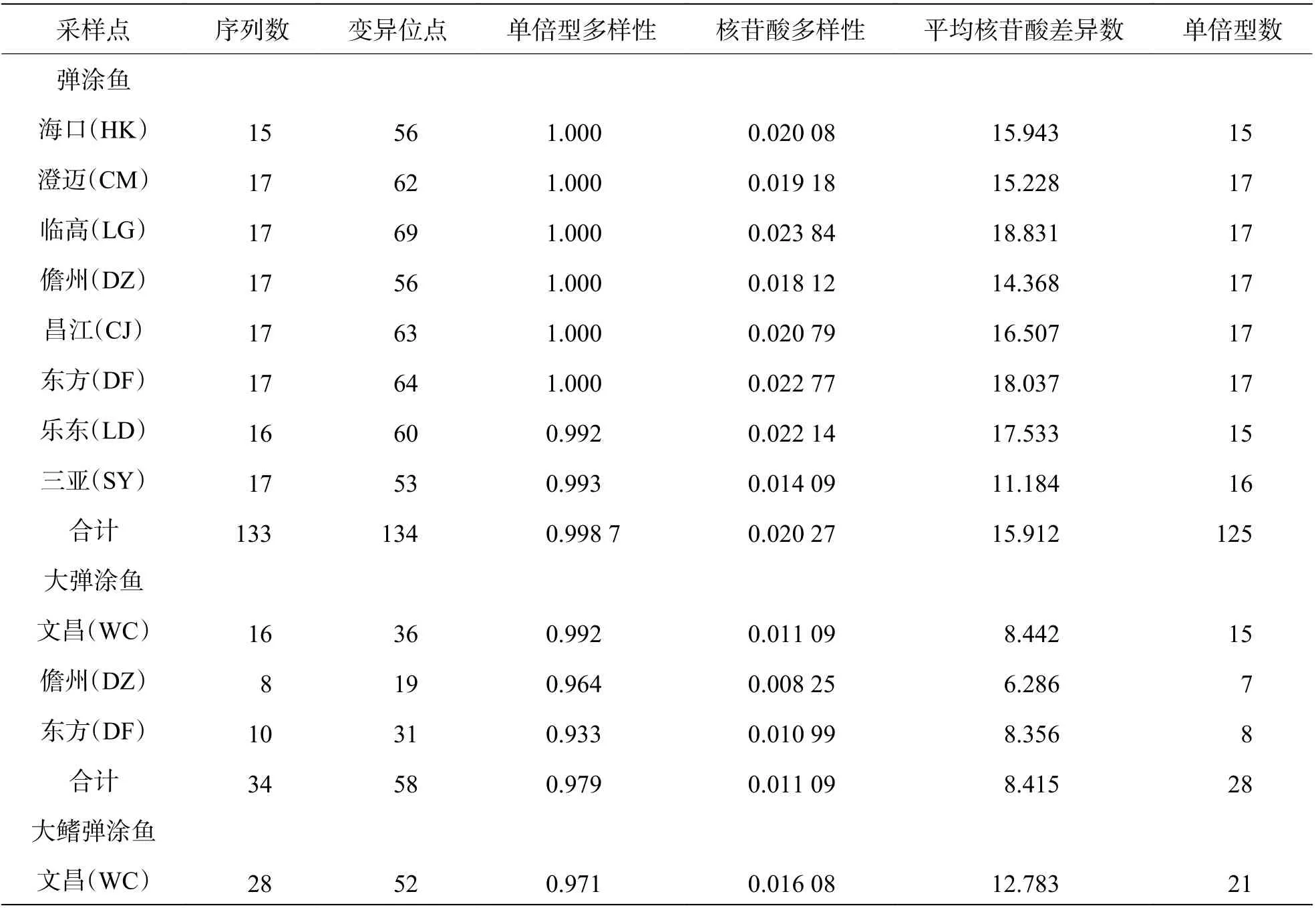
表2 3 种弹涂鱼的采样点、数目及遗传多样性
2.3 单倍型在群体中的分布在8 个弹涂鱼群体中,共有单倍型125 个,5 个共享单倍型,独有单倍型120 个。Hap24 为3 个群体共享(CM、LG、SY),Hap50、53 为2 个群体共享(DZ、CJ),Hap67为2 个群体共享(CJ、DF),Hap84 为2 个群体所共享(DF、SY)。在独有单倍型中HK 群体有15 个(Hap1~15),CM 群 体 有16 个(Hap16~Hap23、Hap25~Hap32),LG 群 体 有 16 个(Hap33~Hap48),DZ 群体有15 个(Hap49、Hap51~Hap52、Hap54~Hap65),CJ 群体有14 个(Hap66、Hap68~Hap80),DF 群体有15 个(Hap81~Hap83、Hap85~Hap96),LD 群体有15 个(Hap97~Hap111),SY 群体有14 个(Hap112~Hap125)。3 个大弹涂鱼群体中共有单倍型28 个,共享单倍型2 个,为Hap19、Hap20(DZ、DF 2 个群体共享);独有单倍型26 个。在独有单倍型中WC 群体有15 个(Hap1~Hap15),DZ 群体有5 个(Hap16~Hap18、Hap21~Hap22),DF 群体有6 个(Hap23~Hap28)。
2.4 遗传分化弹涂鱼单倍型网络图(图1)由Network 软件分析得出:没有按照地理群体而形成独立的分支,共享单倍型约占所有单倍型的4.0%(5/125)。大弹涂鱼单倍型之间的进化关系显示WC 群体较为聚在一起,共享单倍型约占所有单倍型的7.1%(4/24)(图2)。
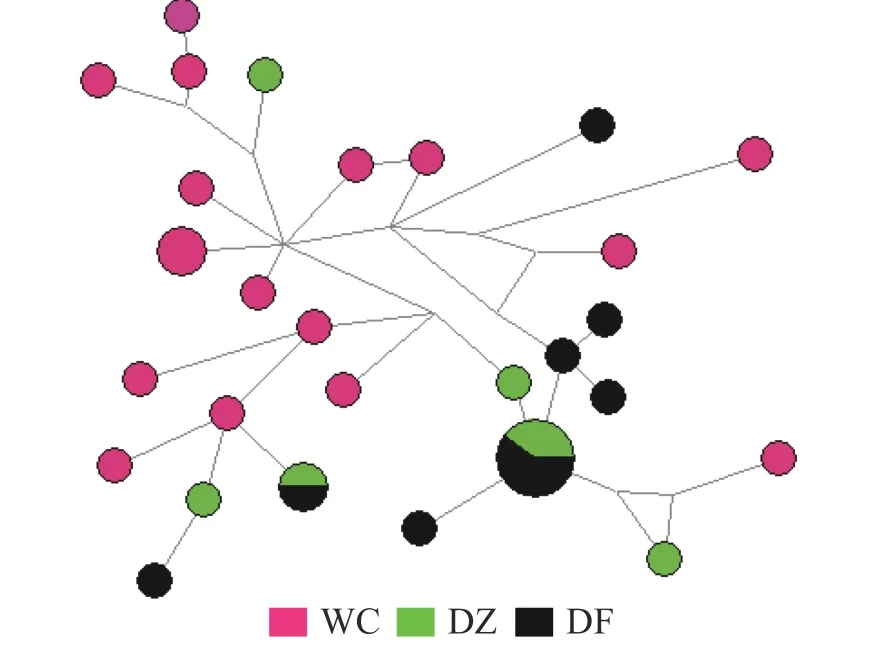
图1 弹涂鱼线粒体控制区单倍型网络结构图

图2 大弹涂鱼线粒体控制区单倍型网络结构图
基于线粒体控制区序列构建的NJ 树(图3-a)结果表明弹涂鱼各群体杂乱地聚在一起,没有按采样的地理位置聚集,大弹涂鱼序列NJ 树结果表明WC 群体较为聚在一起(图3-b)。选取33 条弹涂鱼(TT)、34 条大弹涂鱼(DT)、28 条大鳍弹涂鱼(DQ)序列建树,结果表明3 个物种之间界限明确,不同种之间的序列可各自聚成单系,支持率较高,表明弹涂鱼先与大鳍弹涂鱼分离,再和大弹涂鱼分离(图3-c)。

图3 弹涂鱼(a)、大弹涂鱼(b)及3 种弹涂鱼(c)线粒体控制区序列邻接系统发育树
8 个弹涂鱼群体的遗传距离见表3。表3 结果表明,弹涂鱼群体内的遗传距离为0.014~0.025,群体间的遗传距离为0.016~0.024,LG 和DF 群体的遗传距离最大(0.024),其余群体之间的遗传距离在0.016~0.023 之间。大弹涂鱼群体内的遗传距离为0.008~0.011,群体间的遗传距离为0.010~0.013,WC 和DF 群体的遗传距离最大,为0.013(表4)。
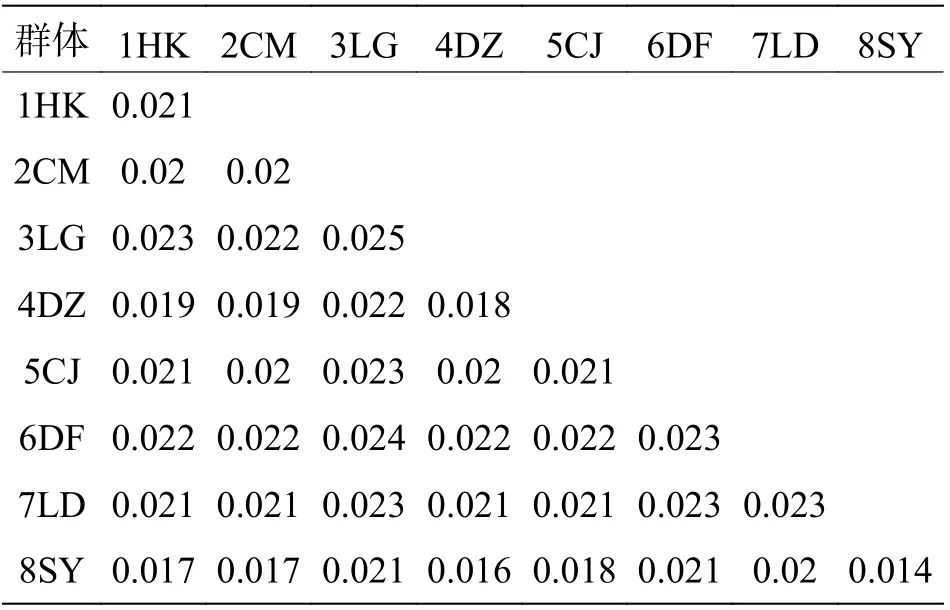
表3 基于线粒体控制区基因序列的弹涂鱼群体遗传距离
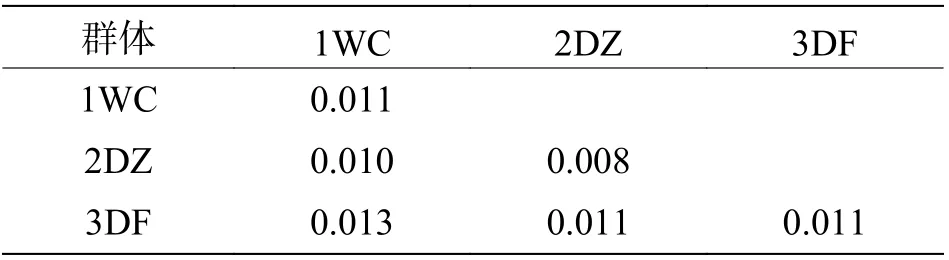
表4 基于线粒体控制区基因序列的大弹涂鱼群体遗传距离
3 种弹涂鱼中,弹涂鱼与大鳍弹涂鱼群体遗传距离最小有着较近的亲缘关系,为0.097,大弹涂鱼与弹涂鱼和大鳍弹涂鱼遗传距离分别为0.344和0.357(表5)。
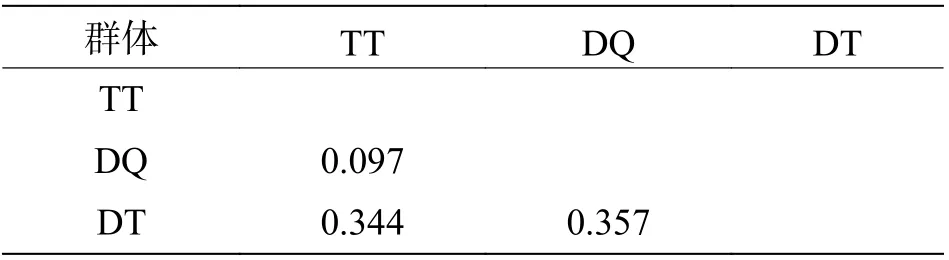
表5 基于线粒体控制区基因序列的3 种弹涂鱼群体遗传距离
群体间Fst分析结果显示:8 个弹涂鱼两两群体间的Fst值在-0.032 22~0.097 57 之间(表6),LG 和SY 群 体Fst为0.092 01(P<0.05),DF 和SY 群体Fst为0.097 57(P<0.05),LD 和SY 群体Fst为0.057 12(P<0.05),其余群体间Fst均小于0.05(P>0.05)。大弹涂鱼两两群体间的Fst值在0.015 79~0.152 70 之 间(表7),WC 和DF 的Fst为0.152 70 (P<0.01),其 余 群 体 间 的Fst为0.015 79 和0.097 75(P>0.05)。弹涂鱼与大鳍弹涂鱼Fst为0.832 11(P<0.01),弹涂鱼与大弹涂鱼Fst为0.974 60(P<0.01),大鳍弹涂鱼与大弹涂鱼Fst为0.982 09(P<0.01)(表8)。
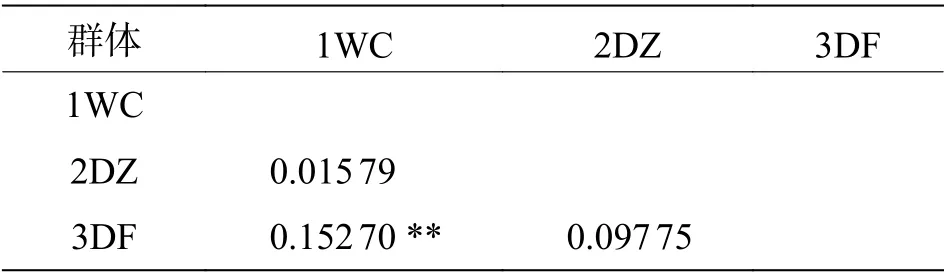
表7 大弹涂鱼遗传分化指数
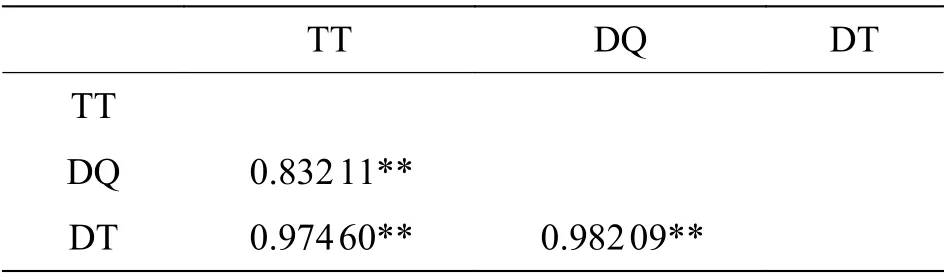
表8 3 种弹涂鱼遗传分化指数
弹涂鱼地理群体AMOVA 分析结果(表9)表明群体间的遗传变异占0.48%,比例极小;群体内部变异占99.52%,比例大。不存在明显的遗传分化,群体间基因交流频繁。大弹涂鱼群体间变异占10%,具有一定比例,群体内部变异占90%,Fst为0.100 03(P<0.01),存在中等程度遗传分化。3 种弹涂鱼种群间的遗传变异占所有遗传变异的96.24%,种群内的遗传变异仅为3.76%。
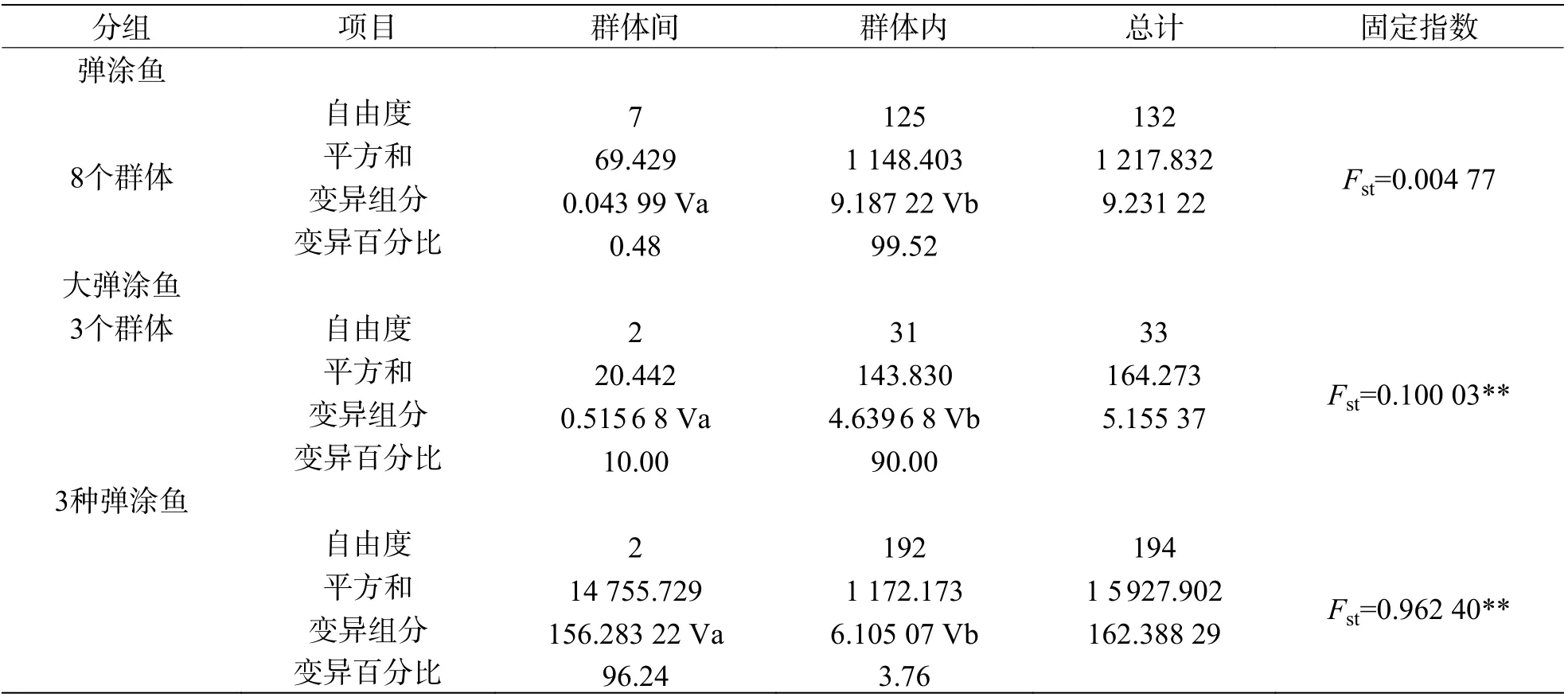
表9 3 种弹涂鱼的分子方差分析
2.5 种群历史动态中性检验结果(表10)表明,弹涂鱼全部群体Tajima'sD值均为负值,不显著。Fu'sFs值均为负值,除LD 群体外其余群体P<0.05。基 于Arlequin 不 配 对 分 布 结 果(图4,表11)表明,全部群体都不是单峰状。CM、CJ 群体的SSD 统计检验显著,其余群体不显著;全部群体r统计检验不显著。大弹涂鱼全部群体Tajima'sD值均为负值,不显著。Fu'sFs值WC 群体P<0.01,另外2 个群体负值不显著。基于Arlequin 不配对分布结果表明WC 群体单峰状,其余群体不为单峰状。SSD 和r这2 个统计检验不显著。大鳍弹涂鱼Tajima'sD和Fu'sFs值负值,不显著,未呈单峰分布。
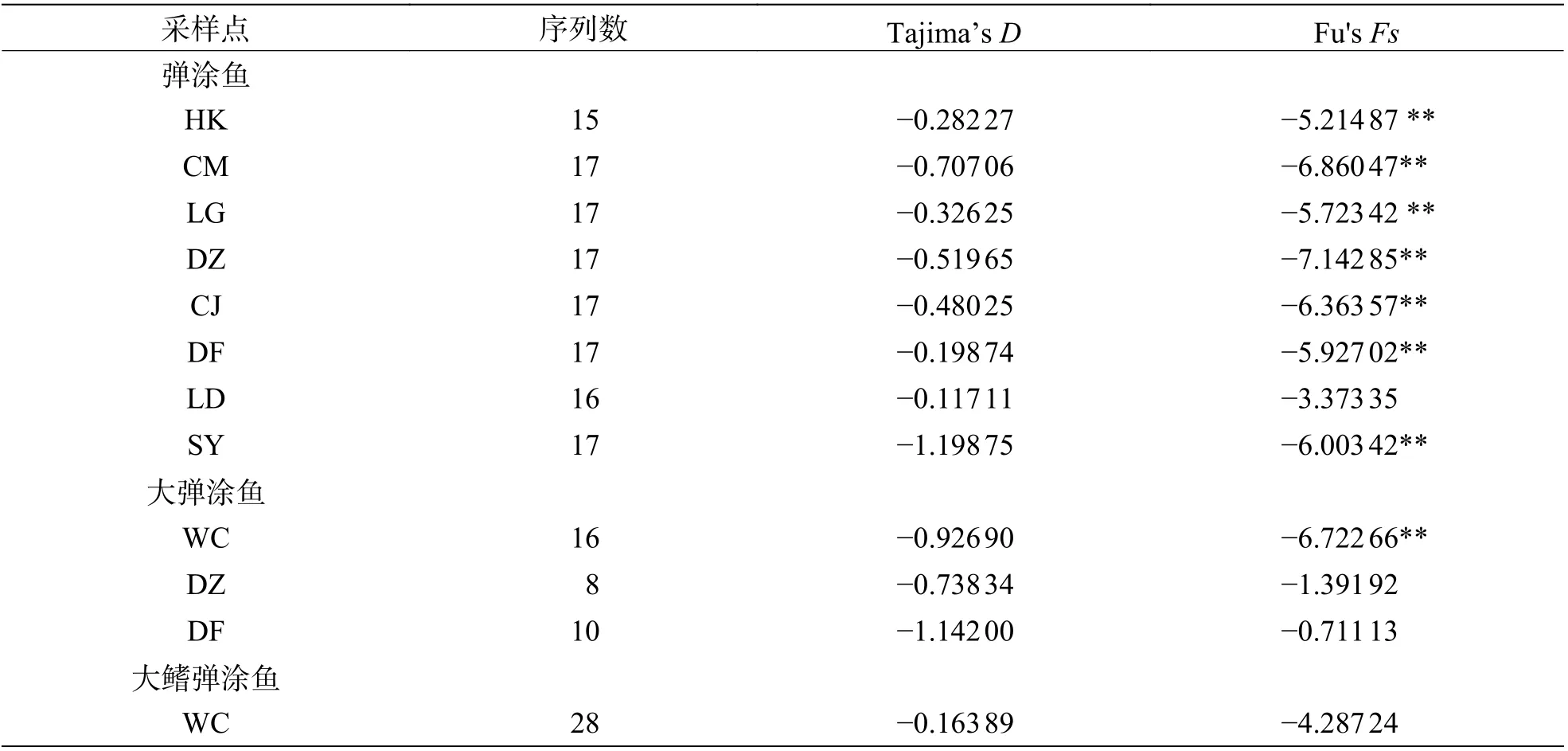
表10 3 种弹涂鱼中性检验结果
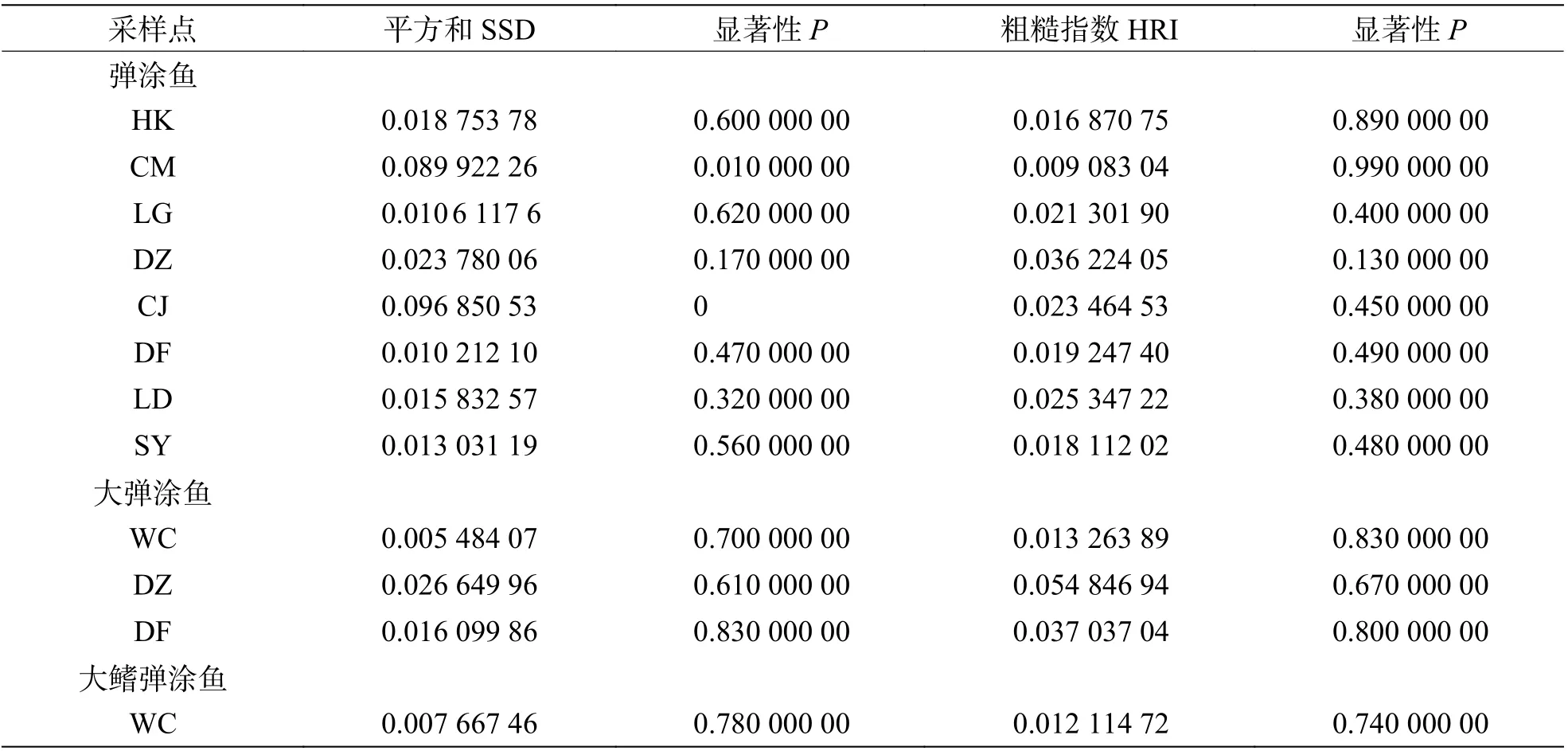
表11 3 种弹涂鱼吻合度检验结果
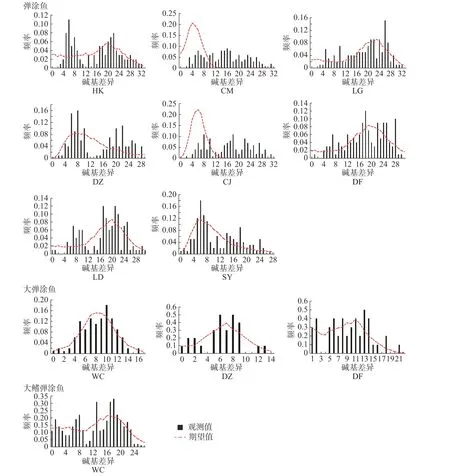
图4 3 种弹涂鱼群体的核苷酸不配对分析图
3 讨 论
遗传多样性与物种的适应能力、进化能力密切相关,本研究对海南岛的弹涂鱼类进行了全面调查,对采集到的3 种弹涂鱼共12 个群体进行分析。结果表明,弹涂鱼群体的单倍型多样性指数在0.992~1.000 之间,核苷酸多样性指数在0.014 09~0.023 84 之间,总体单倍型多样性指数为0.998 7,核苷酸多样性指数为0.020 57。根据Grant 和Bowen[25]提出的4 种模式,海南岛8 个弹涂鱼群体为单倍型多样性及核苷酸多样性高类型。说明是一个大型稳定的群体,具有长期的进化历史或者和其他支系发生过2 次交流。8 个群体中三亚群体的遗传多样性最低,笔者推测相比于其他群体,三亚群体最大的区别在于受周围环境胁迫压力较大,海岸线的开发及人类活动影响使弹涂鱼栖息地范围减小,几近消失,而遗传多样性比较丰富的临高群体则受人类活动影响明显较小。海南岛群体总体与广东群体[10]对比结果表明:单倍型多样性指数和核苷酸多样性指数均高于广东群体。
大弹涂鱼群体的单倍型多样性指数在0.933~0.992 之间,核苷酸多样性指数在 0.008 25~0.011 09 之间,总体单倍型多样性为0.979,总体核苷酸多样性为0.011 09。属于高单倍型多样性、高核苷酸多样性类型。大弹涂鱼3 个群体中,儋州群体遗传多样性最低,笔者推测相比于另外两个采样点,儋州群体采样点附近受人类活动影响较为频繁,而遗传多样性较为丰富的文昌群体位于东寨港红树林保护区,受人为活动的干扰较少。但与江苏连云港群体、上海九段沙群体、浙江慈溪群体、浙江舟山群体、福建霞浦群体、广东雷州半岛群体、广西北海群体[10,16]相比较,属于较低水平。
大鳍弹涂鱼单倍型多样性指数为0.971,核苷酸多样性指数为0.016 08。属于高单倍型多样性、高核苷酸多样性类型。与雷州半岛群体[9]相比属于较高水平。将3 种弹涂鱼与同处于南海的卵形鲳鰺(Trachinotus ovatus)[26]、圆舵鲣(Auxis tapeionosomaBleeker)[27]、鯻(Therapon theraps)[21]相比,弹涂鱼属于中上水平,大弹涂鱼属于低水平,大鳍弹涂鱼属于中下水平。3 种弹涂鱼相互对比,弹涂鱼最为丰富,大鳍弹涂鱼次之,大弹涂鱼最为匮乏,应优先对大弹涂鱼进行保护。
Fst是评价遗传分化的指标,Fst大于0.25 表示分化程度非常高,Fst在0.15~0.25 表示高度分化,Fst在0.05~0.15 表示中等分化,Fst小于0.05 表示未分化[28]。本研究群体间Fst分析结果表明,8 个弹涂鱼两两群体间的Fst值在-0.032,22~0.097 57 之间,LG 和SY 群体Fst为0.092 01(P<0.05),DF 和SY 群 体Fst为0.097 57 (P<0.05),LD 和SY 群 体Fst为0.057 12(P<0.05),其 余 群 体 间Fst均小于0.05(P>0.05)。表明三亚与临高、东方、乐东存在中等程度分化,推测三亚群体受人类活动干扰及栖息地地形阻隔阻碍了其与其他群体的正常交流。AMOVA 分析得出群体间的遗传变异占0.48%,比例极小;群体内部变异占99.52%,占据相当大的比例,不存在明显的遗传分化,与之前使用COⅠ作为标记得出的结果相似[12]。
大弹涂鱼两两群体间的Fst值在 0.015 79~0.152 70 之 间,WC 和DF 的Fst为0.152 70 (P<0.01),其余群体间的Fst为0.015 79 和0.097 75(P>0.05),WC 和DF 群体存在高度分化。AMOVA 分析结果表明,3 个大弹涂鱼群体间变异占10%,具有一定比例,群体内部变异占90%,Fst为0.100 03(P<0.01),存在中等程度遗传分化,根据之前Fst数据推测,主要的分化差异来自于WC 和DF 群体之间。张顺[9]对雷州半岛4 个大弹涂鱼群体进行分析得出Fst值在0~0.05 之间。王从涛[16]对中国沿海大弹涂鱼群体研究得出无显著遗传分化,北海群体同其他群体存在中等程度分化。本研究结果可能与采样地理位置有关,WC 采样点处于港湾内部较封闭区域,加上琼州海峡阻隔洋流阻隔,在一定程度上影响了该群体与其他群体的基因交流。
通过构建邻接系统发育树显示出3 个物种之间界限明确,不同种之间的序列可各自聚成单系,支持率较高,可看出弹涂鱼先与大鳍弹涂鱼分离,再和大弹涂鱼分离。弹涂鱼与大鳍弹涂鱼距离最小为0.097,大弹涂鱼与弹涂鱼和大鳍弹涂鱼距离分别为0.344 和0.357。可得出3 种弹涂鱼中弹涂鱼与大鳍弹涂鱼亲缘关系较近,与分类上弹涂鱼与大鳍弹涂鱼处同一属相一致,弹涂鱼与大鳍弹涂鱼Fst为0.832 11(P<0.01),弹涂鱼与大弹涂鱼Fst为0.974 60(P<0.01),大鳍弹涂鱼与大弹涂鱼Fst为0.982 09(P<0.01),AMOVA 显示3 种弹涂鱼种群间的遗传变异占所有遗传变异的92.41%,种群内的遗传变异仅为7.59%。3 种弹涂鱼交流受阻,存在隔离。长期以来,弹涂鱼和大鳍弹涂鱼被混在一起,韩国学者证实其实它们是2 种不同的鱼类[1]。王正琦等[18]通过cyt b基因序列建树发现大鳍弹涂鱼和弹涂鱼分别聚在相近分支,本研究通过NJ 树可将大鳍弹涂鱼和弹涂鱼相区分开来,与王正琦等[18]的分析结果一致。
中性检验结果表明,弹涂鱼全部群体Tajima'sD值均为负值,不显著。Fu'sFs值均为负值,除LD 群体外其余群体P<0.05。基于Arlequin 不配对分布表明全部群体都不是单峰状。CM、CJ 群体的SSD 统计检验显著,其余群体不显著;全部群体r 统计检验不显著。以此,本研究推测海南岛弹涂鱼未经历过扩张。大弹涂鱼全部群体Tajima'sD值均为负值,不显著。Fu'sFs 值WC 群体P<0.01,另外2 个群体负值不显著。基于Arlequin不配对分布表明WC 群体单峰状,其余群体不为单峰状。SSD 和r这2 个统计检验不显著。大弹涂鱼的性成熟年龄为1 龄[29],D-loop进化速率参考值为每百万年3%~12%[16],推测大弹涂鱼WC 群体在17.9~4.5 万年前经历过扩张。大鳍弹涂鱼群体Tajima'sD值和Fu'sFs 值均为负值,且不显著。基于Arlequin 不配对分布表明不为单峰状,据此推测大鳍弹涂鱼未经历过扩张。17.9~4.5 万年前在第四纪,第四纪的冰期和间冰期的交替变化会造成海平面的下降和上升由此带来的变化可能会对弹涂鱼类产生影响,从而发生扩张[30]。
本研究对海南岛进行了系统的采样调查,采样地点覆盖范围较广,但对比中国动物志等[1]文献的记载发现,资料上的许多地点已没有弹涂鱼类的活动踪迹,比如陵水新村、英州等地。从弹涂鱼和大弹涂鱼的遗传多样性分析结果可看出:采样点的栖息环境与遗传多样性丰富程度存在一定程度的关联。根据本研究调查发现,弹涂鱼类不是海南的主要经济鱼种,所以对于海南岛弹涂鱼类来说影响其多样性的主要原因不是过度捕捉,海岸线过度开发、环境恶化及人类活动频繁是导致弹涂鱼栖息地退化、多样性减少的主要原因。加强弹涂鱼资源保护,倡导人与自然和谐共处,有利于海南岛生态岛的建设。对此建议采取以下措施保护弹涂鱼类资源:(1)严格控制污水排放和滩涂畜禽养殖,减少在弹涂鱼栖息地的人为活动;(2)加强弹涂鱼繁殖生物学基础理论研究,定期监测生态环境以及弹涂鱼生物资源,对资源衰退严重区域可通过人工增殖放流恢复弹涂鱼资源。(3)对分布有弹涂鱼资源的河口、滩涂地区景观工程改造需充分考虑弹涂鱼生活习性,为弹涂鱼保留适当栖息场所。(4)作为弹涂鱼栖息地的红树林滩涂区,存在着利用不合理等问题,下一步需要加强对红树林的保护,为红树林生态系统的发展提供空间。
