油莎豆豆粕中黄酮类物质的提取及工艺优化
2023-04-20田佳泽江悦艇陈奕霖廖海昌侯羽婷于亚莉
田佳泽,江悦艇,陈奕霖,廖海昌,侯羽婷,于亚莉
(吉林大学食品科学与工程学院,吉林长春 130062)
油莎豆属于被子植物门中的单子叶植物纲莎草目莎草科莎草属[1],又称为油莎草、铁荸荠、地杏仁、地下核桃、人参果、油豆等,在国外又被称作虎坚果、老虎豆等。油莎豆中各种营养成分丰富,除油脂、膳食纤维、糖、蛋白质、淀粉和维C、维E外,还富含人体所需的磷、铁、钾等矿物质[2]。此外,油莎豆中还含有丰富的生物活性物质,如甾醇、生物碱、丹宁、类黄酮等[3]。
21 世纪以来,国内外的许多学者对油莎豆中主要营养成分——油的提取进行了积极的探索[4],但是对于榨油后的油莎豆豆粕研究却不多,大多数油莎豆豆粕都被废弃掉,造成极大浪费。用油莎豆豆粕作为原料,采用了酶解法、乙醇溶剂法及酶解辅助醇提法3 种不同的方法,对油莎豆豆粕中的黄酮类物质进行了提取,并对工艺进行了优化,为该物质在医药、食品等领域的应用提供一定的理论依据。
1 材料与分析方法
1.1 材料与试剂
油莎豆豆粕粉,市售;芦丁标样(纯度等级AR),酷尔化学(北京) 科技有限公司提供;纤维素酶(纯度等级BR),上海源叶生物科技有限公司提供;乙醇(纯度等级AR)、盐酸(纯度等级AR)、氢氧化钠(纯度等级AR),北京化工厂提供;其他试剂均为分析纯。
1.2 仪器与设备
UV-4802 型紫外可见分光光度计,尤尼科(上海) 仪器有限公司产品;PHSJ-4F 型pH 计,上海禹昂自动化科技有限公司产品;ESJ 180-4 型电子分析天平,沈阳龙腾电子有限公司产品;LD4-2A 型离心机,北京市雷博尔离心机有限公司产品;DK-98-II 型恒温水浴锅,天津市泰斯特仪器有限公司产品;RE-52-99 型旋转蒸发仪,上海亚荣生化仪器厂产品;SJIA-10N-50A 型真空冷冻干燥机,宁波双嘉仪器有限公司产品。
1.3 提取量检测
1.3.1 标准曲线绘制
精确称取5.5 mg 芦丁对照品于10 mL 的容量瓶,加入75%乙醇溶液,溶解后,加入75%乙醇定容成550 μg/mL 的对照溶液。准确吸取以下梯度的芦丁对照品溶液,0.25,0.50,0.75,1.00,1.25,1.50 mL于6 个10 mL 容量瓶中。然后依次加入5 g/100 mL的亚硝酸钠溶液体积0.3 mL,10 g/100 mL 的硝酸铝溶液体积0.3 mL,10 g/100 mL 的氢氧化钠溶液4 mL,每次加入上述的溶液之后,都需振荡摇匀,静置6 min后再加入到下一个溶液中,最后用体积分数70%的乙醇溶液定容至10 mL。
于波长510 nm处,以芦丁空白作为对照组,进行比色法测定样品的吸光度。以芦丁质量浓度(mg/mL)为横坐标,吸光度为纵坐标,通过横纵坐标绘制标准曲线[5],得到回归方程:Y=0.015 28X-0.180 46,R2=0.997 02。
1.3.2 提取量测定
精确量取1.0 mL 的样品溶液于10 mL 的容量瓶,按序加入5 g/100 mL 的亚硝酸钠溶液0.3 mL,10 g/100 mL 的硝酸铝溶液0.3 mL,10 g/100 mL 的氢氧化钠水溶液4 mL,每次加入一种溶液之后,都需要振荡摇匀,静置6 min 后,再加入下一种溶液中,最后加入体积分数为70%的乙醇溶液定容至10 mL[6]。利用紫外分光光度计仪器,采用比色法,于波长510 nm处测定待测物质的吸光度,并利用回归方程这一数学工具,获取样品的黄酮提取量,并且通过其计算出油莎豆豆粕中的黄酮类物质的提取量,公式如下:
式中:R——油莎豆豆粕中的类黄酮提取量,mg/g;
m——油莎豆豆粕粉的质量,g;
C——所测得的黄酮质量浓度,mg/mL;
V——样品溶液体积,mL;
n——溶液稀释的倍数。
2 试验方法
2.1 酶解水提法
纤维素酶作用于植物细胞的细胞壁,使构成植物细胞的细胞壁成分被分解成小分子物质,降低在提取黄酮类物质中遇到的阻力,从而促进其更好地从细胞中溶出[7]。
准确称取干燥后的2.0 g 油莎豆粕粉末放于三颈圆底烧瓶中,加入适当的纤维素酶和适当体积的水,调节pH 值至相应条件,放在恒温水浴锅中,进行一定时间的酶解提取,之后高温灭酶10 min,冷却至室温后离心,收集上清液,按照上述方法对提取量进行测定。
以样品中黄酮提取量为指标,分别选取5 个单因素25 个值进行试验。即酶用量0.25,0.50,0.75,1.00,1.25 mg/mL;pH 值3,4,5,6,7;酶解温度30,40,50,60,70 ℃;酶解时间1.0,1.5,2.0,2.5,3.0 h;料 液 比1 ∶10,1 ∶20,1 ∶30,1 ∶40,1∶50(g∶mL)。以每个单因素条件最佳值的范围为依据,通过正交试验对黄酮类物质提取工艺进行优化,以获得酶解法的最佳工艺条件。
2.2 醇提法
依据相似相溶原理可知,黄酮类物质易溶于有机溶剂中,因此可以利用乙醇溶液提取油莎豆豆粕中黄酮类物质[8]。
准确称取干燥后的2.0 g 油莎豆粕粉末放于三颈圆底烧瓶中,加入适量的纤维素酶和一定体积分数的乙醇,在恒温条件中提取一定时间,冷却至室温后离心,收集上清液按照上述方法对提取量进行测定。
以黄酮提取量为指标,分别选取了4 个单因素20 个值进行试验。即乙醇体积分数30%,40%,50%,60%,70%,80%;提取温度30,40,50,60,70 ℃;恒温水浴时间1.0,1.5,2.0,2.5,3.0 h;料液比1∶10,1∶20,1∶30,1∶40,1∶50(g∶mL)。以每个单因素条件最佳值的范围为依据,通过正交试验对黄酮类物质提取工艺进行优化,以获得乙醇提取法的最佳工艺条件。
2.3 酶解醇提法
纤维素酶和乙醇溶液的协同作用使得油莎豆豆粕中的细胞壁被充分破坏,有利于细胞内的黄酮类物质浸出[9]。
准确称取干燥后的2.0 g 油莎豆粕粉末放于三颈圆底烧瓶中,加入适量的纤维素酶和适当体积分数的乙醇,调pH 值至相应条件,放在恒温水浴锅中,进行一定时间的酶解提取,之后高温灭酶10 min,冷却至室温后离心,收集上清液,按照上述方法对提取量进行测定。
以黄酮提取量为指标,分别选取了6 个单因素30 个值进行试验。即酶用量0.25,0.50,0.75,1.00,1.25 mg/mL;pH 值3,4,5,6,7;酶解温度30,40,50,60,70 ℃;酶解时间1.0,1.5,2.0,2.5,3.0 h;料液比1∶10,1∶20,1∶30,1∶40,1∶50(g∶mL);乙醇体积分数为10%,20%,30%,40%,50%。以每个单因素条件最佳值的范围为依据,通过正交试验对黄酮类物质提取工艺进行优化,以确定酶解辅助乙醇法的最佳工艺条件。
3 结果与分析
3.1 酶解水提法
3.1.1 单因素试验
(1) 酶用量对油莎豆豆粕中黄酮提取量的影响。在pH 值5,酶解温度50 ℃,酶解时间1.5 h,料液比1∶30(g∶mL) 的条件下,考查酶用量对黄酮类物质提取量的影响。
酶用量对黄酮提取量的影响见图1。
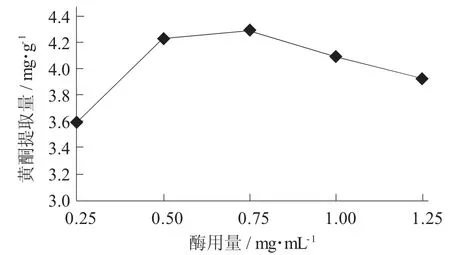
图1 酶用量对黄酮提取量的影响
由图1 可知,当逐渐提高纤维素酶用量时,黄酮的提取量也在不断地上升,把油莎豆豆粕作为底物时,物料浓度是一定的,当增大纤维素酶用量时,酶的浓度增加,这大大加快了酶与底物的反应速度和细胞破裂,导致黄酮类类物质的溶解,提取量自然增加。当酶用量增大到0.75 mg/mL 时,溶液中酶的浓度趋于饱和状态,黄酮的提取量增加的速度会变慢。当黄酮的提取量达最大值时,黄酮的提取量不随酶用量的增加而变化。当酶用量继续增加时,可能会导致酶水解过度,对黄酮类物质的糖苷键产生一定影响,导致黄酮类物质的提取量减小。因此,结合实际情况,选择酶的最佳用量应为0.75 mg/mL。
(2) 酶解温度对油莎豆豆粕中黄酮提取量的影响。在纤维素酶用量0.75 mg/mL,pH 值5.0,酶解时间1.5 h,料液比1∶30(g∶mL) 条件下,考查酶解温度对黄酮提取量的影响。
酶解温度对黄酮提取量的影响见图2。

图2 酶解温度对黄酮提取量的影响
由图2 可知,当酶解温度不断升高时,黄酮类物质提取量逐渐增大,在50 ℃时达到了最大值。当酶解温度超过50 ℃后,温度进一步上升,黄酮的提取量却开始有下降的趋势。一方面,温度的增高降低了酶的活性,纤维素酶不能有效地破坏细胞壁,影响黄酮类物质的有效溶出;另一方面过高的温度会增加试验的能耗[10]。因此,考虑到实际效益,选择最佳酶解温度在50 ℃左右。
(3) pH 值对油莎豆豆粕中黄酮提取量的影响。pH 值对酶解来说是很重要的一个因素,最佳的pH值能发挥出酶的最佳效能[11]。在纤维素酶用量0.75 mg/mL,酶解温度50 ℃,酶解时间1.5 h,料液比1∶30(g∶mL) 的条件下,考查pH 值对黄酮提取量的影响。
pH 值对黄酮提取量的影响见图3。

图3 pH 值对黄酮提取量的影响
由图3 可知,随着pH 值的变大,黄酮的提取量在不断增加,当pH 值等于5.0 时,黄酮的提取量最高。此后再增加pH 值,黄酮类物质提取量趋近于平缓甚至下降,原因可能是由于溶液中pH 值的不断增大,超出纤维素酶作用的最适宜pH 值范围,导致酶不能有效发挥其作用。因此,选择最佳pH 值在5.0左右。
(4) 酶解时间对油莎豆豆粕中黄酮提取量的影响。在纤维素酶用量0.75mg/mL,酶解温度50 ℃,pH 值5.0,料液比1∶30(g∶mL) 的条件下,考查酶解时间对黄酮类物质的提取量的影响。
酶解时间对黄酮提取量的影响见图4。

图4 酶解时间对黄酮提取量的影响
由图4 可知,随着酶解时间的延长,提取出的黄酮类物质也在不断增多,当酶解时间为2 h 时,黄酮的提取量最大。此时,延长酶解时间可以让底物和酶之间的反应进行得更加充分,提高了黄酮的提取量。若酶解时间过长,黄酮的提取量将会进一步下降。长时间的反应反而使酶逐渐失去活性,导致了提取量的减少。因此,从各方面因素综合考虑,选择的最佳酶解时间在2 h 左右。
(5) 料液比对油莎豆豆粕中黄酮提取量的影响。在纤维素酶用量0.75 mg/mL,酶解时间2 h,pH 值5.0,酶解温度50 ℃条件下,考查料液比对黄酮提取量的影响。
料液比对黄酮提取量的影响见图5。
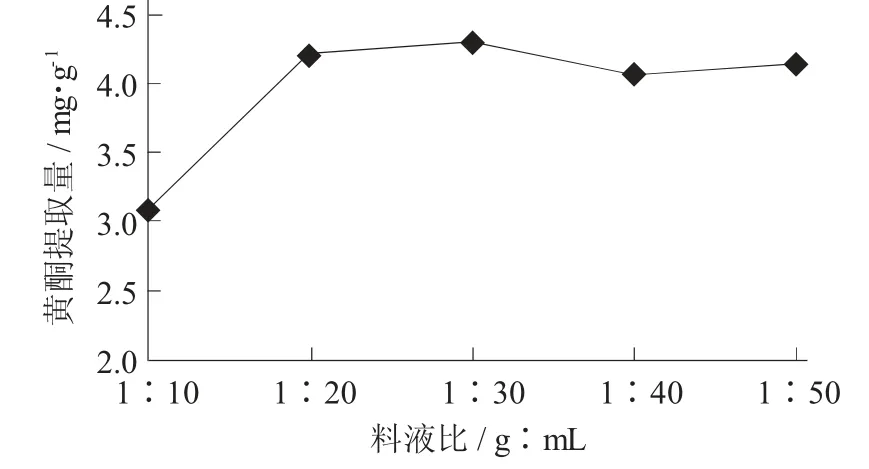
图5 料液比对黄酮提取量的影响
由图5 可知,当料液比发生变化时,黄酮的提取量也会发生较为明显的变化。当料液比为1∶10 ~1∶30(g∶mL) 时,黄酮的提取量将会因为提取液体积的增大而提高;当料液比为1∶30 时,提取量达到最大值,之后提取液进一步增大,黄酮类物质提取量反而下降。料液比对于试验十分重要,如果料液比太小,在试验过程中物料可能不会被完全酶解,最终造成黄酮提取量较低,如果料液比太大,将对水资源造成一定的浪费,而且不利于试验的进行。从经济条件考虑,选取料液比在1∶30(g∶mL)左右较为适宜。
3.1.2 正交试验的设计
(1) 试验设计。根据以上单因素试验获得的范围,以油莎豆豆粕中的黄酮提取量为考查指标,设计正交试验,以确定最优的方案,即采用L9(35)的正交表来进行试验。
因素水平设计见表1,正交试验结果分析见表2。

表1 因素水平设计
(2) 数据处理。由表2 可知,RA>RC>RD>RE>RB,即影响油莎豆的豆粕中黄酮提取量的各因素顺序为料液比(A) >酶用量(C) >pH 值(D) >提取时间(E) >提取温度(B)。影响较大的因素有料液比、酶用量和pH 值,影响较小的因素为温度和时间。
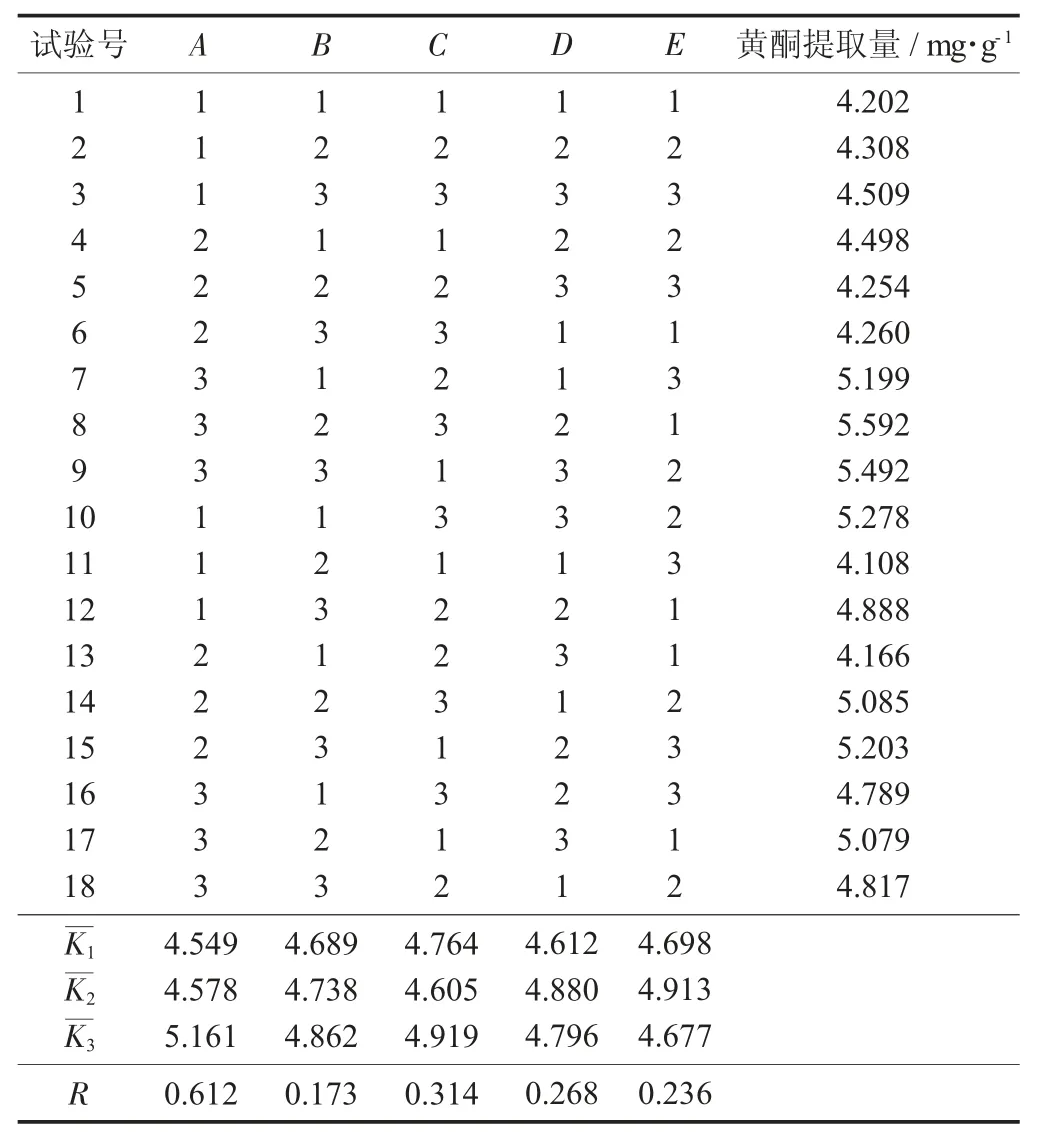
表2 正交试验结果分析
从试验实际的角度看来,酶解法提取的黄酮量会随着料液比的增大而增大,但是与此同时提取液中酶和底物的浓度减少,溶出的杂质含量会增加。在试验过程中,处于理想值的料液比才能使提取充分。因此,选择酶用量0.875 mg/mL,酶解温度55 ℃,pH 值5.0,酶解时间2 h,料液比1∶35(g∶mL)作为酶解法的最佳试验条件。
综上,在上述确定的酶解法最佳试验条件下再次进行试验,得到黄酮提取量为5.624 mg/g。试验证明,酶解法可使油莎豆豆粕中的黄酮类物质充分释放出来,而且操作简单、溶剂无污染、成本低,但较长的提取时间可能会将易溶于热水的无机盐、蛋白质、糖类等杂质一并提取,降低了黄酮类物质的纯度,对试验造成一定的干扰。而且纯度低会导致后续分离纯化等步骤增多,增加了试验的复杂性[12]。
3.2 醇提法
3.2.1 单因素试验
(1) 乙醇体积分数对油莎豆豆粕中黄酮提取量的影响。在料液比1∶30(g∶mL),提取时间2 h,提取温度60 ℃条件下,考查乙醇体积分数对油莎豆豆粕中黄酮的提取量的影响。
乙醇体积分数对黄酮提取量的影响见图6。
由图6 可知,提取过程中,当乙醇体积分数太小时,提取液的极性影响黄酮提取效果[13],导致了提取液中的黄酮量较低;当乙醇体积分数达到60%时,溶剂的极性和细胞中黄酮的极性相接近,从而导致了溶出率最大;当乙醇体积分数继续增大时,黄酮提取量减少,可能是由于高浓度的乙醇易挥发,且挥发性乙醇中含有黄酮,导致最终黄酮提取量减小了。因此,提取油莎豆豆粕中黄酮类物质的乙醇体积分数应选择60%。

图6 乙醇体积分数对黄酮提取量的影响
(2) 提取温度对油莎豆豆粕中黄酮提取量的影响。在料液比1∶30(g∶mL),提取时间2 h,乙醇体积分数60%条件下,考查提取温度对油莎豆豆粕中黄酮提取量的影响。
提取温度对黄酮提取量的影响见图7。
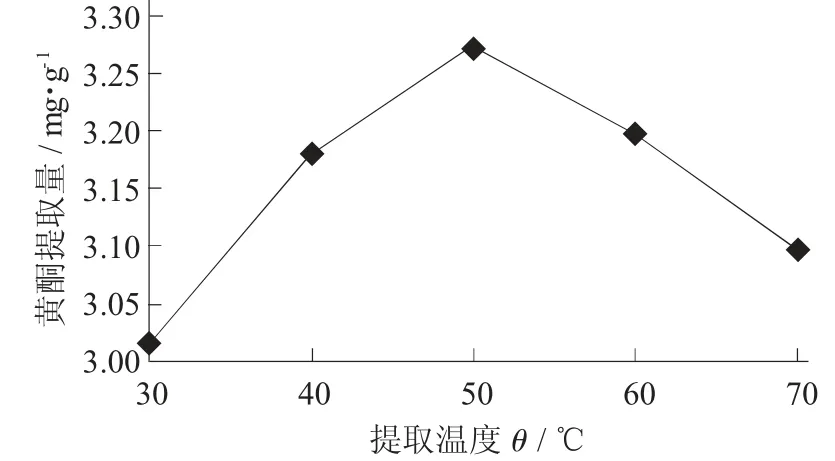
图7 提取温度对黄酮提取量的影响
由图7 可知,当提取温度一直上升到50 ℃时,油莎豆豆粕中黄酮的提取量出现了峰值,由于热效应及溶剂效应的共同影响,使得分子的运动速度越来越快,有利于黄酮类物质溶出,黄酮提取物的提取量也随之增加。所以,油莎豆豆粕中黄酮类物质提取的最佳提取温度应是50 ℃。
(3) 提取时间对油莎豆豆粕中黄酮提取量的影响。在料液比1∶30(g∶mL),提取温度60 ℃,乙醇体积分数60%条件下,考查提取时间对油莎豆豆粕中黄酮提取量的影响。
提取时间对黄酮提取量的影响见图8。
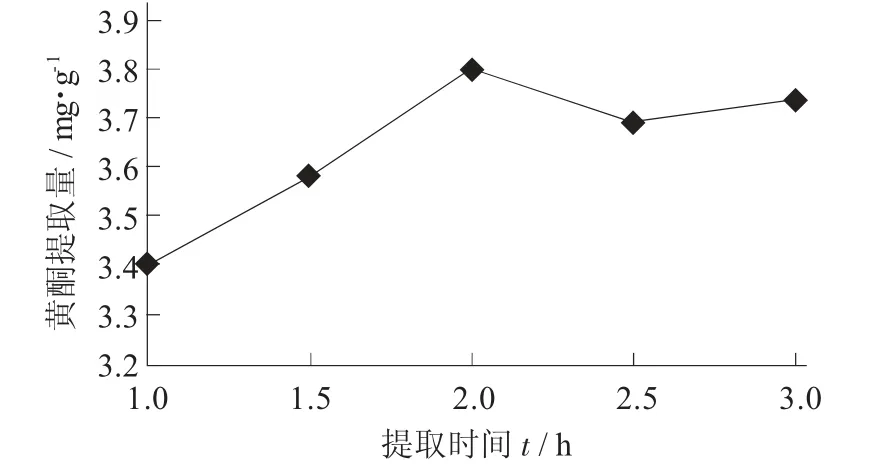
图8 提取时间对黄酮提取量的影响
由图8 可知,油莎豆豆粕中黄酮提取量随着提取时间的延长而增加,当提取时间在2 h 时,黄酮的提取量出现最大值;当提取时间大于2 h 后,黄酮提取量呈下降的趋势,随着提取时间的继续延长,其提取量下降的幅度不明显,基本维持在一个相对稳定的状态。结合实际效益考虑,油莎豆豆粕中黄酮类物质的最佳提取时间应选择2 h。
(4) 料液比对油莎豆豆粕中黄酮提取量的影响。在提取时间2 h,提取温度60 ℃,乙醇体积分数60%恒定不变的条件下,考查料液比对油莎豆豆粕中黄酮类物质提取量的影响。
料液比对黄酮提取量的影响见图9。

图9 料液比对黄酮提取量的影响
由图9 可知,在一定范围内,油莎豆豆粕中黄酮的提取量随料液比的增加而增加,这可能是由于料液比对溶剂传质过程速度的影响,料液比越大,溶剂的传质速度越快,黄酮类类物质的浸出速率也越大;料液比为1∶30 时,油莎豆豆粕中的黄酮提取量最高;而当料液比继续增大时,黄酮类物质的提取量变化不大。还可看出,当料液比增加到一定程度时,黄酮类类物质在溶剂中的浸出将达到饱和的状态[14],因此提取油莎豆豆粕中黄酮类物质的最佳条件是料液比控制在1∶30(g∶mL) 左右。
3.2.2 正交试验的设计
(1) 试验设计。根据以上单因素试验获得的确定范围,以油莎豆豆粕中的黄酮提取量为考查指标,按照设计L9(34)正交试验,研究各因素对油莎豆豆粕中黄酮提取量的影响,以确定最优的方案.
因素水平设计见表3,正交试验结果分析见表4。

表3 因素水平设计
(2) 数据处理。由表4 可知,R'D'>R'B'>R'A'>R'C',即乙醇提取法中各因素对黄酮提取量的影响程度排序为料液比(D') >提取时间(A') >乙醇体积分数(C') >提取温度(B')。从油莎豆豆粕中提取黄酮的最佳工艺为A'1B'3C'1D'3,即由此可见,最佳提取条件为料液比1∶35(g∶mL),提取温度55 ℃,乙醇体积分数55%,提取时间1.75 h。
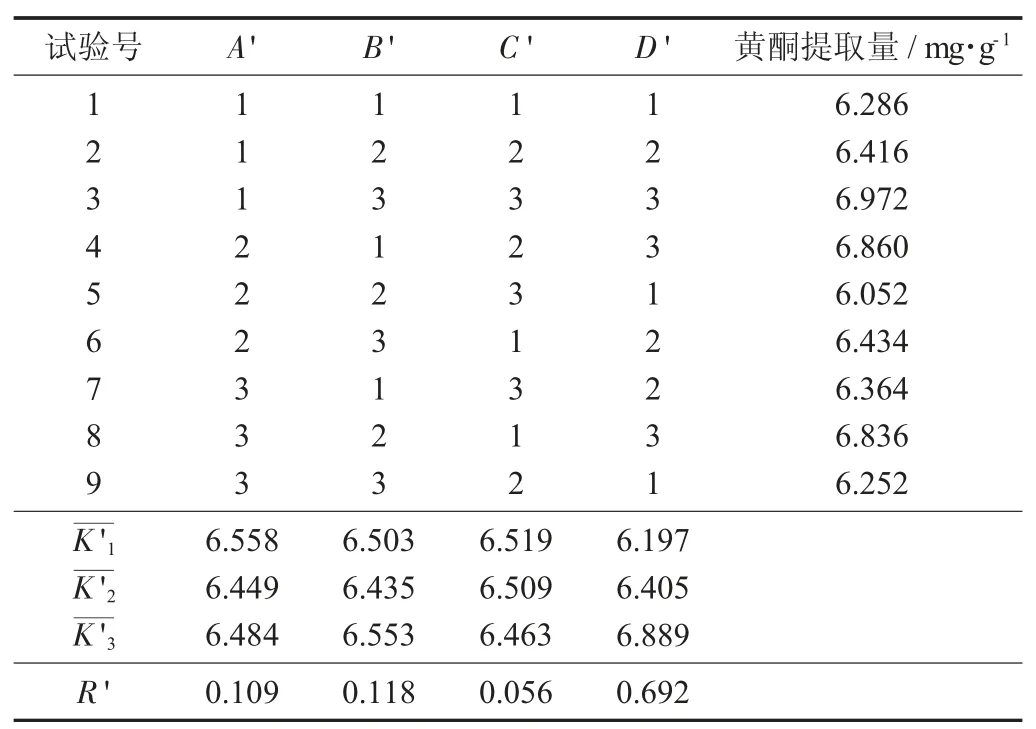
表4 正交试验结果分析
综上,以最佳提取条件为料液比1∶35(g∶mL),提取温度55 ℃,乙醇体积分数55%,提取时间1.75 h下再次进行试验,得到该条件下的黄酮提取量为7.101 mg/g,相比于酶解法,乙醇提取法显著增大了油莎豆豆粕中黄酮提取量,而且提取过程简单安全,具有良好的实用价值。
3.3 酶解醇提法
3.3.1 单因素试验
(1) 酶用量对油莎豆豆粕中黄酮提取量的影响。在pH 值5,酶解温度50 ℃,酶解时间1.5 h,乙醇体积分数30%,料液比1∶30(g∶mL) 条件下,考查酶用量对黄酮提取量的影响。
酶用量对黄酮提取量的影响见图10。

图10 酶用量对黄酮提取量的影响
由图10 可知,随着酶用量的增加,酶和乙醇协同作用使得黄酮提取量大幅度增大,当酶用量继续增大至0.75 mg/mL 时,酶的浓度已达到饱和,此时黄酮提取量趋于稳定,持续增加酶用量只会使酶的浪费。故而,选取酶用量为0.75mg/mL。
(2) 酶解温度对油莎豆豆粕中黄酮提取量的影响。在pH 值5,酶用量0.75 mg/mL,酶解时间1.5 h,乙醇体积分数30%,料液比1∶30(g∶mL) 条件下,考查酶解温度对黄酮提取量的影响。
酶解温度对黄酮提取量的影响见图11。
由图11 可知,酶解温度越高,酶解效果越好。但是,如果温度过高,一方面酶的活性会受到一定的抑制,提取效果会下降;另一方面,提取过程中溶解的杂质也在增加,将增加试验的复杂性和能耗。因此,根据实际情况,最佳酶解温度为50 ℃。
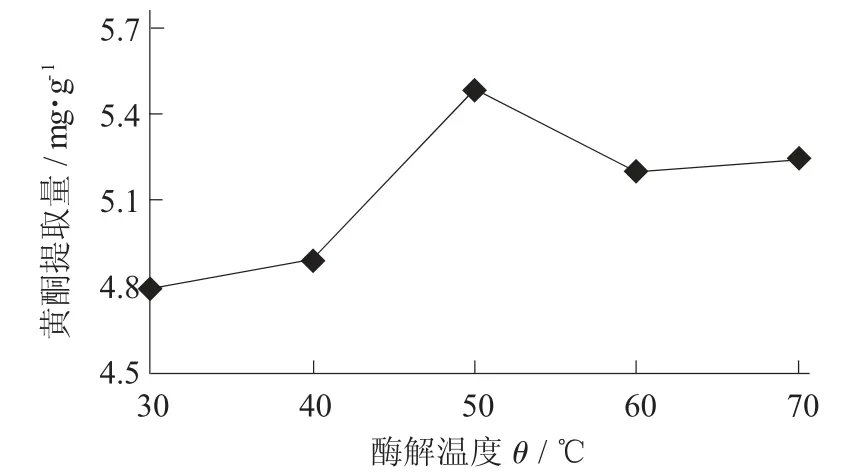
图11 酶解温度对黄酮提取量的影响
(3) pH 值对油莎豆豆粕中黄酮提取量的影响。pH 值不仅影响纤维素酶构象,还影响底物的解离状态,从而影响酶的活性。在酶用量0.75 mg/mL,酶解温度50 ℃,酶解时间1.5 h,乙醇体积分数30%,料液比1∶30(g∶mL) 条件下,考查pH 值对黄酮提取量的影响。
pH 值对黄酮提取量的影响见图12。

图12 pH 值对黄酮提取量的影响
由图12 可知,黄酮提取量随pH 值的增大呈现先增后减的变化趋势。当pH 值5.0 时,黄酮提取量最大;再继续增大pH 值,纤维素酶活性下降,影响破坏细胞壁的致密构造的效果,使得乙醇无法更好地发挥作用,从而导致黄酮提取量下降。因此,从实际出发,试验最适pH 值为5.0。
(4) 酶解时间对油莎豆豆粕中黄酮提取量的影响。在pH 值5,酶用量0.75 mg/mL,酶解温度50 ℃,乙醇体积分数30%,料液比1∶30(g∶mL) 条件下,考查酶解时间对黄酮提取量的影响。
酶解时间对黄酮提取量的影响见图13。
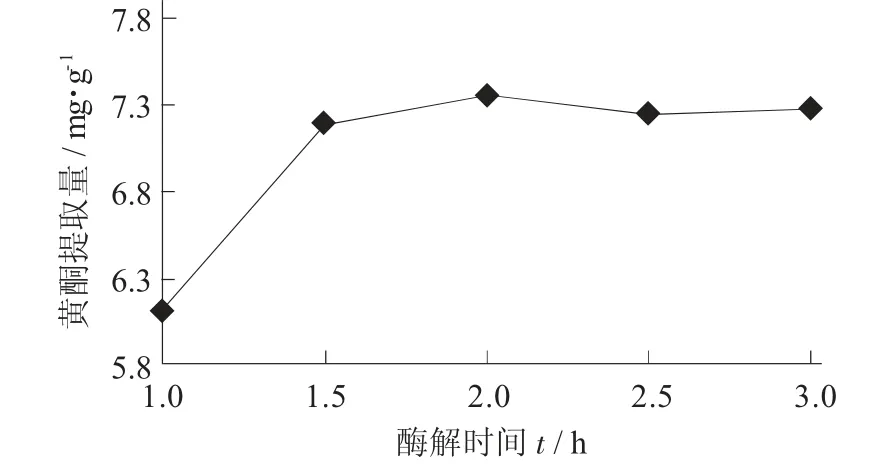
图13 酶解时间对黄酮提取量的影响
由图13 可知,黄酮提取量随着酶解时间的延长而增大,酶解时间为2 h 时,黄酮提取量较高。再延长酶解时间,提取量基本不变,但是杂质的溶出率会随着酶解时间的延长不断升高,结合节省时间、降低成本,故试验选取酶解时间为2 h。
(5) 乙醇体积分数对油莎豆豆粕中黄酮提取量的影响。在pH 值5,酶用量0.75 mg/mL,酶解时间2 h,酶解温度50 ℃,料液比1∶30(g∶mL) 条件下,考查乙醇体积分数对黄酮提取量的影响。
乙醇体积分数对黄酮提取量的影响见图14。

图14 乙醇体积分数对黄酮提取量的影响
由图14 可知,不同乙醇体积分数下纤维素酶乙醇提取的得率均高于单一的醇提,这是由于细胞壁的酶水解和黄酮类类物质的乙醇浸出的协同效应。分析结果可知,选择30%的乙醇体积分数为最佳提取条件。
(6) 料液比对油莎豆豆粕中黄酮提取量的影响。在pH 值5,酶用量0.75 mg/mL,酶解时间1.5 h,酶解温度50 ℃,乙醇体积分数30%条件下,考查料液比对黄酮提取量的影响。
料液比对黄酮提取量的影响见图15。
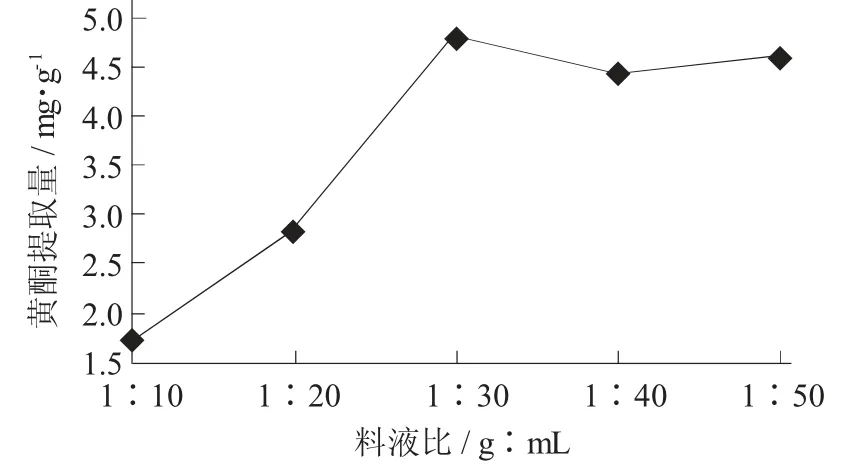
图15 料液比对黄酮提取量的影响
由图15 可知,在一定范围内,随着料液比的增大,提取出的黄酮类物质在逐渐增加,当料液比为1∶30(g∶mL) 时,其提取量最高,随后继续增加料液比,提取量反而下降至一个稳定水平。这是由于过大的料液比会使得样品可能没有被酶解彻底,最终会导致黄酮提取量偏低,而且料液比过大,不仅浪费资源,而且会溶出更多杂质,不利于后续试验的进行。从经济条件考虑,试验选择料液比为1∶30(g∶mL)。
3.3.2 正交试验
(1) 试验设计。根据以上单因素试验获得的确定范围,以油莎豆豆粕中的黄酮提取量为考查指标,按照L18(36)正交试验,研究6 个因素对提取油莎豆豆粕中黄酮类物质的影响,以确定最优的方案。
因素水平设计见表5,正交试验结果分析见表6。

表5 因素水平设计

表6 正交试验结果分析
(2) 数据处理。由直观分析可知,R''B''>R''C''>R''F>R''E',各因素对黄酮提取量的影响的程度排序为料液比(B) >提取温度(C) >时间(F) >pH 值(E),乙醇体积分数和酶解时间影响不大。由此得出的最佳工艺组合为A''1B''3C''1D''1E''2F''1。由此可见,确定最佳提取条件为料液比1∶35(g∶mL),酶解温度55 ℃,乙醇体积分数35%,酶解时间2 h,pH 值5,酶用量0.65 mg/mL。
综上所述,以料液比1∶35(g∶mL),酶解温度55 ℃,乙醇体积分数35%,酶解时间120 min,pH值5,酶用量0.65 mg/mL 为最佳工艺条件下,再次试验得到的黄酮提取量为8.582 mg/g。相比于酶解法和乙醇提取法,纤维素酶和乙醇发挥协同作用能较大程度地提取有效成分,纤维素酶辅助提取黄酮的提取率更高。
4 结论
不同提取方法对黄酮总提取量的影响见表7。

表7 不同提取方法对黄酮总提取量的影响
目前,具有操作方便、提取条件温和、提取过程安全、提取效率高、能较大程度地保留有效成分的优点提取黄酮类物质的方法有3 种,分别是酶解法、有机溶剂提取法和超声波辅助法[15]。如何在试验中配合使用这3 种简单的方法,获得更高的提取量是未来黄酮类物质提取的研究方向。
试验将前2 种方法进行了结合,探究了黄酮提取的最佳工艺条件。由表7 可知,纤维素酶- 水溶液提取油莎豆豆粕中黄酮的得率最小,酶- 乙醇提取的得率最高。这是由于纤维素酶- 水提法提取黄酮杂质较多,如无机盐、蛋白质、糖等,因此提取率最低。在油莎豆豆粕中黄酮提取中加入纤维素酶和乙醇溶液后,酶破坏油莎豆豆粕中细胞壁结构,使黄酮类物质更好地溶于乙醇溶液中,二者对黄酮类物质的浸出产生协同效应,使黄酮溶出率明显增加。结合各种因素的考虑,采用酶- 乙醇溶液更有利于油莎豆豆粕中黄酮的提取[16]。
