量子点标记免疫层析试纸条检测谷物中T-2毒素
2023-04-19刘笑笑
张 滢,彭 涛,苗 茜,刘笑笑,丁 辉
(兰州市食品药品检验检测研究院,甘肃兰州 730050)
单端孢霉烯族毒素是一大类化学结构相关的真菌毒素,根据其特征官能团的不同可分为A、B、C、D 4种类型。T-2是A类型中毒性最强的,广泛分布在谷物及动物饲料中,性质稳定,不易灭活。T-2会引起急性和慢性毒性,对人和动物的多种组织和器官产生毒害作用,能够引起的毒性效应包括消化系统和肝脏毒性、骨系统损伤、基因与细胞毒性、血液系统毒性、免疫系统毒性、神经毒性和生殖发育毒性等[1]。
随着检测技术的快速发展,目前国内外对T-2的测定方法主要有液相色谱(Liquid Chromatography,LC)、 液 质 联 用(Liquid Chromatography-Tandem Mass Spectrometry,LCMS)、气相色谱(Gas Chromatography,GC)、气质联 用(Gas Chromatography-Mass Spectrometry,GCMS)及免疫法[2]。其中LC-MS不需要在检测过程中对T-2进行复杂的衍生,故成为T-2最常用的分析检测方法,但其费时费力,成本高。最便捷、灵敏度高的检测方法是酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay,ELISA)法,可用于广泛的粮食样品T-2的筛查。基于ELISA衍生出的免疫层析法,成本低且适用于大量样品的现场快速分析[3],对减少T-2的污染和降低暴露风险有积极作用。
QDs是一种新型纳米材料,制备简单,发光效率高,化学稳定性好。QDs凭借其诸多优点及独特的荧光效应,在食品中有毒有害小分子物质的快速检测领域得到广泛应用[4-5]。本研究以量子点和T-2抗体为基础,制备QDs-Ab荧光探针,建立一种T-2-QDICA新方法,以期能够缩短谷物中T-2的检测时间,降低检测成本。
1 材料与方法
1.1 材料与仪器
样品垫、结合垫、吸水纸垫、PVC板、Milipore HF 140s硝酸纤维素膜,上海金标公司;羧基化水溶性量子点,武汉珈源公司;T-2单克隆抗体(T-2-Ab)、T-2包被原(T-2-BSA)、T-2 ELISA试剂盒,山东绿都生物科技有限公司;T-2毒素(T-2)、黄曲霉毒素B1(AFB1)、黄曲霉毒素M1(AFM1)、玉米赤霉烯酮(ZEN)、伏马毒素B1(FB1)、呕吐毒素(DON)、赭曲霉毒素A(OTA),德国Dr.Ehrenstorfer公司;羊抗鼠二抗(IgG)、乙基碳二亚胺(EDC),美国Sigma公司;玉米,当地超市。
1.2 设备与仪器
HM3035喷金仪、ZQ2000自动斩切机,上海金标生物有限公司;ZF1-Ⅱ紫外分析仪,上海嘉鹏科技有限公司。
1.3 实验方法
1.3.1 QDs-Ab复合物的制备
取25 μL QD(s8 μmol·L-1)于2.0 mL离心管中,加入 93 μg EDC,再分别加入 12 μg、24 μg、30 μg T-2-Ab,混合均匀,210 r·min-1室温下避光充分反应4 h。然后将溶液在4 ℃条件下12 000 r·min-1离心3 min除团聚。然后用规格为100 kDa的超滤离心管将离心后的上清液浓缩,使用尺寸排阻柱对浓缩液纯化,最终得到QDs-Ab复合物。
1.3.2 QDICA的组装
将140s硝酸纤维素膜、吸水纸垫、结合垫和样品垫依次粘贴在PVC板上,将羊抗鼠IgG、T-2-BSA分别包被在NC膜上,作为QDICA的质控线(C线)、检测线(T线),于37 ℃烘箱中放置4~6 h,用自动斩切机斩断成宽为3.7 mm的试纸条,储存在常温、干燥、避光的条件下。
1.3.3 QDICA实验条件优化
样品的上样缓冲液、QDs-Ab复合物的添加量、工作液的加入量、二抗和T-2-BSA的稀释倍数等都直接影响试纸条的准确性以及灵敏度。分别选择QDs-Ab 的添加量为 0.1 μL、0.3 μL、0.5 μL,工作液添加量为 3 μL、5 μL、8 μL、10 μL 以及 4 种不同的上样缓冲液进行试纸条检测,当试纸条C、T线荧光强度一致且适中、荧光条带清晰以及背景干扰程度小时,确定为QDICA最佳工作条件。
1.3.4 QDICA方法检测限确定
将 T-2 用上样稀释液依次稀释为 0 μg·L-1、1.0 μg·L-1、2.5 μg·L-1、5.0 μg·L-1、8.0 μg·L-1、10.0 μg·L-1、25.0 μg·L-1,分别和一定量的 QDs-Ab复合物、工作液在试纸条最优工作条件下上样,10 min后通过紫外分析仪观察检测结果。T线荧光条带恰好完全消失时所对应的T-2最小浓度确定为T-2-QDICA的可视化检测限。
1.3.5 QDICA方法特异性评价
在试纸条最佳工作条件下,分别检测T-2、AFB1、FB1、ZEN、OTA、DON和AFM1,通过观察C、T线显色情况,进行方法特异性评价。
1.3.6 QDICA实际样品的检测及有效性验证
选择阴性谷物样品作为实际样品进行测定。准确称取5 g粉碎均匀的谷物样品,精密加入5 mL 75%的甲醇溶液作为样品提取液充分提取,涡旋20 min后,离心机3 900 r·min-1下离心10 min,留下上清液待用。将阴性样品上清液用上样缓冲液稀释4倍来消除基质影响,最后进行试纸条上样检测。
本实验利用商品化ELISA试剂盒验证QDICA方法的有效性。
2 结果与分析
2.1 制备QDs-Ab时QDs和T-2-Ab添加比例的优化
QDs和T-2-Ab的添加比例会影响QDs-Ab复合物的偶联效率,最终影响QDICA方法的灵敏度。本研究选择摩尔比为1∶4、1∶8、1∶10的QDs和 T-2-Ab制 备 QDs-Ab。 由 图 1可 知,QDs和T-2-Ab摩尔比为1∶8时,荧光强度最强,所以选择QDs和T-2-Ab摩尔添加比例为1∶8。

图1 QDs和T-2-Ab的添加比例的优化图
2.2 上样缓冲液的优化
试纸条的上样缓冲液会影响免疫反应活性,缓冲液的pH值、溶液中不同离子的浓度均会影响C、T线的荧光强度。本研究选择pH值为5.7和7.4的PB、pH值为7.4的PBS、pH值为8.3的BBS作为上样缓冲液进行试纸条检测。结果发现,缓冲液为pH=5.7的PB时,C、T线处荧光亮度差;缓冲液为pH=7.4的PB时,C、T线处荧光条带均匀清晰,QDICA灵敏度较好;缓冲液为pH=7.4的PBS时,QDICA灵敏度稍差;缓冲液为pH=8.3的BBS时,C线处荧光条带亮度稍弱,可能引起实验结果无效的误判。综上,最终选择pH=7.4的PB作为试纸条上样缓冲液和样品稀释液。
2.3 QDs-Ab复合物和工作液添加量的确定
QDs-Ab复合物的加入量决定着QDICA C、T线处荧光强度,直接影响QDICA方法的灵敏度。工作液的加入主要影响样品溶液在QDICA上的层析速度,进而影响QDs-Ab与T-2-BSA结合效率,间接影响了实验结果的准确性。本文研究QDs-Ab的添加量为 0.1 μL、0.3 μL、0.5 μL,工作液添加量为3 μL、5 μL、8 μL、10 μL 时,QDICA C、T 线处的荧光强度。结果发现,当加入QDs-Ab复合物量较少(0.1 μL)时,C、T线荧光强度较弱,说明没有足够的QDs-Ab复合物与C、T线上二抗和T-2-BSA结合;当加入QDs-Ab复合物量太多(0.5 μL)时,导致C、T线荧光亮度太强而灵敏度降低。随着工作液添加量的增加,变化梯度由一般到明显再到一般。因此,本文最终确定QDs-Ab和工作液的加入量分别为 0.3 μL 和 8.0 μL。
2.4 QDICA检测限的确定
将配制成不同浓度的T-2混合样品溶液滴加在样品垫上,10 min后通过紫外分析仪观察检测结果。
如图2所示,当样品中不含T-2时,C、T线上荧光条带清晰,亮度均匀一致。随着T-2浓度逐渐升高,C线不变,T线的荧光强度逐渐变弱直至消失不见。T-2浓度为5 μg·L-1时,T线上荧光条带恰好完全消失。经过几次重复实验,确定T-2-QDICA方法的可视化检测限为 5 μg·L-1。
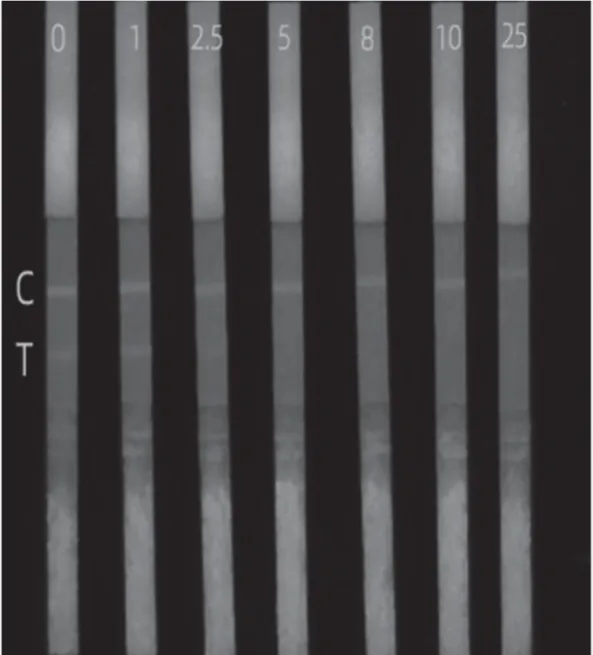
图2 T-2-QDICA可视化检测限的确定图
2.5 T-2-QDICA特异性的评价
如图 3所示,5 μg·L-1的 T-2就能够使 QDICA T线处的荧光条带消失,而其余6种高浓度真菌毒素标准品溶液(浓度均为1 mg·L-1)都不能与T线处包被物结合,从而使T线荧光条带消失。说明QDs-Ab复合物只能和其对应的T-2抗原结合,与其他6种常见的真菌毒素均无交叉,特异性好。

图3 T-2-QDICA交叉反应图
2.6 T-2-QDICA有效性的验证
经过验证发现,实验中QDICA方法与ELISA试剂盒的检测结果一致,证明QDICA方法高效、有效,可简单、快速实现T-2在谷物中的半定量检测。
3 结论
本研究利用QDs作为荧光标记物,基于免疫特异性识别,建立了一种灵敏、快速的荧光免疫层析方法用于检测谷物中T-2的残留量。本方法相较于大型仪器检验方法,检测时间短,操作简单,实际样品中测定结果与ELISA试剂盒测定结果一致,证明本方法有效且具有一定实用性。
