根结线虫危害与健康黄瓜根际土壤微生物群落结构差异分析
2023-04-18杨学瑾周媛媛彭欣怡刘建凤张爱民井爱芹赵钢勇曹丹丹
杨学瑾 周媛媛 彭欣怡 刘建凤 张爱民 井爱芹 赵钢勇 曹丹丹
摘要:为探明黄瓜根结线虫病与根际土壤微生物群落的关系,通过高通量测序分析对比了受根结线虫危害和健康黄瓜根系的根表土和根围土中微生物群落结构组成及丰富度的差异。结果表明,健康黄瓜根表土、健康黄瓜根围土、病害黄瓜根表土和病害黄瓜根围土4组土壤样品之间微生物Alpha多样性无显著差异,但Beta多样性在各组间差异显著。在门水平上,各组间细菌和真菌群落组成相似,但拟杆菌门(Bacteroidetes)和担子菌门(Basidiomycota)在各组的相对丰度存在显著差异,其中拟杆菌门在病害黄瓜根表土(13.58%)、担子菌门在健康黄瓜根表土(6.69%)中的相对丰度较高。在属水平上,各组间细菌和真菌的组成也基本一致,细菌中黄杆菌属(Flavobacterium)、假单胞菌属(Pseudomonas)、链霉菌属(Streptomyces)、根瘤菌属(Rhizobium)、德沃斯氏菌属(Devosia)、鞘氨醇杆菌属(Novosphingobium)、剑菌属(Ensifer)、纤维弧菌属(Cellvibrio)和噬几丁质菌属(Chitinophaga)在不同组中的相对丰度存在显著差异,且均在病害黄瓜根表土中的相对丰度最高,分别为3.62%、2.58%、1.93%、2.34%、1.14%、1.60%、1.30%、1.13%和1.59%;而黃色类固醇杆菌属(Steroidobacter)在健康黄瓜根表土中的相对丰度最高,为1.50%;真菌中假埃希氏菌属(Pseudallescheria)、毛壳菌属(Chaetomium)在健康黄瓜根围土中的相对丰度最高,分别为13.73%、11.00%;漆斑菌属(Myrothecium)在健康黄瓜根表土中的相对丰度最高,为7.51%;绿僵菌属(Metarhizium)在病害黄瓜根围土中的相对丰度较高,为3.99%;棒孢菌属(Corynespora)在病害黄瓜根表土中的相对丰度较高,为2.64%。研究结果为通过调控植物根际土壤微生物群落结构防治根结线虫提供了理论依据。
关键词:根结线虫病;根际土;微生物多样性;黄瓜doi:10.13304/j.nykjdb.2022.0840
中图分类号:S642.2 文献标志码:A 文章编号:10080864(2023)01010910
蔬菜根结线虫病(root-knot nematode disease)已成为当今农业生产中仅次于真菌病害的第二大类病害,由植物寄生性根结线虫(Meloidogynespp.)引起[1]。根结线虫主要侵害植物的根系,并在其内部形成复杂的取食位点,严重影响植物正常的水分和养分吸收运输等生理代谢功能[23]。每年因根结线虫侵染可造成蔬菜减产30%,因此导致的经济损失达30亿元以上[4]。在植物根际筛选具有抑杀功能的有效微生物是目前生物防治根结线虫的重要手段。
在根际微生态系统中,由于植物根系分泌物以及代谢后组织成分的存在使得植物根际塑造出不同于周围土壤的微生物群落结构,这些根际微生物在促进植物生长以及生物地球化学循环方面起着重要作用[5-7]。研究表明,根际土壤微生物群落水平上的构成特性能够成为植物宿主免受病原物侵染的第一道免疫防线[89]。若植株感染病害,则表明原本的根际微生物群落生态平衡被打破[10],如受疫霉菌感染患晚疫病的马铃薯根际土壤中细菌的多样性及丰度发生了改变[11];由尖孢镰刀菌草莓专化型病原菌引起的草莓枯萎病也会导致根际基质中真菌组成发生变化[12]。根结线虫病对烟草[13]、大豆[14]、茄子、番茄、苦瓜和黄瓜[15]根际微生物群落影响的研究相继被报道,但植物种类、地区气候、土壤理化性质和种植管理措施等均会影响根际微生物群落结构组成。因此,充分了解病害发生的作物根际微生物群落特征,有利于有针对性地改善根际土壤微生物群落结构组成,进而有效防控根结线虫,促进植物健康生长。
山东省寿光市是我国重要的蔬菜生产基地,被誉为“中国蔬菜之乡”。其蔬菜生产遭受根结线虫危害严重[16],因此,本研究通过高通量测序技术对该地区设施大棚中感病植株和健康植株的根表土和根围土中细菌、真菌的生物群落组成结构进行分析,旨在明确根结线虫危害对黄瓜根际微生物种类和丰度的影响,为改善作物根际土壤微生态环境以及研发环境友好型高效抑杀线菌剂提供理论依据。
1 材料与方法
1.1 供试材料
取样地位于山东省寿光市孙集镇南胡村的黄瓜种植大棚(36°50′18.7″N、 118°43′22.7″E,海拔32 m)。样地土壤pH 7.2,土壤有效氮、磷、钾含量分别为26.0、49.2 和108.3 mg·kg-1,有机质含量2.0%。黄瓜品种为津美85,嫁接砧木品种为白子瓜。于2020年7月黄瓜采收中后期,在同一大棚内采用平行线取样法选取受根结线虫危害严重(图1A)和未受危害的黄瓜根系(图1B)各9株,每3株混合成1个样本作为1个重复,每组3个重复。样品植株去除地上部分和根部大块土壤后,将分离的根围土(贴近根的轻微抖动能从根上脱落的土层)和根表土(贴附在根的表面上用无菌毛刷轻轻扫落的土层)分别过60目筛网,共得到4组样本,分别记作健康黄瓜根表土(JGB)、健康黄瓜根围土(JGW)、病害黄瓜根表土(BGB)和病害黄瓜根围土(BGW)。将获得的土壤样品及时装入无菌离心管内用液氮速冻,加干冰低温运送至上海美吉生物医药科技有限公司进行高通量测序。
1.2 土壤微生物高通量测序
采用DNA 提取试剂盒(E.Z.N.A.? Soil DNAKit)抽提样本中微生物群落总DNA,使用微量分光光度计以及1%琼脂糖凝胶电泳(电压5 V·cm-1,时间20 min)对提取DNA的纯度、浓度和完整性进行检测。分别使用引物338F(5-ACTCCTACGGGAGGCAGCA-3)/806R(5-GGACTACHVGGGTWTCTAAT-3)和ITS1F(5-CTTGGTCATTTAGAGGAAGTAA-3)/ITS2R(5-GCTGCGTTCTTCATCGATGC-3)对细菌16S rRNA基因的V3~V4可变区和真菌的ITS1区进行PCR扩增。PCR体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mmol·L-1dNTPs 2 μL,上游引物(5 μmol·L-1)0.8 μL,下游引物(5 μmol·L-1)0.8 μL, TransStart FastPfu DNA 聚合酶0.4 μL,模板DNA 10 ng,ddH2O补足至20 μL。PCR 程序为:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,27个循环;72 ℃ 10 min;最后扩增产物在4 ℃保存。扩增产物经2%琼脂糖凝胶电泳鉴定、AxyPrep DNA凝胶回收试剂盒纯化、微型荧光计定量与按照相应比例混合均一化后,使用建库试剂盒(NEXTFLEX? Rapid DNA-Seq Kit)构建文库,利用Illumina公司的Miseq PE300平台对构建的文库进行相对定量测序。
1.3 土壤微生物DNA 序列的优化和聚类
使用Fastp 软件(version 0.19.6)和Flash 软件(version 1.2.11)对原始测序序列进行质控、过滤、拼接,最终得到优化序列。使用Uparse 软件(version 7.0.1090)去除优化序列中没有重复的单序列,提取优化序列中的非重复序列,并按照97%的相似性将其进行可操作分类单元(operationaltaxonomic unit,OTU)聚类,在聚类过程中去除嵌合体,选取每个OTU中丰度最高的序列作为该OTU的代表序列,用于后续生物信息学分析。
1.4 土壤微生物多样性组成及差异性分析
基于最小样本序列数对OTU抽平,利用RDPclassifier 软件(version 2.11)通过比对Silva16S rRNA 数据库和Unite数据库,对每条序列进行物种分类注释,设置比对阈值为70%,分别在门和属水平上统计各样本的微生物群落组成。使用Mothur 软件(version 1.30.2)计算Chao 指数和Shannon 指数。使用R 语言(version 3.3.1)进行Beta 多样性分析,基于bray_curtis 距离计算距离矩阵,使用PCoA进行可视化展示。调用R语言中的stats包和Python语言中的scipy包分析不同组微生物群落组成及丰度差异。
1.5 数据分析
采用 SPSS 26.0 软件和R语言(version 3.3.1)进行数据统计分析,应用Wilcoxon秩和检验法和Kruskal-Wallis 秩和检验法检验组间差异显著性。
2 结果与分析
2.1 黄瓜根际土壤微生物高通量测序结果统计
将细菌原始测序序列进行优化后共得到500 450条序列,平均序列长度为436.98 bp,通过聚类分析得到2 037 个OUT,物种注释到35 门、78纲、158目、302科、565属、1 060种。样品土壤真菌測序序列优化后共得到781 135条序列,平均序列长度为262.69 bp,聚类分析得到689个OUT,物种注释到6 门、17 纲、46 目、99 科、189 属、301种。
2.2 根结线虫危害黄瓜与健康黄瓜根际土壤微生物群落Alpha 多样性差异
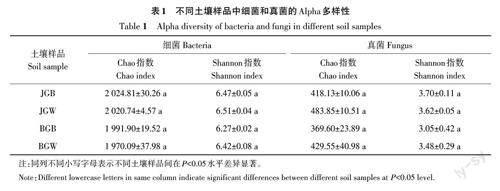
Alpha 多样性分析结果(表1)表明,JGB 和JGW样品中细菌和真菌的Chao指数和Shannon指数均高于BGB 和BGW 样品,表明JGB 和JGW 中微生物的丰度及多样性高于BGB和BGW,但差异均未达到显著水平。
2.3 根结线虫危害黄瓜与健康黄瓜根际土壤微生物群落Beta 多样性差异
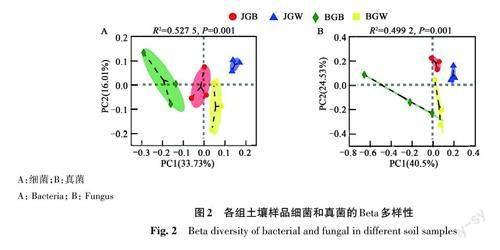
PCoA 分析结果表明,各组样品中细菌组成存在一定的分离趋势,且各组间的差异性显著大于组内的差异性(图2A),表明受根结线虫危害后的黄瓜根际土壤与健康黄瓜根际土壤中细菌群落结构的Beta多样性存在显著差异。土壤样品真菌群落分析结果(图2B)表明,4组土壤样品间真菌的多样性组成相似性较小,受根结线虫危害后黄瓜根际土壤与健康黄瓜根际土壤中的真菌群落结构的Beta多样性存在显著差异。
2.4 根结线虫危害黄瓜与健康黄瓜根际土壤微生物群落结构组成差异
2.4.1 根结线虫危害黄瓜与健康黄瓜根际土壤细菌群落结构组成的差异 在门水平上,以相对丰度大于1%为阈值,4组样品的细菌微生物群落组成相似(图3),均包含10个共有细菌门。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)均为各组样品中的优势细菌门,其中变形菌门占比最大,其在JGB中的相对丰度最高,为43.31%;放线菌门在BGW中的相对丰度最高,为19.46%;绿弯菌门和酸杆菌门在JGW 中的相对丰度分别为18.27% 和10.89%,高于其他组。拟杆菌门在各组中的相对丰度存在显著差异(P=0.038),其中在BGB 中的相对丰度最高,为13.58%;在JGB 和BGW 中次之,相对丰度分别为10.54%和8.90%;在JGW中的相对丰度最低,为6.25%。
在每种细菌属丰度达到1% 的前提下,健康和根结线虫危害的黄瓜根际土壤中细菌群落在属水平上的组成基本一致,均包含34 个属(图4)。其中鞘氨醇单胞菌属(Sphingomonas)为优势细菌属,在JGB中的相对丰度较高,为4.48%,高于其他组。
经差异显著性检验,有10个细菌属的相对丰度在4 组样品间存在显著差异(图5)。其中黄杆菌属(Flavobacterium)、假单胞菌属(Pseudomonas)、链霉菌属(Streptomyces)、根瘤菌属(Rhizobium)、德沃斯氏菌属(Devosia)、鞘氨醇杆菌属(Novosphingobium)、剑菌属(Ensifer)、纤维弧菌属(Cellvibrio) 和噬几丁质菌属(Chitinophaga)在BGB 中的相对丰度分别为3.62%、2.58%、1.93%、2.34%、1.14%、1.60%、1.30%、1.13%和1.59%,均高于其他组;黄色类固醇杆菌属(Steroidobacter)在JGB中相对丰度最高,为1.50%。
2.4.2 根结线虫危害黄瓜与健康黄瓜根际土壤真菌群落结构组成的差异 在以相对丰度1%的阈值条件下,各组土壤真菌在门水平上的群落组成相似(图6),均包含4个共有真菌门,其中子囊菌门(Ascomycota)为优势菌门,在各组中的相对丰度均达到81.00% 以上,在BGB 中最高,为88.38%;担子菌门(Basidiomycota)的相对丰度在各组间差异显著(P=0.031<0.05),在JGB 中的相对丰度最高(6.69%),其次是JGW(1.78%),在BGW和BGB中较低(1.03%和0.71%)。
以相对丰度不小于1%为阈值,4组土壤样品在属水平上包含27个共有真菌属(图7)。假埃希氏菌属(Pseudallescheria)和被孢霉属(Mortierella)为优势菌属,其中假埃希氏菌属在JGW中的相对丰度较高,为13.72%;被孢霉属在BGW中的相对丰度较高,为12.02%。对4组土壤样品间真菌群落在属水平上的组成差异进行显著性检验,发现7种真菌属在各组间存在显著差异(图8),其中假埃希氏菌属(Pseudallescheria)、毛壳菌属(Chaetomium)以及unclassified_ f_Bionectriaceae 在JGW 中相对丰度较高,为别为13.73%、11.00% 和4.62%;漆斑菌属(Myrothecium)和unclassified_ f_Ceratobasidiaceae 在JGB中的相对丰度较高,分别为7.51%和4.18%;绿僵菌属(Metarhizium)的相对丰度在BGW中较高,为3.99%;棒孢菌属(Corynespora)在BGB中的相对丰度较高,为2.64%。
3 讨论
构成植物根际功能核心的根际微生物在植物生长发育过程中发挥重要作用,被看作是植物的第二基因组,已逐渐成为促进农业绿色发展关键调控区域[17]。本研究通过比较根结线虫危害和健康黄瓜的根际土壤发现,健康根表土、健康根围土、病害根表土、病害根围土4组土壤样品中细菌和真菌的群落组成多样性无显著差异,在一定阈值范围内,4组土壤样品无论是细菌还是真菌在门和属水平上的群落结构组成均相似,但同类群在不同组间的相对丰度存在差异,与前人研究结果一致[18]。
4 组土壤样品中的优势细菌门均为变形菌门、放线菌门、绿弯菌门、拟杆菌门和酸杆菌门,其中绿弯菌门和酸杆菌门在健康黄瓜根际土壤中的相对丰度较高。绿弯菌门参与重要的生物地球化学循环过程,能够降解有机污染物和改善环境,包含多种营养代谢方式,并可以在不同的环境条件下进行切换,其中一些类群产生的次级代谢产物具有一定的抗菌效果[19]。酸桿菌门的细菌具有产抗生素、抗真菌药物、抗病毒药物等次生代谢物基因[20],在植物生长过程中发挥着重要的生态作用。
本研究中放线菌门和拟杆菌门在病害植株的根围土和根表土中的相对丰度较高。研究表明,受根结线虫侵害的苦瓜、茄子和番茄的根际土壤中放线菌的相对丰度高于未侵染土壤[15],与本研究结果相似。据报道,放线菌及其代谢产物对植物病原菌和病虫害具有较强的拮抗作用[21],但Wang等[22]研究发现,植物根际土壤中存在对根结线虫具有吸引作用的放线菌,特殊的植物根系微生物有助于线虫寻找寄主植物。本研究中受侵害黄瓜根围土中的放线菌种类及具有生物活性的代谢产物还需进一步分离鉴定。
研究表明,抗病虫的栽培基质中黄色类固醇杆菌属为优势菌属[23]。本研究结果也表明,健康黄瓜根表土中黄色类固醇杆菌属的相对丰度较高;而黄杆菌属、假单胞菌属、链霉菌属、根瘤菌属、德沃斯氏菌属、鞘氨醇杆菌属、剑菌属、纤维弧菌属和噬几丁质菌属在受根结线虫侵染的黄瓜植株根表土中的相对丰度较高。研究表明,黄杆菌属和噬几丁质属对病原体的侵害具有一定的抵抗作用[24]。假单胞菌、链霉菌及其代谢产物均对根结线虫具有一定的抑制作用[25]。根结线虫和根瘤菌属、德沃斯氏菌属、鞘氨醇杆菌属和纤维弧菌属存在互利共生的关系[26]。多数剑菌属是从固氮根瘤中分离得到,属于固氮菌,根结线虫侵入的伤口可能为这类细菌的生长提供了有利条件[27]。
本研究结果表明,健康和受侵害黄瓜根际的真菌群落中均以子囊菌门为优势菌门,而担子菌门的相对丰度在4组处理间存在显著差异,其中在健康黄瓜根际土中的相对丰度较高。研究表明,在根结线虫侵染的马铃薯根际土壤中,担子菌门的相对丰度有所增加[28],表明担子菌门可能在一定程度上起到抵抗线虫的作用。本研究中假埃希氏菌属、毛壳菌属和漆斑菌属在健康植株根际土中的相对丰度较高。研究表明,假埃希氏菌属在受根结线虫危害的番茄根际土中的相对丰度较低[13];由球形毛壳菌产生的代谢物质能够降低棉花黄萎病的病情指数,提高棉花产量[29];漆斑菌属对引起烟草根病的腐霉菌和立枯丝核菌的抑制率达到50%以上[30];疣孢漆斑菌产生的代谢活性物质能够抑杀根结线虫[31]。本研究表明,绿僵菌属和棒孢菌属在病害植株根际土中的相对丰度较高。Huang等[13]研究发现,绿僵菌属在受根结线虫危害的根际土中的相对丰度显著增加。棒孢菌属是植物致病菌,会引起植物叶枯病[32]。
综上,在受根结线虫危害后的黄瓜根表土和根围土中,黄杆菌属、假单胞菌属、链霉菌属、噬几丁质属、根瘤菌属、德沃斯氏菌属、鞘氨醇杆菌属、剑菌属和纤维弧菌属的细菌以及绿僵菌属和棒孢菌属的真菌相对丰度显著升高。在健康黄瓜植株根表土和根围土中,黄色类固醇杆菌属细菌和假埃希氏菌属、毛壳菌属和漆斑菌属的真菌相对丰度较高。这些差异微生物的生理活动是否对植物健康生长产生影响还有待进一步对菌种进行分离纯化和鉴定培养研究。
参 考 文 献
[1] 金娜,陈永攀,刘倩,等.我国蔬菜根结线虫发生、致害和绿
色防控研究进展[J].植物保护学报,2022,49(1):424-438.
JIN N, CHEN Y P, LIU Q, et al .. Research progresses in
occurrence, diagnoses, pathogenic mechanisms and integrated
management of vegetable root-knot nematodes in China [J]. J.
Plant Prot., 2022, 49(1):424-438.
[2] 王从丽,李春杰,胡岩峰.利用Pluronic三维胶系统研究植物
寄生線虫的趋化性[J].土壤与作物,2016,5(1):1-13.
WANG C L, LI C J, HU Y F. Pluronic gel system: an approach
to investigate chemotaxis of plant parasitic nematodes [J]. Soils
Crops, 2016, 5(1):1-13.
[3] 路雪君,廖晓兰,成飞雪,等. 根结线虫的生物防治研究进
展[J].中国农业科技导报,2010,12(4):44-48.
LU X J, LIAO X L, CHENG F X, et al .. Research progress in
bio-control of Meloidogyne [J]. J. Agric. Sci. Technol., 2010,
12(4):44-48.
[4] 彭德良.植物线虫病害:我国粮食安全面临的重大挑战[J].
生物技术通报,2021,37(7):1-2.
PENG D L. Plant nematode diseases: serious challenges to
Chinas food security [J]. Biotechnol. Bull., 2021, 37(7):1-2.
[5] LI H, SU J Q, YANG X R, et al .. Distinct rhizosphere effect on
active and total bacterial communities in paddy soils [J]. Sci.
Total Environ., 2019, 649:422-430.
[6] ZHANG B H, HONG J P, ZHANG Q, et al .. Contrast in soil
microbial metabolic functional diversity to fertilization and
crop rotation under rhizosphere and non-rhizosphere in the
coal gangue landfill reclamation area of Loess Hills [J/OL].
PLoS One, 2020, 15(3):e0229341 [2022-09-02]. https://doi.org/
10.1371/journal.pone.0229341.
[7] 连文慧,董雷,李文均.土壤环境下的根际微生物和植物互作
关系研究进展[J].微生物学杂志,2021,41(4):74-83.
LIAN W H, DONG L, LI W J. Advances in rhizosphere
microorganism and plant interaction in soil environment [J]. J.
Microbiol., 2021, 41(4):74-83.
[8] VANNIER N, AGLER M, HACQUARD S. Microbiotamediated
disease resistance in plants [J/OL]. PLoS Pathogens,
2019, 15(6): e1007740 [2022-09-02]. https://doi. org/10.1371/
journal.ppat.1007740.
[9] NWOKOLO N L, ENEBE M C, CHIGOR C B, et al .. The
contributions of biotic lines of defence to improving plant
disease suppression in soils: a review [J/OL]. Rhizosphere,
2021, 19: 100372 [2022-09-02]. https://doi.org/10.1016/j.
rhisph.2021.100372.
[10] LI H, MA X, TANG Y Q, et al .. Integrated analysis reveals an
association between the rhizosphere microbiome and root rot of
arecanut palm [J]. Pedosphere, 2021, 31(5):725-735.
[11] 李华伟,罗文彬,许国春,等.基于高通量测序的福建北部马
铃薯晚疫病株根际土壤细菌群落分析[J]. 微生物学通报,
2022,49(3):1017-1029.
LI H W, LUO W B, XU G C, et al .. High-throughput
sequencing of bacterial community in the rhizosphere soil of
potato infected by late blight in northern Fujian province [J].
Microbiol. China, 2022, 49(3):1017-1029.
[12] 唐冬蘭,唐泉,蒋立奔,等.草莓枯萎病病株与健株根际基质
真菌群落组成分析[J].江苏农业科学,2021,49(24):110-114.
TANG D L, TANG Q, JIANG L B, et al .. Fungal community
composition of rhizosphere matrix of strawberry fusarium wilt
isolates and healthy isolates [J]. Jiangsu Agric. Sci., 2021,
49(24):110-114.
[13] HUANG K, JIANG Q P, LIU L H, et al .. Exploring the key
microbial changes in the rhizosphere that affect the occurrence
of tobacco root-knot nematodes [J/OL]. AMB Express, 2020,
10(1):6 [2022-09-02]. https://doi.org/10.1186/S13568-020-01006-6.
[14] TOJU H, TANAKA Y. Consortia of anti-nematode fungi and
bacteria in the rhizosphere of soybean plants attacked by rootknot
nematodes [J/OL]. R. Soc. Open Sci., 2019, 6: 332403
[2022-09-02]. https://doi.org/10.1101/332403.
[15] ZHOU D M, FENG H, SCHUELKE T, et al .. Rhizosphere
microbiomes from root knot nematode non-infested plants
suppress nematode infection [J]. Microb. Ecol., 2019, 78(2):
470-481.
[16] 金晟,朴成淳,商照聪,等.山东省寿光市设施蔬菜大棚土壤
质量调查与评价——亲土在线-农业土壤治理大数据平台
(上)[J].肥料与健康,2020,47(2):22-26.
JIN S, PIAO C C, SHANG Z C, et al .. Investigation and
evaluation of soil quality of vegetable greenhouses in
Shouguang city, Shandong province- pro-soil online-big data
platform for agricultural soil remediation (Part Ⅰ) [J]. Fert.
Health, 2020, 47(2):22-26.
[17] 张福瑞.根际微生物:农业绿色发展中大有作为的植物第二
基因组[J].生物技术通报,2020,36(9):1-2.
ZHANG F R. Rhizosphere microorganisms: the second genome
of plants that play an important role in the green development of
agriculture [J]. Biotechnol. Bull., 2020, 36(9):1-2.
[18] 张仁军,陈雅琼,张洁梅,等.健康与根结线虫病烟田根际土
壤微生物群落对比分析[J]. 中国农学通报,2021,37(26):
124-132.
ZHANG R J, CHEN Y Q, ZHANG J M, et al .. Comparative
analysis of microbial communities in rhizosphere soil of
healthy and root-knot nematodes-infected tobacco fields [J].
Chin. Agric. Sci. Bull., 2021, 37(26):124-132.
[19] 鲜文东,张潇橦,李文均.绿弯菌的研究现状及展望[J].微生
物学报,2020,60(9):1801-1820.
XIAN W D, ZHANG X T, LI W J. Research status and
prospect on bacterial phylum Chloroflexi [J]. Acta Microbiol.
Sin., 2020, 60(9):1801-1820.
[20] KALAM S, BASU A, AHMAD I, et al .. Recent understanding
of soil acidobacteria and their ecological significance: a critical
review [J/OL]. Front. Microbiol., 2020, 11:580024 [2022-09-
02]. https://doi.org/10.3389/fmicb.2020.580024.
[21] KAUR T, JASROTIA S, OHRI P, et al .. Evaluation of in vitro
and in vivo nematicidal potential of a multifunctional
streptomycete, Streptomyces hydrogenans strain DH16 against
Meloidogyne incognita [J]. Microbiol. Res., 2016, 192:247-252.
[22] WANG P Y, SUN Y, YANG L L, et al .. Chemotactic responses
of the root-knot nematode Meloidogyne incognita to
Streptomyces plicatus [J/OL]. FEMS Microbiol. Lett., 2019,
366(19): fnz234 [2022-09-02]. https://doi.org/10.1111/j.1574-
6968.2019.fnz234.
[23] KUMAR A, PANWAR A S, RANA B, et al .. Bacterial
community structure analysis of soil treated with Parthenium
hysterophorus L. derived green medium [J]. Plant Sci. Today,
2020, 7(2):281-287.
[24] CARRI?N V J, PEREZ-JARAMILLO J, CORDOVEZ V, et al ..
Pathogen-induced activation of disease-suppressive functions
in the endophytic root microbiome [J]. Science, 2019, 366
(6465):606-612.
[25] MOSLEHI S, POURMEHR S, SHIRZAD A, et al .. Potential of
some endophytic bacteria in biological control of root-knot
nematode Meloidogyne incognita [J/OL]. Egypt. J. Biol. Pest
Control, 2021, 31(1): 4 [2022-09-02]. https://doi.org/10.1186/
s41938-021-00396-4.
[26] 曹毅.受根結线虫侵染的烟草根际细菌群落特征及南方根
结线虫伴生细菌多样性研究[D].昆明:云南大学,2015.
CAO Y. Characteristics of rhizobacterial community to rootknot
nematode infected tobacco and diversity of bacterial flora
associated with Meloidogyne incongnita [D]. Kunming:
Yunnan university, 2015.
[27] NATHALIE D, ERIK S, C?LINE P, et al .. Permanent draft
genome sequence of Ensifer sp. strain LCM 4579, a salttolerant,
nitrogen-fixing bacterium isolated from senegalese
soil [J/OL]. Genome Announce., 2017, 5(14):e00117-17 [2022-
09-02]. https://doi.org/10.1128/genomea.00117-17.
[28] 张丽芳,李艳琼,蔡建,等.高通量测序分析根结线虫对马铃
薯根际土壤真菌群落多样性的影响[J].福建农业学报,2021,
36(8):936-941.
ZHANG L F, LI Y Q, CAI J, et al .. High-throughput
sequencing on fungal diversity in potato rhizosphere soil
infested by root-knot nematodes [J]. Fujian J. Agric. Sci., 2021,
36(8):936-941.
[29] ZHANG Y, ZHU H Q, YE Y H, et al .. Antifungal activity of
chaetoviridin A from Chaetomium globosum CEF-082
metabolites against Verticillium dahliae in cotton [J]. Mol.
Plant-Microbe Interact., 2021, 34(7):758-769.
[30] 王家和.烟草根病拮抗真菌的分离与筛选[J].中国生物防
治,1998,14(1):28-31.
WANG J H. Isolation and screening of antagonistic fungi
against tobacco root diseases [J]. Chin. J. Biol. Control, 1998,
14(1):28-31.
[31] 董海龙,王海香,张作刚,等.抑杀根结线虫的疣孢漆斑菌代谢
活性物质的分离鉴定[J].植物保护学报,2019,46(3):721-722.
DONG H L,WANG H X, ZHANG Z G, et al .. Isolation and
identification of nematicidal active substances from the soil
fungus Myrothecium verrucaria metabolites [J]. J. Plant Prot.,
2019, 46(3):721-722.
[32] LI B X, YANG Y, CAI J M, et al .. Genomic characteristics and
comparative genomics analysis of two Chinese Corynespora
cassiicola strains causing Corynespora leaf fall (CLF) disease [J].
J. Fungi, 2021, 7(6):485-485.
(责任编辑:张冬玲)
