八仙花‘Bailmer’花萼和叶片内铝离子的动态变化
2023-04-18褚志云祁惠李颖万一兵任志雨刘春袁素霞
褚志云 祁惠 李颖 万一兵 任志雨 刘春 袁素霞


摘要:八仙花(Hydrangea macrophylla)是极具观赏价值的铝积累植物。铝离子作为八仙花花色调控的必要元素之一,对其蓝色花形成和植株的生长发育具有十分重要的作用。以‘Bailmer为试验材料,确定其最适生长温度,并研究其体内铝离子的动态变化。结果表明,23 ℃有利于‘Bailmer的生长发育及叶片和萼片对铝离子的吸收;花萼和叶片中铝离子含量的动态变化基本类似,均呈先上升、再下降、再上升的趋势;花萼与叶片的铝离子吸收速率均在前期迅速上升,在12 h时达到最大,而后又迅速降低,并趋于稳定。研究结果为八仙花花色调控奠定了理论基础。
关键词:八仙花‘Bailmer;温度;铝离子吸收速率;动态变化doi:10.13304/j.nykjdb.2021.1110
中图分类号:S682 文献标志码:A 文章编号:10080864(2023)01006507
八仙花(Hydrangea macrophylla)别名绣球、紫阳花,属虎耳草科八仙花属植物,原产于东南亚,主要分布在中国和日本[1]。八仙花喜阴湿、惧旱涝,因其具有花序大、颜色丰富艳丽、病虫害相对较少及养护难度低等特点,在盆栽、切花和园林绿化等方面均有应用,具有广阔的市场前景。八仙花种类繁多,目前全世界已有600多个品种[2]。近年来,随着八仙花新品种的不断推出,品种总量持续增加,市场占有率逐步提升。
花色是八仙花重要的观赏性状,目前主要有白色、粉色、红色、紫色和蓝色等[3]。其中,蓝色更受消费者的青睐,但蓝色花在自然界中并不存在,是由人工栽培调控而成的。现阶段八仙花栽培过程中,最难解决的问题就是蓝色花的调控。在诸多调控因素中,铝离子是关键因素之一。八仙花蓝色花萼中铝离子的含量显著高于红色花萼[4];不同花色萼片中,红色花萼中铝离子含量范围为0~10 μg·g-1 FW(鲜重,fresh weight)、紫色花萼为10~40 μg·g-1 FW,而蓝色花萼则大于40 μg·g-1FW[5]。由此可见,铝离子含量与八仙花蓝色花色形成有一定的关联性。
铝离子含量在植株体内的动态变化受多种因素影响,其中温度是影响植株体内铝离子吸收的重要因素之一。在水稻和番茄研究中发现,植株体内的铝离子含量随温度上升而递增,温度越高植株的生长状态越差,所受到的铝毒害就越严重[6]。同样,高温也促进了玉米植株对铝离子的吸收[7]。另外,植株体内的铝离子含量也会随外源铝离子处理时间的变化而变化,外源铝离子处理不同时间段植株对铝离子的吸收速率也不同。研究发现,低水平铝离子处理大豆根系,前期细胞内和根尖分生组织中的铝离子含量会随着铝离子处理时间的增加而增加[8]。莴苣、甘蓝、狼尾草的根对铝离子的吸收过程可以分为前期快速吸收(60 min)阶段和后期呈线性或微曲线性吸收阶段[9]。
八仙花作为观赏价值较高的植物,其铝富集的特性受到越来越多的关注,相关研究主要侧重于铝离子在八仙花不同器官、细胞中的分布以及在体内的存在形式等方面[10-12]。本研究针对环境温度和外源铝离子处理时间与八仙花植株体内铝离子含量之间的相关关系进行研究,明确八仙花生长和铝吸收的最适温度,以及八仙花植株体内铝离子吸收量和吸收速率的动态变化,以期为八仙花栽培生产中花色调控研究奠定理论基础和实践指导。
1 材料与方法
1.1 试验材料
供试八仙花品种为‘Bailmer( 美国,US2004123356P1),种植于中国农业科学院蔬菜花卉研究所南区。扦插苗上盆至盆口径15 cm、高度12 cm的花盆中,置于人工气候箱(MGC-450HP,上海谱振生物有限公司)进行培养,光照周期(光/暗)为16 h/ 8 h,光照强度均为8 000~12 000 lx,相对湿度均为80%。
1.2 环境温度设置
待扦插苗生长至现蕾时,挑选长势一致的植株,每盆施6 g Al2(SO4)3·18H2O,并将其移至不同温度条件的人工气候箱中,随后进行正常的水肥管理,培养30 d后,测定花萼和叶片铝离子含量及叶片荧光参数和植株营养生长指标。人工气候箱温度分别设置为恒温18、23、28 ℃,以23 ℃、不施铝为对照组(CK)。每个处理设置3个重复,每个重复3盆,每盆1株。
1.3 外源铝处理时间设置
待扦插苗培养至花萼进入着色期,挑选长势一致的植株进行施铝处理,每盆6 g Al2(SO4)3 ·18H2O,选择最佳的生长温度作为培养条件,分别在施铝后1、4、8、12、24 h和2、3、5、8、11、15 d取样,每个处理设置3个重复,每个重复3盆。在不同时间段对植株的花萼和叶片分别取样以测定铝离子含量,并计算铝离子吸收速率。
C =Mn ± Mn - 1/t (1)
式中,C 为铝离子吸收速率;Mn为第n 个取样点的铝离子吸收量;Mn-1为第n-1个取样点的铝离子吸收量;t 为相邻2个取样点的时间差。
1.4 指标测定
1.4.1 营养生长指标测定 在人工气候箱中培养30 d后,用游标卡尺(DL91150,得力)测定株高、茎粗、葉长、叶宽、花径。
1.4.2 荧光参数测定 采用荧光仪(LI-6400XT,美国LI-COR)测定植株茎秆中部叶片的叶绿素荧光参数、初始荧光 (minimal fluorescence,Fo)、最大荧光产量(maximal fluorescence,Fm)、原初光能效率(optimal/maximal photochemical quantumyield of PSⅡ,Fv/Fm)、实际光化学量子效率(actualphotochemical efficiency in photosystem Ⅱ ,ФPS Ⅱ )、光化学淬灭系数(photochemicalquenching,qP)、PSⅡ处非调节性能量耗散的量(non-adjusting energy dissipation quantum yield,NO)、PS Ⅱ 处调节性能量耗散的量(nonphotochemicalquenching,NPQ)。
1.4.3 铝离子含量测定 用ICP-OES法[13]测定样品中的铝离子含量。称取5 g鲜样放于玻璃消解器皿,向消解器皿中加入7~8 mL硝酸高氯酸(体积比4∶1)混合溶液,置于电热板上进行消解反应,待消解器皿中的溶液冒白烟,消化液呈无色透明或略带黄色,冷却,用蒸馏水定容至25 mL,混匀过滤后上机测定。
1.5 数据处理与分析
所有数据用Excel 2010 整理,用Origin 2019作图。使用SPSS Statistics 20.0进行单因素方差分析(One Way-ANOVA),采用Duncan法多重比较。
2 结果与分析
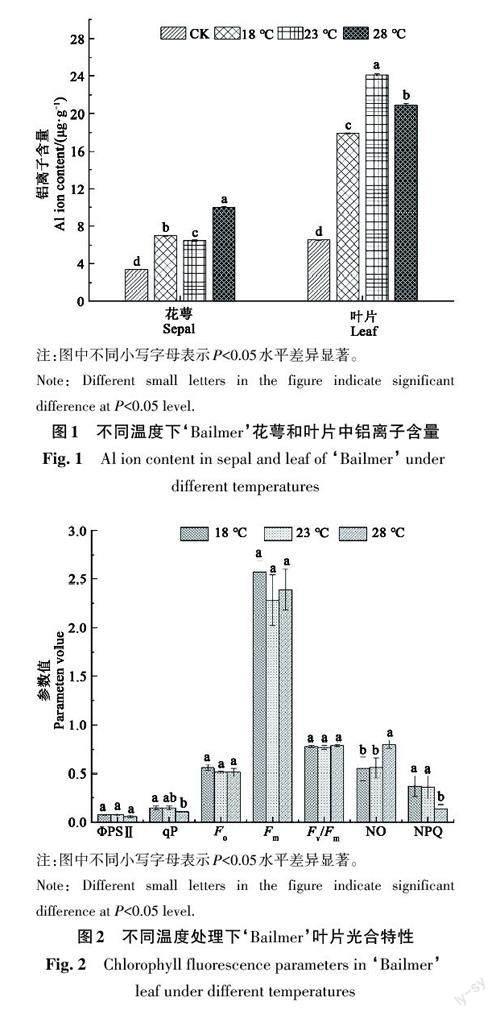
2.1 温度对‘Bailmer花萼和叶片中铝离子含量的影响
施铝处理组的铝离子含量在花萼和叶片中均显著高于对照;在施铝处理条件下,不同温度对铝离子吸收的影响差异显著(图1)。在花萼中,28 ℃条件下铝离子含量最高,为9.98 μg·g-1,其次是18 ℃,23 ℃时含量最低(6.43 μg·g-1);而在叶片中,铝离子含量表现为23 ℃处理>28 ℃处理>18 ℃处理,分别为24.13、20.89、17.94 μg·g-1。不论是在花萼还是叶片中,不同环境温度处理下铝离子含量均呈显著差异,其中28 ℃最适合花萼中的铝离子积累,23 ℃最适合叶片中的铝离子积累。
2.2 温度对‘Bailmer叶片叶绿素荧光参数的影响
由图2 可知,植株叶片的叶绿素荧光参数ФPSⅡ、Fo、Fm、Fv/Fm 在3种温度条件下均显著不差异(P>0.05);qP和NPQ在18 ℃ 时,均显著高于28 ℃时,但均与23 ℃时差异不显著;NO在28 ℃时显著高于18 ℃和23 ℃处理,但在18 ℃和23 ℃时无显著差异。由此可见,在3种环境温度条件下,叶片的叶绿素荧光参数差异不显著,但是,在28 ℃条件下,光损伤较为严重。
2.3 温度对‘Bailmer生长发育指标的影响
表1结果显示,平均株高和叶宽在不同温度条件下均差异不显著;平均茎粗、叶长、花径在23 ℃处理下分别为5.05 、120.08、93.00 mm,均显著高于其他温度处理。由图3可以看出,28 ℃条件下植物长势较差,且植株在生长过程中出现严重的叶片卷曲和叶边缘焦叶现象。因此,23 ℃最有利于‘Bailmer的生长发育。
2.4 铝处理后‘Bailmer花萼和叶片中铝离子含量的动态变化
综合考虑温度对‘Bailmer花萼和叶片中铝离子含量及叶片叶绿素荧光参数和生长势的影响,发现23 ℃最有利于植株的生长发育以及其对铝离子的吸收。因此,在23 ℃条件下研究外源铝处理下‘Bailmer花萼和叶片中铝离子含量的动态变化。结果(图4)显示,花萼和叶片中的铝离子含量在外源铝离子处理后1 h时均最低,分别为2.20、5.77 μg·g-1,而后迅速增加;花萼中的铝离子含量在外源铝离子处理12 h 时达到最高,为10.90 μg·g-1,随后逐渐下降,在5 d 后又开始上升;叶片中的铝离子含量在2 d时出现了一个高峰,随后也出现了下降、再上升,在11 d时达到最高峰,为16.7 μg·g-1,之后趋于稳定。由此可见,花萼和叶片中铝离子含量随时间的变化趋势基本类似,均呈先上升、再下降、再上升的趋势。
2.5 外源铝离子对‘Bailmer花萼和叶片中铝离子吸收速率的影响
在整个取样时间内,花萼和叶片中铝离子的吸收速率变化幅度均较大,但二者的总体趋势一致。均在前期迅速升高,同时在12 h时达到最大值,分别为1.63和0.80 μg·g-1·h-1,而后均迅速降低,并于24 h后趋于稳定(图5)。
3 讨论
温度对植物形态建成和营养元素的吸收具有重要的影响,适宜的温度是植物良好发育的必备条件,番茄(Solanum lycopersicum L.) 幼苗在(33±3) ℃下生长速度最快[14];Skalova等[15]研究发现,豚草(Ambrosia artemisiifolia L.)的种苗在26 ℃处理下最有利于植株生长;另外,20 ℃最有利于晚香玉(Polianthes tuberosa L.)花形态建成[16]。本研究发现,23 ℃最有利于八仙花‘Bailmer的生长发育,本课题组在之前的研究中也得出了类似的结论[17]。植株对温度的响应机制也会通过光合作用来体现,而光合作用又可以用叶绿素荧光参数来反映。qP反映了原初电子受体QA的氧化还原程度和光下反应中心的开放程度;Fv/Fm代表了植物的光合效率;NO 反映的是被动的耗散为热量和发出荧光的能量,是光损伤的重要指标;NPQ 则是通过调节性的光保护机制耗散为热的能量,是光保护的重要指标[18]。Haldimann等[19]证实,玉米叶片在受到温度胁迫后会导致qP下降。
在本研究中,28 ℃条件下八仙花‘Bailmer叶片的qP 和NPQ 最低、NO 最高,说明28 ℃对八仙花‘Bailmer已经造成一定的高温胁迫,导致光损伤。
八仙花是铝积累植物[20],铝离子在植株体内的积累受多种因素的影响。本研究发现,不同温度条件下八仙花对铝离子的吸收差异显著,在23 ℃条件下叶片中铝离子含量最高,这与前人研究温度对不同作物(水稻、大豆、大麦、番茄)铝毒害的影响的结果一致,均发现在植株的最适生长环境温度条件下铝离子积累量最高[67]。推测可能是因为23 ℃ 处于‘Bailmer的最适生长环境温度,在此条件下植株根系生长良好、各项生理机能活跃、铝吸附位点较多,进而促进了铝离子的吸收。另外,Shen等[21]研究表明,高温胁迫导致叶片气孔打开程度减小,蒸腾效应随之下降,进而影响植物对水分的需要和营养元素的吸收。在本研究中,叶片在28 ℃条件下的铝离子含量低于23 ℃,这一结果可能与高温下叶片蒸腾效率较低,进而影响了植株对铝离子的吸收。而花萼中的铝离子含量在28 ℃条件下最高,这可能与高温促进了铝离子的长距离运输有关,因为植物对铝的吸收以被动吸收为主并随质流上移到地上部。尽管28 ℃有利于花萼对铝离子的吸收,但是该温度下植株长势最差。综合考虑,在栽培生产中,应在八仙花‘Bailmer的最佳生长温度进行铝离子处理,不仅有利于八仙花‘Bailmer植株的生长发育,也较有利于植株对铝离子的吸收。本研究对八仙花‘Bailmer在外源铝离子处理后不同时间的花萼和叶片进行铝离子含量测定,结果发现,植株体中的铝离子含量在前期迅速升高,但达到一定水平后铝离子含量开始降低,随着处理时间延长铝离子含量又开始升高并達到饱和。这可能是由于铝离子进入植株体内导致植株根系分泌有机酸 [22]。在植株耐铝机理中有机酸的分泌起着十分重要的作用。根系分泌有机酸与铝离子螯合,从而减少铝离子的进入,减轻铝的毒性。Ma[23]发现,八仙花对铝胁迫的反应有明显滞后期,铝处理数小时后才有明显的有机酸分泌。另外,植株对铝元素的吸收属于被动吸收,可以将膜外高水平的铝扩散透过细胞膜进入膜内,也可以借助载体与铝的结合,由细胞内外之间的电化学势来推动。由此推断,本研究处理前期,相邻时间较为密集,植株生物量变化不大,而‘Bailmer植株在铝处理数小时后才明显分泌有机酸,在大量分泌有机酸之前膜内外铝离子浓度差大,电化学势大,因此,铝离子含量在前期快速增加,吸收速率迅速上升。随着时间的增加以及取样时间间隔的加大,植株生物量迅速增加,在此过程中,有机酸的分泌增多,并在植物根区与铝离子鳌合,减少铝离子进入细胞的量,膜内外铝离子浓度差基本持平,细胞内外电化学势达到平衡,导致植株对铝离子的吸收速率慢于生物量的增加速度,发生‘稀释效应,进而引发铝离子含量的不断降低。当时间间隔达到一定时长时,植株生物量不再增加,但对铝离子的吸收还在继续,使得植株体内铝离子含量再一次升高并达到植株所能承受的最大积累量。
由于铝离子是八仙花蓝色花形成的必要因素之一,因此生产中蓝色花的形成必需通过人工调控土壤环境才能获得。但是生产中八仙花蓝色花的调控技术并不成熟,主要是因为外源铝的施用时期与施用量以及土壤中铝的利用率尚不完全清晰。通过本研究发现,23 ℃ 较利于八仙花‘Bailmer植株吸收;花萼和叶片中铝离子含量随时间的变化趋势基本类似,均是先上升、再下降、再上升的趋势;花萼与叶片的铝离子吸收速率均在12 h时达到最大,而后迅速降低,并趋于稳定。本研究明确了外源铝被植株吸收的最佳温度条件,并阐明了外源铝离子在八仙花植株叶片和萼片中的铝含量及吸收速率的动态变化,为生产上八仙花花色调控中的施铝环境条件和时期提供了一定的理论依据。
参考文献
[1] 彭尽晖,周朴华,周红灿,等.湖南省绣球属植物资源调查[J].
湖南农业大学学报(自然科学版),2008,34 (5):563-567.
PENG J H, ZHOU P H, ZHOU H C, et al .. Investigation on
Hydrangea resource in Hunan province [J]. J. Hunan Agric.
Univ. (Nat. Sci.), 2008, 34 (5): 563-567.
[2] 曾奕,杨伟权,郁书君.绣球花的育种研究进展[J].广东农业
科学,2018,45 (6):36-43.
ZENG Y, YANG W Q, YU S J. Research progress of
Hydrangea breeding [J]. Guangdong Agric. Sci., 2018, 45 (6):
36-43.
[3] 刘焕新.八仙花的花色调控[J].天津农林科技,2004 (5):21.
LIU H X. The regulation of flower colour in Hydrangea
macrophylla [J]. Sci. Technol. Tianjin Agric. Forestry, 2004 (5): 21.
[4] ITO D, SHINKAI Y, KATO Y, et al .. Chemical studies on
different color development in blue-and red-colored sepal cells
of Hydrangea macrophylla [J]. Biosci. Biotechnol. Biochem.,
2009, 73 (5): 1054-1059.
[5] SCHREIBER H D, JONES A H, LARIVIERE C M, et al .. Role
of aluminum in red-to-blue color changes in Hydrangea
macrophylla sepals [J]. BioMetals, 2011, 24 (6): 1005-1015.
[6] 顧明华,陆申年,白厚义,等.铝毒在不同作物上的差异及温
度的影响[J].热带亚热带土壤科学,1994,(2):59-65.
GU M H, LU S N, BAI H Y, et al .. The difference of aluminum
toxicity in different crops and the effect of temperature [J].
Trop. Subtrop. Soil Sci., 1994 (2): 59-65.
[7] WAGATSUMA T. Effect of non-metabolic conditions on the
uptake of aluminum by plant roots [J]. Soil Sci. Plant Nutr.,
1983, 29 (3):323-333.
[8] SILVA I R, SMYTH T J, MOXLEY D F, et al .. Aluminum
accumulation at nuclei of cells in the root tip. Fluorescence
detection using lumogallion and confocal laser scanning
microscopy [J]. Plant Physiol., 2000, 123 (2): 543-552.
[9] HUETT D O, MENARY R C. Aluminium Uptake by Excised
Roots of Cabbage, Lettuce and Kikuyu Grass [J]. Funct. Plant
Biol., 1979, 6 (6): 643-653.
[10] NAUMANN A, HORST W J. Effect of aluminium supply on
aluminium uptake, translocation and blueing of Hydrangea
macrophylla (Thunb.) Ser. cultivars in a peatclay substrate [J].
J. Hortic. Sci. Biotechnol., 2003, 78 (4): 463-469.
[11] HOTTA H, WANG Q, FUKUDA M, et al .. Identification of
aluminum species in an aluminum-accumulating plant,
hydrangea (Hydrangea macrophylla), by electrospray ionization
mass spectrometry [J]. Anal. Sci., 2008, 24 (6): 795-798.
[12] ITO T, AOKI D, FUKUSHIMA K, et al .. Direct mapping of
Hydrangea blue-complex in sepal tissues of Hydrangea
macrophylla [J/OL]. Sci. Rep., 2019, 9 (1): 5450 [2022-05-20].
https://doi.org/10.1038/s41598-019-41968-7.
[13] 杨锁宁. 基质pH、铝离子对八仙花花色形成的调控机
理[D].银川:宁夏大学,2020.
YANG S N. The study on the mechanism of substrate pH and
Al3+ regulating sepal color formation in Hydrangea
macrophylla [D].Yinchuan: Ningxia University, 2020.
[14] 赵玉萍,邹志荣,白鹏威,等.不同温度对温室番茄生长发育
及产量的影响[J]. 西北农业学报,2010,19 (2):133-137.
ZHAO Y P, ZHOU Z R, BAI P W, et al .. Effect of different
temperature on the growth and yield of tomato in greenhouse [J].
Acta Agric. Boreali-occident. Sin., 2010, 19 (2): 133-137.
[15] SKALOVA H, MORAVCOVA L, DIXON A F G, et al .. Effect
of temperature and nutrients on the growth and development of
seedlings of an invasive plant [J]. Food Chem., 2016, 202:
184-188.
[16] HUANG K L, MIYAJIMA I, OKUBO H. Effects of temperature
and shade treatment on flower colors and characteristics in
newly established reddish-purple tuberose(Polianthes) [J]. J.
Faculty Agric. Kyushu Univ., 2000, 45 (1): 57-63.
[17] 杨锁宁,张黎,刘春,等.温度和土壤酸度对八仙花‘Bailmer
生长发育的影响[J].中国农业科技导报,2020,22 (5):24-34.
YANG S N, ZHANG L, LIU C, et al .. Influences of temperature
and soils acidity on the growth and development of Hydrangea
macrophylla ‘Bailmer [J]. J. Agric. Sci. Technol., 2020,
22 (5): 24-34.
[18] 杨彬,金小青,陈修斌.温度对龙葵幼苗叶绿素含量和荧光参
数的影响[J].安徽农业科学,2018,4605:56-57,72.
YANG B, JIN X Q, CHEN X B. Effects of different
temperature on the content of chlorophyll in the leaves of
Solanum nigrum L. seedlings and the fluorescent index [J]. J.
Anhui Agric. Sci., 2018, 46(05): 56-57, 72.
[19] HALDIMAN P, FRACHEBOUD Y, STAMP P. Photosynthetic
performance and resistance to photoinhibition of Zea mays L.
leaves grown at sub-optimal temperature [J]. Plant Cell
Environ., 1996, 19: 85-92.
[20] 彭盡晖.湖南省绣球属(Hydrangea)植物资源及耐铝特性研
究[D].长沙:湖南农业大学,2010.
PENG J H. Study on resources of Hydrangea L. in Hunan
Province and characteristics of aluminum tolerance [D].
Changsha: Hunan Agricultural University. 2010.
[21] SHEN R F, IWASHITA T, MA J F. Form of Al changes with Al
concentration in leaves of buckwheat [J]. J. Exp. Bot., 2004,
55 (394):131-136.
[22] 陈海霞,胡春梅,彭尽晖,等. 铝胁迫诱导八仙花根系分泌有
机酸的研究[J].天津农业科学,2017,23 (2):1-7,15.
CHEN H X, HU C M, PENG J H, et al .. Al Stress-Induced
Organic Acid Secretion from Roots in Hydrangea macrophylla [J].
Tianjin Agric. Sci., 2017, 23 (2): 1-7,15.
[23] MA J F. Role of organic acids in detoxification of Al in higher
plants [J]. Plant Cell Physiol., 2000, 44: 383-390.
(责任编辑:温小杰)
