基于叶绿素荧光分析的油菜响应低温胁迫机制研究
2023-04-18燕辉
燕辉

摘要:为探明油菜幼苗叶绿素荧光响应低温胁迫的生理机制,将油菜幼苗进行低温胁迫处理,研究低温胁迫处理下油菜幼苗叶片的叶绿素荧光参数及其光响应曲线的变化特征。结果表明,胁迫处理后油菜幼苗叶片的最大光化学效率(Fv/Fm)与激发能捕获效率(F'v/F'm)较对照显著降低;实际光化学效率(F'q/F'm)在低温胁迫5~10 d后较对照显著降低,光化学淬灭(F'q/F'v)在低温处理1、3 和10 d后较对照无显著变化,由此表明,低温胁迫使PSⅡ反应中心受损,导致反应中心捕获激发能的效率降低;此时虽然反应中心吸收的光能中用于光合电子传递的份额未发生显著变化,但光能转化效率在低温胁迫5和10 d后较对照显著降低。此外,F'q/F'v光响应曲线较对照变幅较小;但低温胁迫5~10 d后,F'v/F'm与F'q/F'm光响应曲线较对照大幅降低;非光化学淬灭(non-photochemical quenching,NPQ)光响应曲线中各荧光值亦在高光强环境中显著升高。综上所述,长期低温与高光强条件下,PSⅡ反应中心通过升高NPQ的光保护机制来耗散过量激发能。以上结果为进一步分析作物响应低温胁迫的生理机制奠定了基础。
关键词:油菜;低温胁迫;荧光参数;荧光曲线doi:10.13304/j.nykjdb.2021.0486
中图分类号:S311;S565.4 文献标志码:A 文章编号:10080864(2023)01005807
油菜(Brassica napus L.)是我国重要的油料作物,在全国各地广泛种植。目前,我国种植的油菜品种大多数都需要越冬。因此,油菜幼苗在生长过程中易遭遇低温。低温会对油菜幼苗生长发育造成不利影响。研究发现,在气温为-3 ℃时,油菜会受到严重伤害;随着气温的进一步降低,油菜遭受的损伤更加严重[1],裸露于地表的叶片最易遭受低温伤害。低温伤害首先导致叶肉细胞内结冰,从而对其细胞器造成生理损伤;低温伤害还会引起叶肉细胞生理脱水及进一步的细胞塌陷,从而对其细胞质和细胞壁造成伤害。目前,低温已成为威胁油菜幼苗正常生长的主要灾害。
光合作用是农作物生长发育过程中重要的生命活动,为探明油菜光合响应低温胁迫的生理机制,长期以来,广大学者对低温处理下油菜叶片的气孔开度、光合能力与蒸腾强度等的变化规律进行了大量研究,并获得了一些研究结果[2-4]。但是,这些传统的指标仅能反映光合作用“表观性”,无法反映低温胁迫下油菜光合器官的“内在性”特征。叶绿素荧光分析是以作物光合器官所激发的叶绿素荧光变化为探针来研究不同环境条件下光合器官对光能吸收、传递、利用与耗散规律的无损伤检测技术[56]。与通过分析作物叶片CO2释放来获取光合碳同化信息的传统光合机理研究相比,能够有效地反映光合器官的“内在性”特征,具有迅速、灵敏等特点[78]。因此,为分析油菜幼苗响应低温胁迫的光合生理机制,本研究利用叶绿素荧光来探求油菜幼苗叶片在低温条件下的荧光参数变化规律,以期为探明作物低温响应机制提供理论指导。
1 材料与方法
1.1 试验设计
试验在河南科技大学农业装备工程学院的实验室中进行。试验前将供试油菜种子播种于装满基质(通用型营养土,养分含量分别为:全氮0.68%、P2O5 0.27%、K2O 0.36%)的营养钵,并放入光照培养箱中培养,培养条件为:昼夜时长12 h/12 h,光照强度200 μmol·m-2·s-1,昼夜温度23 ℃/19 ℃,相对湿度70%。待油菜种子出土并生长至幼苗期,开始进行试验。试验设置为两组:对照组继续在上述条件的光照培养箱中培养;胁迫处理组在低温光照培养箱中培养,培养条件为:昼夜时长12 h/12 h,光照强度200 μmol·m-2·s-1,昼夜温度6 ℃/2 ℃,相对湿度70%。两组均保持相同的水分供应,分别于低温处理的第1、3、5和10天使用叶绿素荧光仪测定油菜叶片各荧光参数及其光响应曲线。
1.2 叶绿素荧光参数采集
采用德国Walz公司生产的MINI-PAM叶绿素荧光仪测定荧光参数与荧光响应曲线。选取油菜倒2叶片,首先采用弱光照射叶片测得初始荧光(Fo);再用光强为5 000 μmol·m-2·s-1的饱和脉冲光照射获得最大荧光(Fm);随后采用光化光进行连续照射,得到稳态荧光(F');再用饱和脉冲光进行照射,得到光适应下最大荧光(F'm);光适应下初始荧光(F'o)由软件自动导出。按以下公式计算最大光化學效率(Fv/Fm)、实际光化学效率(F'q/F'm)、激发能捕获效率(F'v/F'm)、光化学淬灭(F'q/F'v)和非光化学淬灭(non-photochemical quenching,NPQ)等参数[6]。
Fv/Fm=(Fm-Fo)/Fm (1)
F'q/F'm=(F'm-F')/F'm (2)
F'v/F'm=(F'm-F'o)/F'm (3)
F'q /F'v=(F'm-F')/(F'm-F'o) (4)
利用MINI-PAM测定油菜荧光光响应曲线。测定过程中将已光适应的油菜倒2叶片暴露于30、60、120、250、500、750、1 000、1 250、1 500 μmol·m-2·s-1光照强度(photosynthetic photon flux density, PPFD)下,测定F'q/F'm、F'v/F'm、F'q/F'v与NPQ的光响应曲线。
1.3 数据分析
使用SPSS 16.0与Origin 7.5进行数据统计分析和图表制作。
2 结果与分析
2.1 低温胁迫下最大光化学效率变化
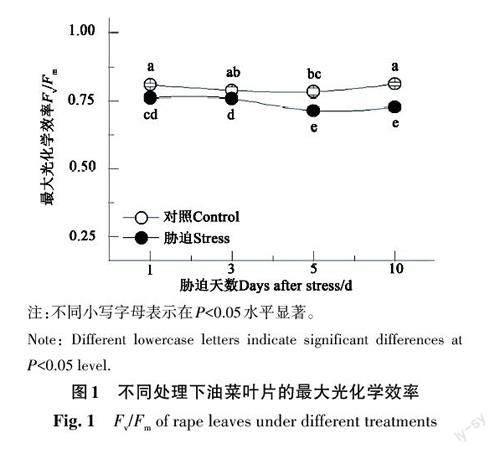
低温处理1 d后,油菜叶片Fv/Fm较对照显著降低;且随着胁迫时间的延长,Fv/Fm呈现出逐渐降低的趋势;低温处理5~10 d后,Fv/Fm降至最低(图1)。
2.2 低温胁迫下荧光参数变化
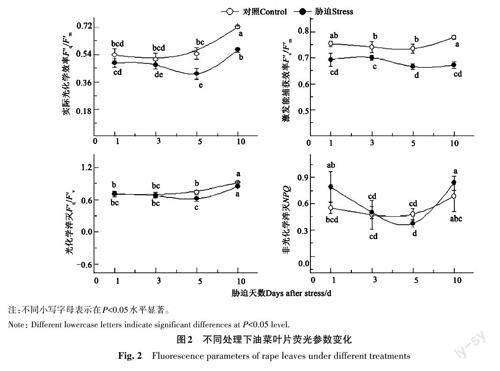
对低温胁迫下油菜叶片的F'q/F'm进行分析,结果(图2)表明,F'q/F'm在低温处理1 d后即呈现下降趋势;在低温胁迫5 d 后较对照显著降低。F'v/F'm在低温胁迫1 d后较对照显著降低;且在整个试验过程中均显著低于对照。低温处理1、3和10 d时,F'q/F'v较对照无显著变化,表明光合电子传递在PSⅡ吸收光能中所占比例受低温胁迫影响较小。与F'q/F'm与F'v/F'm等荧光参数不同,非光化学淬灭(NPQ)在整个试验过程中较对照均未发生显著变化。
2.3 低温胁迫下F′q/F′m光响应曲线变化
油菜F'q/F'm随着光照强度的增大呈现出逐步降低的趋势,但不同胁迫时长的F'q/F'm光响应曲线存在一定差异。低温胁迫1~3 d,胁迫组叶片F'q/F'm光响应曲线较对照变化较小;而胁迫5~10 d,F'q/F'm光响应曲线较对照大幅降低(图3)。
2.4 低温胁迫下F′v /F′m 与F′q/F′v 光响应曲线变化
分析不同光照强度下低温处理后油菜叶片的F'v/F'm与F'q/F'v光响应曲线,结果(图4和5)表明,随着光照强度的增大,F'v/F'm 与F'q/F'v 对低温胁迫的荧光响应存在差异。低温胁迫1~3 d,F'v/F'm较对照降幅较小;而胁迫5~10 d,F'v/F'm较对照大幅降低。F'q/F'v光响应曲线在整个试验过程中均较对照变幅较小。
2.5 低温胁迫下NPQ 光响应曲线变化
随着光照强度的增加,NPQ呈逐步升高趋势;且NPQ光响应曲线的变化与低温胁迫程度有关。低温处理1~3 d,叶片的NPQ光响应曲线较对照变幅较小;而当光照强度大于750 μmol·m-2·s-1、低温胁迫5~10 d,叶片的NPQ光响应曲线较对照呈大幅升高趋势(图6)。
3 讨论
作为探测植物光合作用的有效探针,叶绿素荧光不仅能够反映植物体内光能的吸收与传递等光合原初反应机制,还与碳同化等过程相关[10]。
因此,叶绿素荧光参数能够反映逆境对植物光合生理进程的影响。最大光化学效率(Fv/Fm)是衡量作物荧光特性的重要参数,能够反映PSⅡ光化学反应中心最大的光能转化效率[11]。正常条件下,Fv/Fm比较稳定[1213],约为0.80~0.85[7];但低温胁迫后,Fv/Fm较对照显著降低,表明低温胁迫对PSⅡ光化学反应中心造成了生理损伤。除Fv/Fm外,低温胁迫还降低了PSⅡ光化学反应中心的激发能捕获效率,进而导致PSⅡ反应中心产生的激发能减少。低温胁迫1、3和10 d时,尽管参与光合电子传递的能量在PSⅡ吸收光能中所占比例(F'q/F'v)较对照均未发生显著变化,但PSⅡ光化学反应中心的光能转化效率受激发能捕获效率降低的影响呈现出降低趋势(图2)。
非光化学淬灭(NPQ)是指PSⅡ反应中心吸收的光能中不参与光合电子传递,而以热能形式耗散的部分[14]。本研究表明,低温胁迫后油菜叶片NPQ未发生显著变化。非光化学淬灭是作物自身的一种生理保护机制[15-17],当PSⅡ反应中心活性降低,捕光色素吸收的光能无法用于光合电子传递时,往往通过升高非光化学淬灭的方式将过量激发能耗散掉[1819],从而有效地避免能量过激发对光合器官造成的生理伤害[20]。在本研究中,虽然PSⅡ反应中心的光能转化效率在低温胁迫后显著降低,但激发能捕获效率亦随之显著降低。因此,无需升高非光化学淬灭即实现了PSⅡ反应中心的生理保护(图2)。
光照强度对作物叶绿素荧光参数具有重要影响[2122]。本研究表明,油菜叶片F'q/F'm、F'v/F'm与F'q/F'v光响应曲线均随着光照强度的增大而变化,可能是油菜通过调整PS Ⅱ反应中心活性来适应高光强,也有可能是高光强胁迫造成了光抑制现象[23]。同时,各荧光参数的光响应曲线对不同程度胁迫的生理响应存在差异。其中,F'q/F'm与F'v/F'm光响应曲线在胁迫初期(1和3 d)较对照降幅较小,而在胁迫5~10 d时较对照大幅降低。由此表明,低温处理对油菜叶片F'q/F'm与F'v/F'm的影响与胁迫程度有关,轻度低温胁迫对PSⅡ反应中心光能捕获效率及光能转化效率影响较小;重度低温胁迫则会降低PSⅡ反应中心光能捕获效率,进而降低其光能转化效率,限制光能向化学能的转化。低温胁迫下,叶片F'q/F'v光响应曲线在整个试验过程中较对照变幅较小,表明低温胁迫下油菜葉片PSⅡ反应中心吸收的光能中用于光合电子传递的份额能够维持稳定。
与F'q/F'm、F'v/F'm、F'q/F'v 等荧光参数光响应曲线不同,油菜叶片NPQ 光响应曲线均随着光照强度的增大呈现出逐步升高趋势。这可能是由于叶片在高光照强度环境下以增强非光化学淬灭的形式耗散了过剩激发量[24]。此外,当光照强度大于750 μmol·m-2·s-1时,中重度低温胁迫使油菜叶片NPQ光响应曲线较对照大幅升高。这可能是由于中重度低温胁迫下,PSⅡ反应中心在高光照强度下出现光抑制,捕光色素吸收的光能无法有效地转化为化学能。为避免能量过激发对PSⅡ反应中心造成的生理损伤,油菜在长期进化过程中形成了有效的光合器官自我保护机制。在这一机制中,PSⅡ反应中心通过升高NPQ将过量激发能以热量的形式耗散掉,从而避免能量过激发对光合器官的生理伤害[2526]。
综上所述,低温胁迫导致PSⅡ光化学反应中心遭受损伤,激发能捕获效率降低;此时,虽然PSⅡ反应中心吸收的光能中用于光合电子传递的份额未发生显著改变,但反应中心的光能转化效率仍然呈现出降低趋势。本试验中,胁迫叶片的F'q/F'v 光响应曲线较对照变幅较小,F'v/F'm 与F'q/F'm光响应曲线在长期低温胁迫下大幅降低,而NPQ光响应曲线的升高主要出现在长期低温、高光强环境,由此表明,在长期低温与高光强环境中,油菜会通过耗散过量激发能来实现对光合器官的自我保护。
参 考 文 献
[1] 张晓红,冯梁杰,杨特武,等.冬季低温胁迫对油菜抗寒生理
特性的影响[J].植物生理学报,2015,51(5):737-746.
ZHANG X H, FENG L J, YANG T W, et al .. Effects of chilling
stress on physiological characteristics of rapeseed seedlings in
winter [J]. Plant Physiol. J., 2015, 51(5):737-746.
[2] 张智,张耀文,任军荣,等.多效唑处理后油菜苗在低温胁迫下
的光合及生理特性[J].西北农业学报,2013,22(10):103-107.
ZHANG Z, ZHANG Y W, REN J R, et al .. Photosynthetic and
physiological characteristics of Brassica napus seedlings
treated with multi-effect triazole under cold stress [J]. Acta
Agric. Bor-Occid. Sin., 2013, 22(10):103-107.
[3] 刘自刚,袁金海,孙万仓,等.低温胁迫下白菜型冬油菜差异蛋
白质组学及光合特性分析[J].作物学报,2016,42(10):1541-1550.
LIU Z G, YUAN J H, SUN W C, et al .. Differential proteomic
analysis and photosynthetic characteristics of winter rapeseed
under low temperature stress [J]. Acta Agron. Sin., 2016, 42(10):
1541-1550.
[4] 陈奇,袁金海,孙万仓,等.低溫胁迫下白菜型冬油菜与春油
菜叶片光合特性及内源激素变化比较[J].中国油料作物学
报,2017,39(1):37-46.
CHEN Q, YUAN J H, SUN W C, et al .. Leaf photosynthetics
and endogenous hormones of spring and winter rapa (Brassica
rapa L.) under low temperature [J]. Chin. J. Oil. Crop. Sci.,
2017, 39(1):37-46.
[5] 岑海燕,姚洁妮,翁海勇,等.叶绿素荧光技术在植物表型分析
的研究进展[J].光谱学与光谱分析,2018,38(12):3773-3779.
CEN H Y, YAO J N, WENG H Y, et al .. Applications of
chlorophyll fluorescence in plant phenotyping: a review [J].
Spectrosc. Spect. Anal., 2018, 38(12):3773-3779.
[6] ZHANG J, LIU J, ZHAO T, et al .. Effects of drought stress on
chlorophyll fluorescence in tomato [J]. Mol. Plant Breeding,
2017, 8(7):65-69.
[7] GENTY B, BRIANTAIS J M, BAKER N R. The relationship
between quantum yield of photosynthetic electron transport
and quenching of chlorophyll fluorescence [J]. Bba-Gen.
Subjects., 1989, 990(1):87-92.
[8] MAXWELL K, JOHNSON G N. Chlorophyll fluorescence-a
practical guide [J]. J. Exp. Bot., 2000, 51(345):659-668.
[9] BAKER N R. Chlorophyll fluorescence: a probe of photosynthesis
in vivo [J]. Annu. Rev. Plant. Biol., 2008, 59:89-113.
[10] 尤鑫,龚吉蕊.叶绿素荧光动力学参数的意义及实例辨析[J].
西部林业科学,2012,41(5):90-94.
YOU X, GONG J R. Significance and application of
chlorophyll fluorescence dynamics process parameters [J]. J.
West. China. For. Sci., 2012, 41(5):90-94.
[11] DEVACHT S, LOOTENS P, BAERT J, et al .. Evaluation of
cold stress of young industrial chicory (Cichorium intybus L.)
plants by chlorophyll a fluorescence imaging. I. light induction
curve [J]. Photosynthetica, 2011, 49(2):161-171.
[12] ZHOU R, YU X Q, KJ?R K H, et al .. Screening and validation
of tomato genotypes under heat stress using Fv/Fm to reveal the
physiological mechanism of heat tolerance [J]. Environ. Exp.
Bot., 2015, 118:1-11.
[13] XU L, PAN R, SHABALA L, et al.. Temperature influences
waterlogging stress-induced damage in Arabidopsis through the
regulation of photosynthesis and hypoxia-related genes [J].
Plant Growth Regul., 2019, 89:143-152.
[14] SOUZA R P, MACHADO E C, SILVA J A B, et al .. Photosynthetic
gas exchange, chlorophyll fluorescence and some associated
metabolic changes in cowpea (Vigna unguiculata) during water
stress and recovery [J]. Environ. Exp. Bot., 2004, 51(1):45-56.
[15] ZHAO X, ZHONG Y, ZHANG H, et al .. Cooperation between
photosynthetic and antioxidant systems: an important factor in
the adaptation of Ulva prolifera to abiotic factors on the sea
surface [J/OL]. Front. Plant Sci., 2019, 10:648 [2021-05-05].
https://doi.org/10.3389/fpls.2019.00648.
[16] MATESE A, BARALDI R, BERTON A, et al.. Estimation of
water stress in grapevines using proximal and remote sensing
methods [J/OL]. Remote. Sens., 2018, 10(1):114 [2021-05-05].
https://doi.org/10.3390/rs10010114.
[17] PANDIT A, REWS M, MOROSINOTTO T, et al.. An NMR
comparison of the light-harvesting complex II (LHCII) in active and
photoprotective states reveals subtle changes in the chlorophyll a
ground-state electronic structures [J]. BBA-Bioenergetics, 2013,
1827(6):738-744.
[18] QUAAS T, BERTEOTTI S, BALLOTTARI M, et al .. Nonphotochemical
quenching and xanthophyll cycle activities in
six green algal species suggest mechanistic differences in the
process of excess energy dissipation [J]. J. Plant Physiol.,
2015, 172(1):92-103.
[19] CISSE A, ZHAO X, FU W, et al .. Non-photochemical quenching
involved in the regulation of photosynthesis of rice leaves under
high nitrogen conditions [J/OL]. Int. J. Mol. Sci., 2020, 21(6):2115
[2021-05-05]. https://doi.org/10.3390/ijms21062115.
[20] SHANGGUAN Z P, SHAO M A, DYCKMANS J. Nitrogen
nutrition and water stress effects on leaf photosynthetic gas
exchange and water use efficiency in winter wheat [J]. Environ.
Exp. Bot., 2000, 44:141-149.
[21] 孙永平,汪良驹.ALA处理对遮荫下西瓜幼苗叶绿素荧光参
数的影响[J].园艺学报,2007,34(4):901-908.
SUN Y P, WANG L J. Effects of 5-am inolevulinic acid (ALA) on
chlorophyll fluorescence dynamics of watermelon seedlings under
shade condition [J]. Acta. Hortic. Sin., 2007, 34(4):901-908.
[22] 康瑯,汪良驹.ALA对西瓜叶片叶绿素荧光光响应曲线的影
响[J].南京农业大学学报,2008,31(1):31-36.
KANG L, WANG L J. Effects of ALA treatments on light
response curves of chlorophyll fluorescence of water melon
leaves [J]. J. Nanjing. Agric. Univ., 2008, 31(1):31-36.
[23] 许耀照,曾秀存,张芬琴,等.白菜型冬油菜叶片结构和光合
特性对冬前低温的响应[J].作物学报,2017,43(3):432-441.
XU Y Z, ZENG X C, ZHANG F Q, et al .. Response of leaf
anatomical structure and photosynthetic characteristics of
winter turnip rape (Brassica rapa L.) to low temperature before
winter [J]. Acta. Agron. Sin., 2017, 43(3):432-441.
[24] 杨佳伟,文仕知,何功秀,等.施肥对闽楠幼树 PSⅡ叶绿素荧
光快速光响应曲线的影响[J].中南林业科技大学学报,2018,
38(2):43-49.
YANG J W, WEN S Z, HE G X, et al .. Rapid light curves of
PSⅡ chlorophyll fluorescence parameters in leaves of Phoebe
bournei saplings fertilized [J]. J. Cent. South Univ. For. Tech.,
2018, 38(2):43-49.
[25] QIU N, LU Q, LU C. Photosynthesis, photosystem II efficiency
and the xanthophyll cycle in the salt-adapted halophyte
Atriplex centralasiatica [J]. New Phytol., 2003, 159:479-486.
[26] HUI Y, WU L, FILARDO F, et al .. Chemical and hydraulic
signals regulate stomatal behavior and photosynthetic activity
in maize during progressive drought [J/OL]. Acta. Physiol.
Plant, 2017, 39: 125 [2021-05-05]. https://doi. org/10.1007/
s11738-017-2418-5.
(责任编辑:张冬玲)
