电针大鼠血清对氧糖剥夺诱导的海马神经元铁死亡的影响
2023-04-17李笑笑李姝洁董健健韩永升
李笑笑 ,李姝洁 ,董健健 ,韩永升,
1.安徽中医药大学研究生院,安徽 合肥 230012; 2.安徽中医药大学神经病学研究所,安徽 合肥 230038;3.安徽省中西医结合医院,安徽 合肥 230031
卒中是世界第二大死亡原因,也是全球致残的主要原因。缺血性脑卒中(ischemic stroke,IS)是卒中最常见的类型[1-2],由血管阻塞导致大脑特定区域血液供应减少引起。电针将传统针刺与生物电刺激相结合,基础和临床研究均表明电针可通过多途径、多靶点治疗IS[3-6]。针刺血清是针刺治疗后产生的效应物质,有类似于针刺治疗的效应,具有抑制神经元Ca2+超载、促进神经干细胞增殖与分化、上调神经元内质网活性、提高海马神经元突触可塑性、减轻神经元损伤等作用[7-10]。
铁死亡是细胞内铁和脂质活性氧累积,导致细胞氧化应激损伤和死亡的特殊死亡形式[11]。越来越多的证据表明,铁死亡是IS病理性细胞死亡的重要机制,铁死亡促进IS的发生,引起脑组织结构和功能损伤,而抑制铁死亡可以显著降低IS严重程度并促进脑功能恢复[12-13]。
课题组前期研究发现,电针对IS模型大鼠神经血管单元(NVU)具有保护作用,且电针血清干预可减轻氧糖剥夺/复糖复氧(OGD/R)诱导的神经元损伤,而该作用与激活Wnt/β-catenin信号通路密切相关[14-15]。同时发现,电针通过抑制铁死亡对IS模型大鼠发挥神经保护作用[16]。为进一步探究电针对IS铁死亡的抑制作用及可能机制,本研究利用OGD/R方法构建海马神经元体外缺血损伤模型,并予电针大鼠血清干预,观察电针血清对海马神经元OGD/R损伤及铁死亡的影响,为电针治疗IS提供实验依据。
1 实验材料
1.1 动物及细胞
SPF级健康雄性SD大鼠30只,2~3月龄,体质量250~300 g,济南朋悦实验动物繁育有限公司提供,动物许可证号SCXK(鲁)2019-0003。饲养温度24~26 ℃,相对湿度50%~60%,12 h光照,自由摄食饮水。HT-22细胞,购自中国科学院上海细胞库,用含10%胎牛血清的DMEM培养液,置于37 ℃、5%CO2培养箱培养。
1.2 主要试剂与仪器
DMEM培养基(批号8120475),美国Gibco公司;胎牛血清(批号20210506),天津康源;CCK8试剂盒(批号CK04),上海东仁化学科技有限公司;活性氧(ROS)检测试剂盒(批号CA1410),索莱宝科技有限公司;长链脂酰辅酶A合成酶4(ACSL4)抗体(批号384265)、Wnt1多克隆抗体(批号251822),成都正能生物;β-连环蛋白(β-catenin)多克隆抗体(批号8480),美国CST公司;谷胱甘肽过氧化物酶4(GPX4)抗体(批号GB113745),武汉赛维尔生物;糖原合成酶激酶-3(GSK-3β)抗体(批号ab32391)、轴蛋白2(Axin2)抗体(批号ab109307)、运铁蛋白(Tf)抗体(批号ab82411),英国Abcam公司。
生物安全柜(BSC-1300ⅡA2),苏州安泰空气技术有限公司;CO2培养箱(GOLD-SIM W200IR),美国SIM公司;荧光倒置相差显微镜(CKX41),日本Olympus公司;全波长酶标仪(Epoch2),美国Biotek公司;电泳仪(Powerpac Basic),美国伯乐公司;电针仪(G6805-2A),上海华谊医用仪器有限公司;一次性无菌针灸针(13 mm×0.18 mm),吴江云龙医疗器械有限公司。
2 实验方法
2.1 血清制备
参照前期研究[15]方法制备对照大鼠血清和电针大鼠血清,0.22 μm过滤器过滤,分装,56 ℃灭活30 min,-20 ℃冰箱保存备用。
2.2 分组、造模及干预
将HT-22细胞分为对照组、模型组和电针血清组。对照组先以15%对照大鼠血清置于37 ℃、5%CO2培养箱中培养24 h,后更换为无血清、含糖培养基继续培养;模型组先以15%对照大鼠血清正常培养24 h,再以无血清、无糖培养基置于37 ℃、5%CO2、1%O2和94%N2混合气体培养箱中培养2 h,后以无血清、含糖培养基置于37 ℃、5%CO2培养箱中继续培养24 h建立OGD/R模型;电针血清组先以15%电针大鼠血清正常培养24 h,再按模型组方法进行处理。
2.3 CCK8法检测细胞存活率
取对数生长期细胞,以每孔1×105个细胞接种至96孔板,每孔100 μL,按“2.2”项下方法分组处理,每组6个复孔,另设空白组(不接种细胞仅加入培养基)。干预结束后,每孔加入10 μL CCK8溶液,于37 ℃培养箱中孵育1.5 h,各组分别吸取100 μL培养液于96孔板中,酶标仪波长450 nm测定吸光度,计算细胞存活率。细胞存活率(%)=(电针血清组-空白组)÷(对照组-空白组)×100%。
2.4 活性氧含量检测
取对数生长期细胞,将细胞接种至放有细胞爬片的6孔板中,调整细胞密度为3×105个/孔,并按“2.2”项下方法进行分组干预。干预结束后,吸去培养液,每孔加入1 mL稀释的DCFH-DA,37 ℃孵育20 min,弃去液体,以无血清培养基洗涤细胞3次,细胞爬片滴加DAPI染色剂,室温避光孵育8~10 min,PBS漂洗3次,使用抗荧光淬灭封片剂进行封片,荧光显微镜下观察,使用Image J软件分析平均荧光强度。
2.5 Western blot检测
干预结束后,收集各组细胞,分别加入PMSF和RIPA裂解液吹打混合,冰浴摇床上裂解30 min,4 ℃、12 000 r/min离心30 min,取上清液,加入蛋白上样缓冲液,100 ℃水浴加热8 min,-80 ℃冰箱保存备用。以12%聚丙烯酰胺凝胶电泳分离蛋白,将蛋白转移到NC膜上,快速封闭液摇床常温封闭20 min,加入β-actin、ACSL4、 Tf、 GPX4、 Wnt1、 β -catenin、 Axin2、GSK-3β一抗(均为1∶1 000),室温摇床孵育4 h,PBST洗膜3次,加二抗(1∶10 000),室温摇床孵育1.5 h,使用ECL发光试剂进行曝光,Image J软件分析条带灰度值,以目的蛋白与内参蛋白(β-actin)灰度值比值计算蛋白相对表达量。
3 统计学方法
采用SPSS23.0统计软件进行分析。计量资料以±s表示,多组间比较采用方差分析,多重比较采用LSD-t检验。P<0.05表示差异有统计学意义。
4 结果
4.1 电针血清对HT-22细胞存活率的影响
与对照组比较,模型组HT-22细胞存活率显著降低(P<0.01);与模型组比较,电针血清组HT-22细胞存活率显著升高(P<0.01)。见表1。
表1 各组HT-22细胞存活率比较(±s,%)

表1 各组HT-22细胞存活率比较(±s,%)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别对照组模型组电针血清组n 6 6 6存活率100.00± 5.37 56.04± 6.81**71.87±10.05##
4.2 电针血清对HT-22细胞活性氧含量的影响
与对照组比较,模型组HT-22细胞ROS含量显著增加(P<0.01);与模型组比较,电针血清组HT-22细胞ROS含量显著减少(P<0.01)。见表2。
表2 各组HT-22细胞ROS含量比较(±s,平均荧光强度)

表2 各组HT-22细胞ROS含量比较(±s,平均荧光强度)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别对照组模型组电针血清组n 3 3 3 ROS 2.04±0.37 44.59±2.47**17.59±2.08##
4.3 电针血清对HT-22细胞铁死亡相关蛋白表达的影响
与对照组比较,模型组HT-22细胞ACSL4、Tf蛋白表达升高,GPX4蛋白表达降低,差异有统计学意义(P<0.01);与模型组比较,电针血清组HT-22细胞ACSL4、Tf蛋白表达降低,GPX4蛋白表达升高,差异有统计学意义(P<0.01)。见图1、表3。
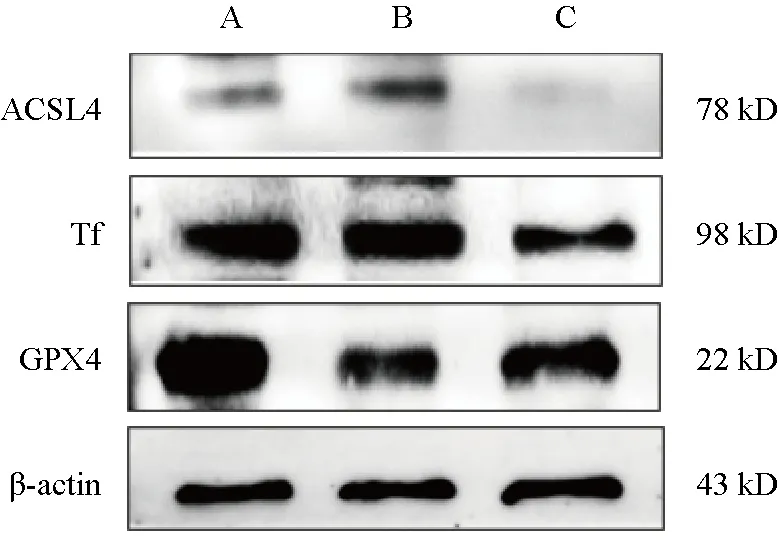
图1 各组HT-22细胞ACSL4、Tf、GPX4蛋白免疫印迹
表3 各组HT-22细胞ACSL4、Tf、GPX4蛋白表达比较(±s)

表3 各组HT-22细胞ACSL4、Tf、GPX4蛋白表达比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别对照组模型组电针血清组n 3 3 3 ACSL4 0.141±0.003 0.316±0.002**0.096±0.003##Tf 0.635±0.006 0.665±0.004**0.383±0.002##GPX4 1.021±0.013 0.500±0.009**0.643±0.001##
4.4 电针血清对HT-22细胞Wnt/β-catenin信号通路相关蛋白表达的影响
与对照组比较,模型组HT-22细胞Wnt1、β-catenin蛋白表达显著降低,Axin2、GSK-3β蛋白表达显著升高,差异均有统计学意义(P<0.01);与模型组比较,电针血清组HT-22细胞Wnt1、β-catenin蛋白表达显著升高,Axin2、GSK-3β蛋白表达显著降低,差异均有统计学意义(P<0.01)。见表4、图2。
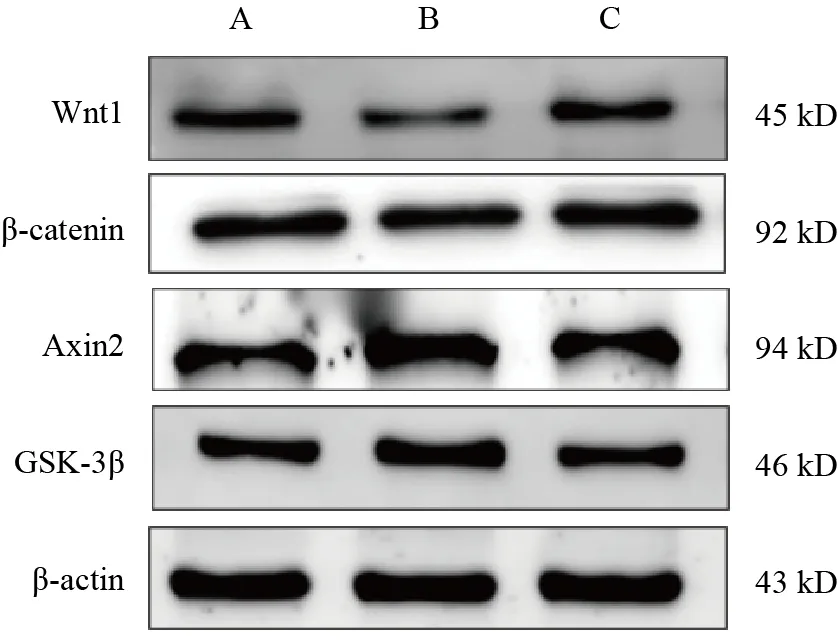
图2 各组HT-22细胞Wnt1、β-catenin、Axin2、GSK-3β蛋白免疫印迹
表4 各组HT-22细胞Wnt1、β-catenin、Axin2、GSK-3β蛋白表达比较(±s)

表4 各组HT-22细胞Wnt1、β-catenin、Axin2、GSK-3β蛋白表达比较(±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
组别对照组模型组电针血清组n 3 3 3 Wnt1 0.639±0.015 0.524±0.008**0.612±0.010##β-catenin 1.024±0.028 0.846±0.014**0.986±0.033##Axin2 0.649±0.012 0.878±0.013**0.662±0.020##GSK-3β 0.633±0.017 0.787±0.018**0.599±0.021##
5 讨论
研究发现,以铁超载、谷胱甘肽(GSH)消耗和GPX4失活、脂质过氧化、Xc-系统损伤及线粒体膜密度增加、嵴破裂或消失等为特征的铁死亡在IS发生发展中具有重要作用[17]。大脑中动脉闭塞(MCAO)模型大鼠大脑皮质出现铁和ROS沉积,血清脂质过氧化水平明显升高,并伴有铁死亡相关蛋白表达异常[18]。OGD/R能显著增加神经元内铁和ROS含量,线粒体出现膜密度增加和嵴减少[19],而应用铁死亡抑制剂如Liproxstatin-1可显著减少铁沉积和ROS生成,降低脂质过氧化水平,保护OGD/R诱导的神经元损伤,促进MCAO大鼠神经功能恢复[20]。临床应用去铁胺能降低急性IS患者体内铁含量和运铁蛋白饱和度,减轻神经损伤,改善预后[21]。
ROS累积是铁死亡的标志之一,铁死亡抑制剂和各种抗氧化剂或ROS清除剂都可以抑制ROS累积和细胞铁死亡[22]。相关研究发现,OGD/R诱导神经元内铁和ROS沉积,介导细胞铁死亡[20,23-24]。本实验及前期研究结果[14]显示,OGD/R后神经元内ROS水平升高、丙二醛(MDA)含量增加、超氧化物歧化酶(SOD)活性减弱,提示OGD/R诱导神经元内ROS生成和氧化应激发生。在电针大鼠血清干预下,ROS水平降低,MDA含量减少、SOD活性增强,提示电针大鼠血清能抑制ROS产生,减轻氧化损伤。
ACSL4和GPX4被认为是铁死亡的正、负调节因子。ACSL4是多不饱和脂肪酸(PUFA)代谢的同工酶[25],通过催化PUFA乙酰化,产生脂质过氧化物,导致铁死亡[26]。ACSL4过表达促进铁死亡的发生,而抑制ACSL4可减轻铁死亡[27-28]。GPX4是一种硒过氧化物酶,利用GSH作为辅助因子,将有毒的脂质氢过氧化物转化为无毒的脂质醇,以维持细胞氧化还原稳态[29],通过调节脂质过氧化抑制细胞铁死亡。Tf是血清中的一种铁载体蛋白,通过转铁蛋白受体介导的内吞作用将铁转运到细胞中[30],Tf的激活促进铁死亡发生[31]。本实验发现,OGD/R诱导HT-22细胞ACSL4、Tf蛋白表达升高,GPX4蛋白表达降低,结合ROS含量增加和细胞存活率降低,提示OGD/R能诱导神经元铁死亡。电针血清干预后,HT-22细胞ACSL4、Tf蛋白表达降低,GPX4蛋白表达升高,并伴有ROS含量减少和细胞存活率升高,提示电针血清对OGD/R诱导的神经元铁死亡具有抑制作用。
Wnt信号通路是一条进化上保守的细胞间信息传递通路,与胚胎发生和干细胞更新,细胞增殖、分化等紧密相关。课题组前期研究发现,电针可通过激活Wnt/β-catenin信号通路,有效保护MCAO大鼠NVU[14]。本研究也发现,在电针大鼠血清干预后,HT-22细胞Wnt1、β-catenin蛋白表达上调,Axin2、GSK-3β蛋白表达下调,提示电针大鼠血清可能通过激活Wnt/β-catenin信号通路抑制神经元铁死亡。
综上所述,电针大鼠血清对OGD/R诱导的海马神经元损伤的保护作用可能与激活Wnt/β-catenin信号通路,抑制细胞铁死亡相关。
