黄芪对糖尿病视网膜病变小鼠的影响及机制研究
2023-04-17刘汉滢季青璇彭美中马盼牛艺婷徐艺宸韩静
刘汉滢 ,季青璇 ,彭美中 ,马盼 ,牛艺婷 ,徐艺宸 ,韩静
1.北京中医药大学中医学院,北京 100029; 2.北京中医药大学北京中医药研究院,北京 100029
糖尿病视网膜病变(diabetic retinopathy,DR)是由糖尿病引起的微血管并发症[1],是成年人失明最常见的原因[2]。在我国,随着糖尿病患病人数增加,DR的致盲率日益升高[3]。目前,DR的治疗方法有控制血糖、激光光凝手术、注射抗血管内皮生长因子药物等。但目前的治疗方法存在弊端,如经视网膜光凝手术治疗后,患者出现视网膜受损性裂孔、虹膜受损、出血等不良反应[4];使用抗血管内皮生长因子药物治疗后,部分患者出现牵引性视网膜脱离、眼压升高、黄斑孔形成及葡萄膜炎等不良反应[5]。因此,亟需寻找能够有效治疗DR的新方法。
黄芪味甘,性微温,具有补气升阳、固表止汗、敛疮生肌等作用[6]。药理研究表明,黄芪可降低糖尿病大鼠血糖[7]。临床研究表明,黄芪注射液能提高DR患者视力,减少眼底出血,改善血液流变学指标[8]。此外,黄芪有效部位黄芪多糖能减少视网膜血管中白细胞黏附,降低DR大鼠视网膜肿瘤坏死因子-α(TNF-α)等蛋白表达[9]。黄芪主要成分黄芪甲苷可显著抑制db/db小鼠视网膜神经节细胞凋亡[10]。虽然提示黄芪具有治疗DR的潜力,但药理机制尚未阐明。本实验通过建立小鼠糖尿病模型,观察黄芪对糖尿病小鼠视网膜病变的作用,并探讨其潜在机制,为黄芪治疗DR的临床应用奠定基础。
1 实验材料
1.1 动物
SPF级雄性C57BL/6J小鼠18只,8周龄,体质量20~25 g,购于斯贝福(北京)生物技术有限公司,动物许可证号SYXK(京)2019-0030。饲养于北京中医药大学动物实验中心,温度22~27 ℃,湿度45%~55%,自然光照,适应性喂养1周。本实验经北京中医药大学实验动物伦理委员会审查批准(BUCM-4-2020102005-4193)。
1.2 药物及制备
黄芪,购于南京同仁堂有限公司,批号6971133498764。称取黄芪饮片50 g,加10倍量去离子水,煎煮2次,每次2 h,合并滤液,减压浓缩至5 g/mL,于4 ℃保存。
1.3 主要试剂与仪器
链脲佐菌素(STZ),德国Sigma,货号S0130;柠檬酸钠缓冲液,江苏凯基生物技术股份有限公司,货号KGHC001;封闭用羊血清,北京中杉金桥,货号ZLI-9056;小鼠内皮糖蛋白(Endoglin/CD105)抗体,英国Abcam,货号ab156756;基质金属蛋白酶2(MMP2)抗体,英国Abcam,货号ab79781;糖原合成酶激酶-3β(GSK-3β)抗体,美国CST,货号D5C5Z;含DAPI荧光封片剂,北京中杉金桥,货号ZF-0311;山羊抗小鼠IgG,英国Abcam,货号ab97018;羊抗兔IgG-Alexa Fluor 647,北京百瑞极生物,货号BN20636;Triton X-100,北京百瑞极生物,货号9002-93-1。光学显微镜(德国Leica,型号DM2500),激光共聚焦显微镜(德国Leica,型号TCS SP8),视网膜显微成像系统(美国Phoenix Research Labs,型号Micron Ⅲ)。
2 实验方法
2.1 造模、分组及给药
小鼠随机分为正常组、模型组和黄芪组,每组6只。除正常组外,其余各组参照文献[11]方法制备DR小鼠模型。小鼠禁食12 h,模型组和黄芪组连续5 d腹腔注射链脲佐菌素溶液60 mg/kg(pH=4.4柠檬酸钠缓冲液配制),正常组注射等体积柠檬酸钠缓冲液。4周后小鼠尾静脉采血测定空腹6 h血糖,剔除血糖<16.7 mmol/L小鼠。按60 kg成人临床剂量与小鼠体表面积换算给药剂量,黄芪组予黄芪水提物80 mg/kg灌胃[12-13],正常组和模型组予等体积羧甲基纤维素钠灌胃,连续6周。
2.2 体质量与空腹血糖测定
每周称量小鼠体质量,每2周检测小鼠空腹血糖。
2.3 光学相干断层扫描检测视网膜厚度
小鼠腹腔注射0.5%戊巴比妥钠麻醉,滴加复方托吡卡胺滴眼液散瞳,卡波姆眼膏润滑角膜,将小鼠眼球紧贴于实验仪器镜面进行观察并拍照。采用Image J软件对图片进行分析,统一标尺长度以测量视网膜厚度,以中央凹为起点,在左右各150、300 μm处测量视网膜全层厚度。
2.4 网络药理学分析
2.4.1 黄芪有效成分及靶点筛选
在 TCMSP(https://old.tcmsp-e.com/tcmsp.php)数据库以“黄芪”为关键词进行检索,获取黄芪有效成分,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为条件进行筛选。通过SwissTargetPrediction数据库检索有效成分对应靶点信息,将筛选的靶点导入UniProt数据库(http://www.uniprot.org/up-loadlists/),限定物种为“人类”,将靶点蛋白、基因信息标准化。
2.4.2 糖尿病视网膜病变相关靶点筛选
以“diabetic retinopathy”为关键词在OMIM(https://www.omim.org/)、GAD(https://www.g6gsoftwaredirectory.com/)、TTD(http://db.idrblab.net/ttd/)数据库进行检索,获得DR相关靶点。
2.4.3 黄芪治疗糖尿病视网膜病变靶点预测
将黄芪有效成分靶点与DR相关靶点导入Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)得到交集靶点,即黄芪治疗DR的潜在靶点。
2.4.4 蛋白相互作用网络构建
将获得的交集靶点导入STRING(https://cn.stringdb.org/)数据库,物种设置为“人类”,剔除孤立靶点,以TSV格式将数据导出,得到蛋白相互作用(PPI)网络,并进行蛋白间相互作用分析。
2.4.5 黄芪治疗糖尿病视网膜病变靶点生物功能注释
将黄芪治疗DR靶点上传至DAVID(https://david.ncifcrf.gov/list.jsp)数据库,对靶点进行GO功能和KEGG通路富集分析,将阈值P<0.01设定为筛选条件。
2.5 免疫荧光染色
干预结束后,取视网膜,制作视网膜组织切片,依次加入二甲苯Ⅰ、二甲苯Ⅱ、二甲苯Ⅲ浸泡20 min,梯度乙醇(100%、95%、90%、80%、70%、60%、50%)脱水5 min,流水冲洗10 min,甘氨酸溶液孵育10 min,PBS冲洗3次,羊血清封闭30 min,分别滴加CD105一抗(1∶50)、MMP2一抗(1∶200)、GSK-3β一抗(1∶250),4 ℃孵育过夜。PBS冲洗5 min×3次,滴加二抗(1∶400),37 ℃避光孵育60 min,加入适量含DAPI荧光封片剂,避光复染5 min,盖玻片封片,激光共聚焦显微镜下观察并拍照,采用Image J软件分析蛋白平均光密度。
3 统计学方法
采用SPSS20.0统计软件进行分析。计量资料以±s表示,符合正态分布,多组间比较采用方差分析,方差齐组间两两比较采用LSD法,方差不齐用T2检验。P<0.05表示差异有统计学意义。
4 结果
4.1 黄芪对模型小鼠体质量及空腹血糖的影响
与正常组比较,模型组小鼠体质量明显减少(P<0.05),空腹血糖明显升高(P<0.05);与模型组比较,黄芪组小鼠体质量明显增加(P<0.05),空腹血糖水平无明显变化(P>0.05)。结果见表1。
表1 各组小鼠体质量和空腹血糖比较(±s)

表1 各组小鼠体质量和空腹血糖比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别正常组模型组黄芪组只数6 6 6体质量/g 32.25±1.47 20.34±1.15*22.34±1.51#空腹血糖/(mmol/L)8.57±0.73 25.83±2.86*23.17±9.95
4.2 黄芪对模型小鼠视网膜厚度的影响
光学相干断层扫描前麻醉过程中,黄芪组小鼠死亡2只。对视网膜厚度测量后发现,与正常组比较,模型组小鼠距中央凹150、300 μm处视网膜厚度明显减少(P<0.05);与模型组比较,黄芪组小鼠距中央凹150、300 μm处视网膜厚度明显增加(P<0.05)。结果见图1、表2。
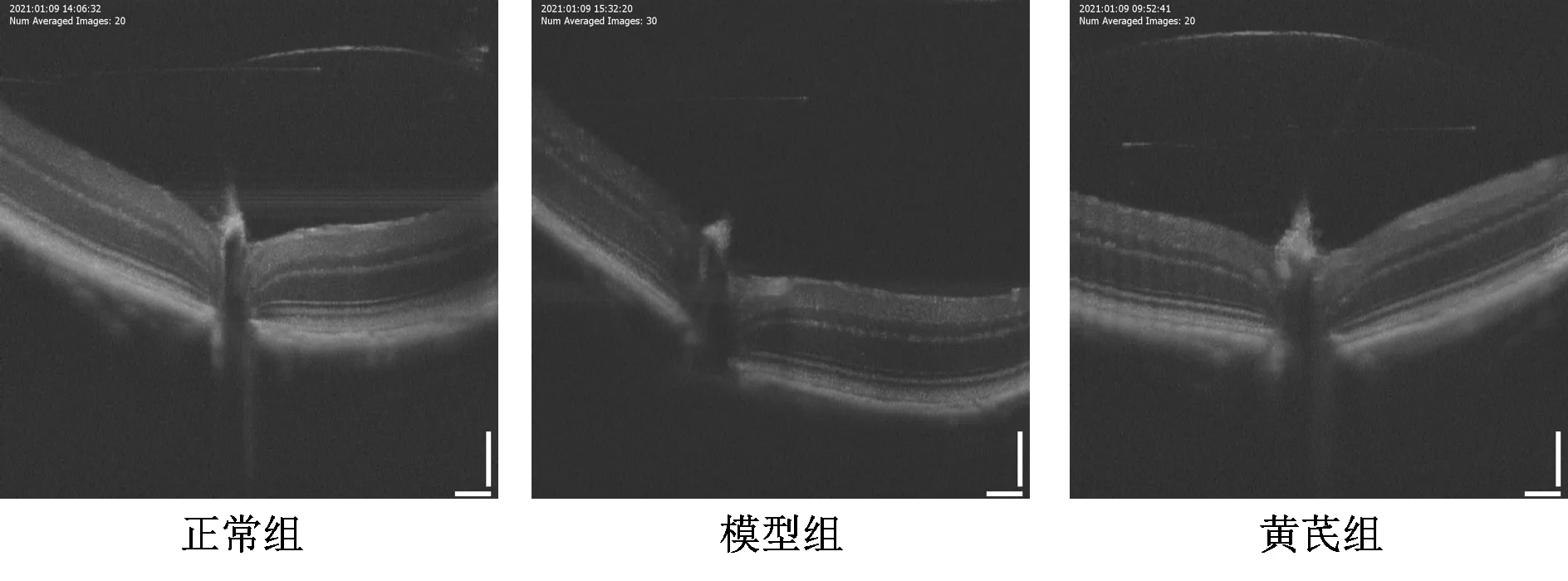
图1 各组小鼠视网膜光学相干断层扫描图像
表2 各组小鼠视网膜厚度比较(±s,μm)

表2 各组小鼠视网膜厚度比较(±s,μm)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
距中央凹300 μm厚度组别 只数 距中央凹150 μm厚度163.00±4.46 153.52±7.63*158.12±7.53#正常组模型组黄芪组6 6 4 160.67±3.89 151.79±6.81*156.12±7.05#
4.3 黄芪对模型小鼠视网膜组织CD105蛋白表达的影响
与正常组比较,模型组小鼠视网膜组织CD105蛋白表达明显升高(P<0.05);与模型组比较,黄芪组小鼠视网膜组织CD105蛋白表达明显降低(P<0.05)。结果见图2、表3。
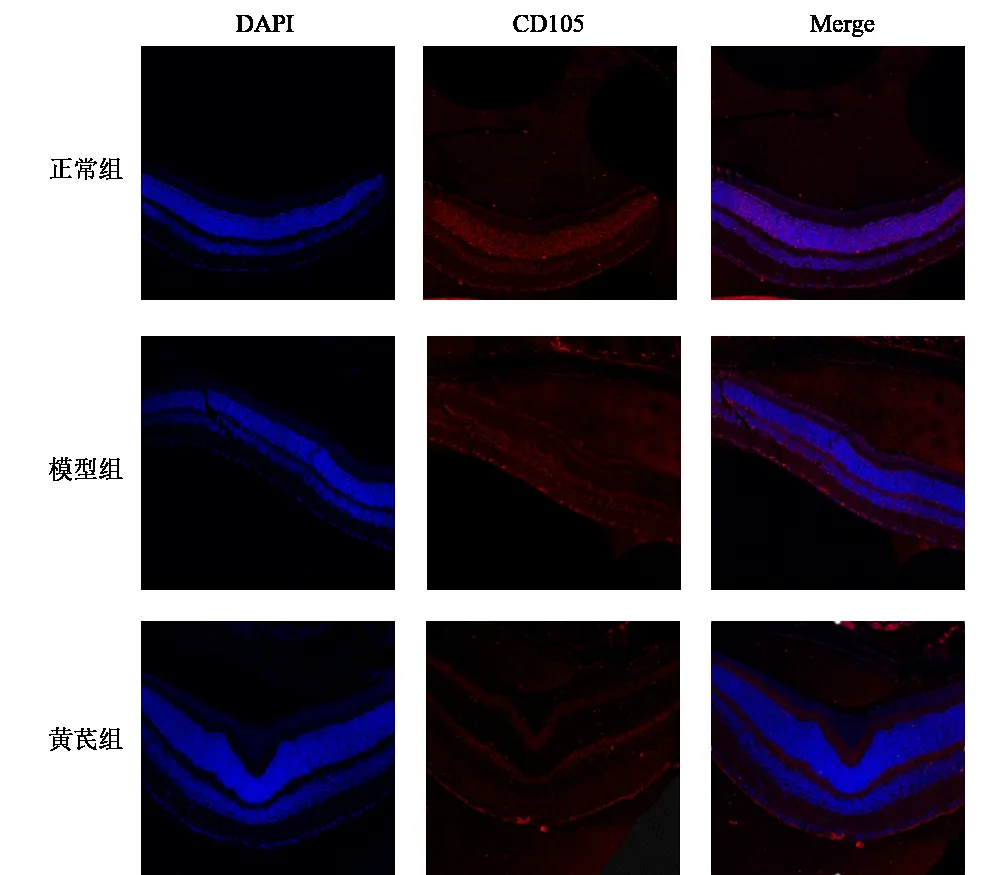
图2 各组小鼠视网膜组织CD105蛋白表达(免疫荧光染色,×400)
表3 各组小鼠视网膜组织CD105蛋白表达比较(±s,%)
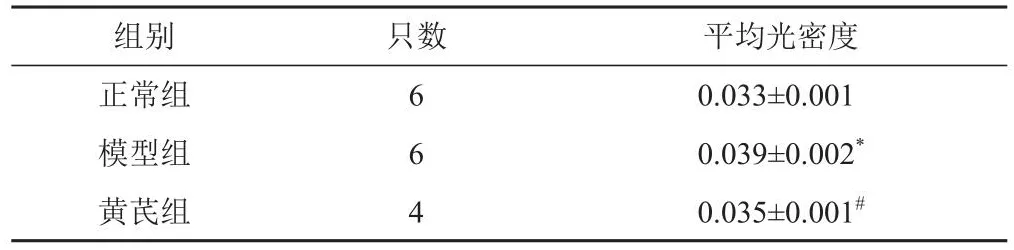
表3 各组小鼠视网膜组织CD105蛋白表达比较(±s,%)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别正常组模型组黄芪组只数6 6 4平均光密度0.033±0.001 0.039±0.002*0.035±0.001#
4.4 网络药理学分析结果
4.4.1 黄芪有效成分及靶点
通过TCMSP数据库检索,并根据OB≥30%、DL≥0.18筛选,得到黄芪有效成分6个,见表4。通过SwissTargetPrediction数据库检索6个有效成分对应的靶点信息,剔除重复靶点后,得到127个靶点。
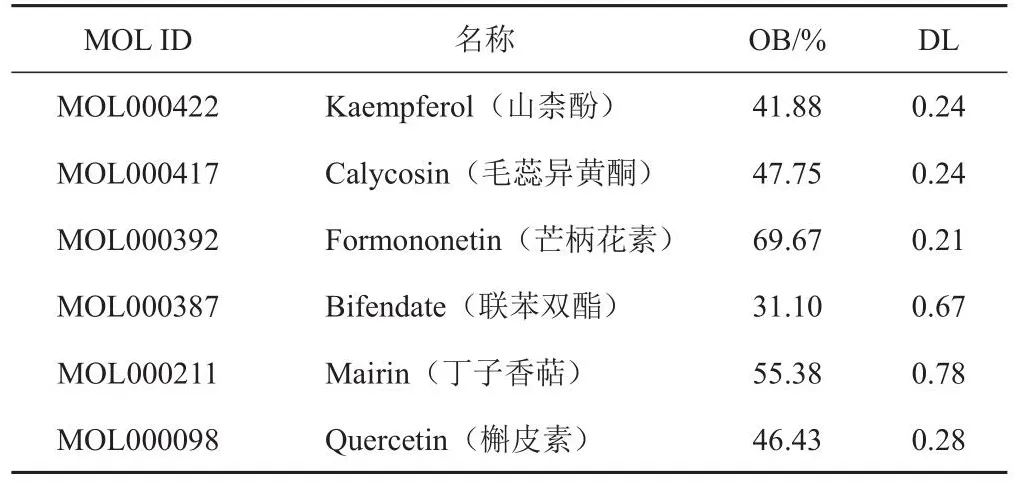
表4 黄芪有效成分信息(OB≥30%、DL≥0.18)
4.4.2 糖尿病视网膜病变相关靶点及交集靶点
在OMIM、GAD、TTD 3个数据库检索DR相关靶点,剔除重复靶点后,共获得650个靶点。采用Venny 2.1将有效成分靶点与DR相关靶点取交集,共获得58个交集靶点,韦恩图见图3。
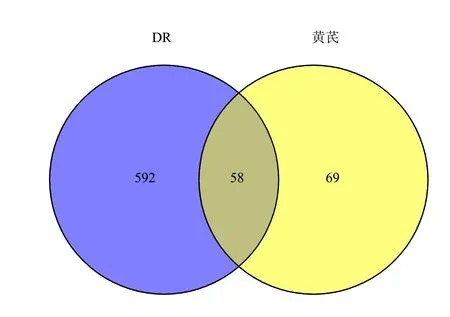
图3 黄芪治疗DR相关靶点韦恩图
4.4.3 蛋白相互作用网络与核心靶点
将58个交集靶点导入STRING数据库,得到PPI网络(见图4)。该网络由58个节点、30条边构成,平均节点数10.6。节点数靠前的靶点包括MMP2、GSK3B、EGFR、IL2、PPARG等。
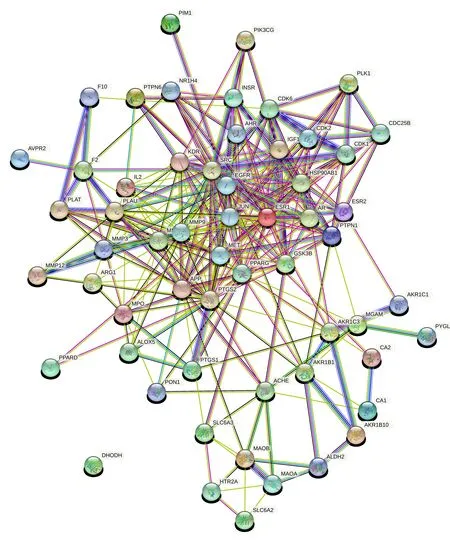
图4 黄芪治疗DR靶点PPI网络
4.4.4 GO功能和KEGG通路富集分析
将58个交集靶点导入DAVID数据库进行GO富集分析,以P<0.01为筛选条件,选取前20条基因信息绘制条图(见图5)。对交集靶点进行KEGG通路富集分析,共获得81条通路富集结果。根据P值由小到大选取前20条通路绘制气泡图(见图6)。
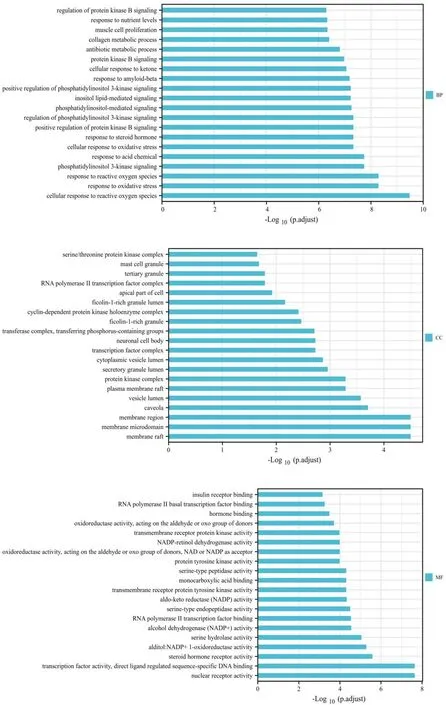
图5 黄芪治疗DR靶点GO富集分析
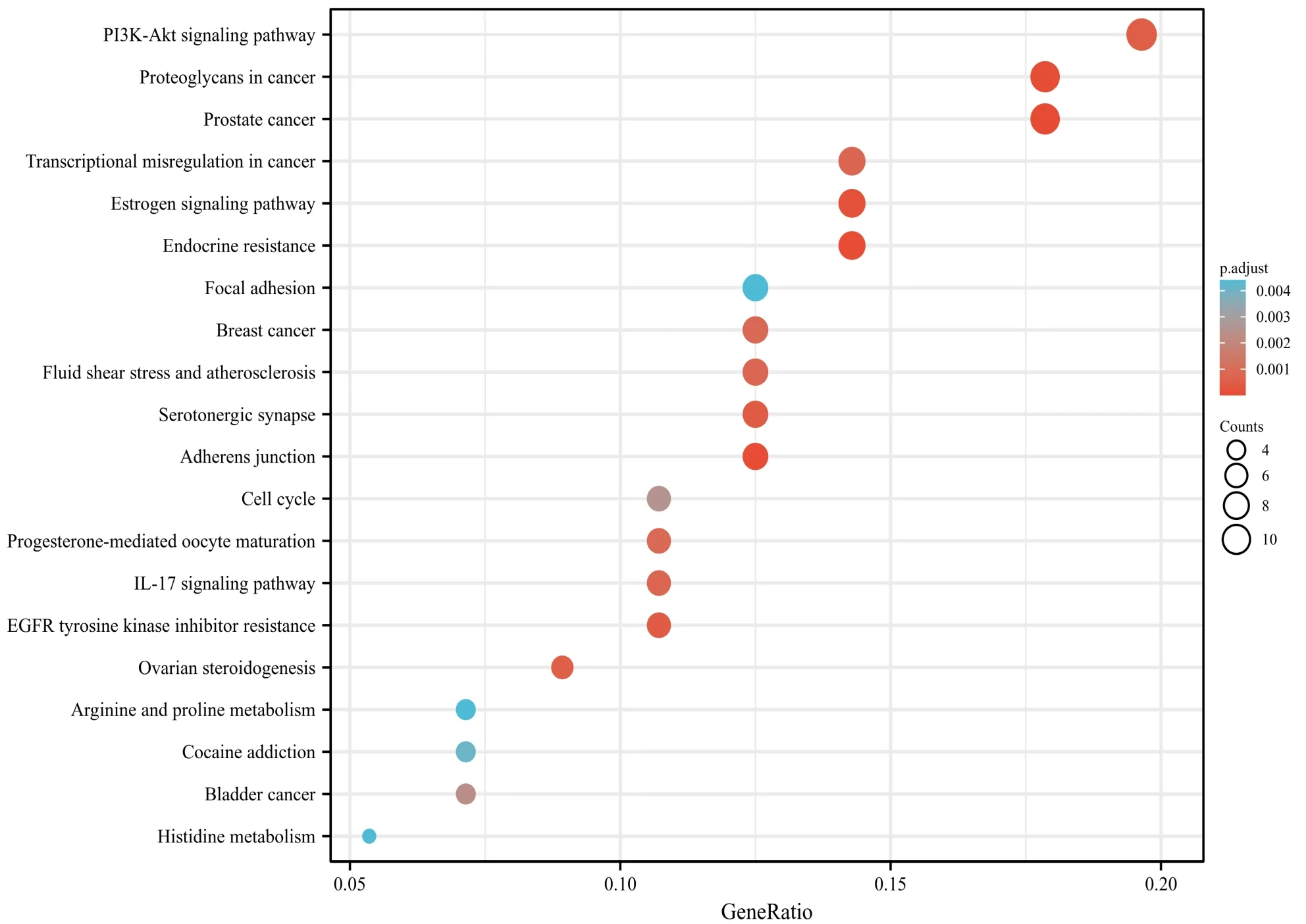
图6 黄芪治疗DR靶点KEGG通路富集分析
4.5 黄芪对模型小鼠视网膜组织基质金属蛋白酶2、糖原合成酶激酶-3β蛋白表达的影响
与正常组比较,模型组小鼠视网膜组织MMP2、GSK-3β蛋白表达明显升高(P<0.05);与模型组比较,黄芪组小鼠视网膜组织MMP2、GSK-3β蛋白表达明显降低(P<0.05)。结果见图7、图8、表5。
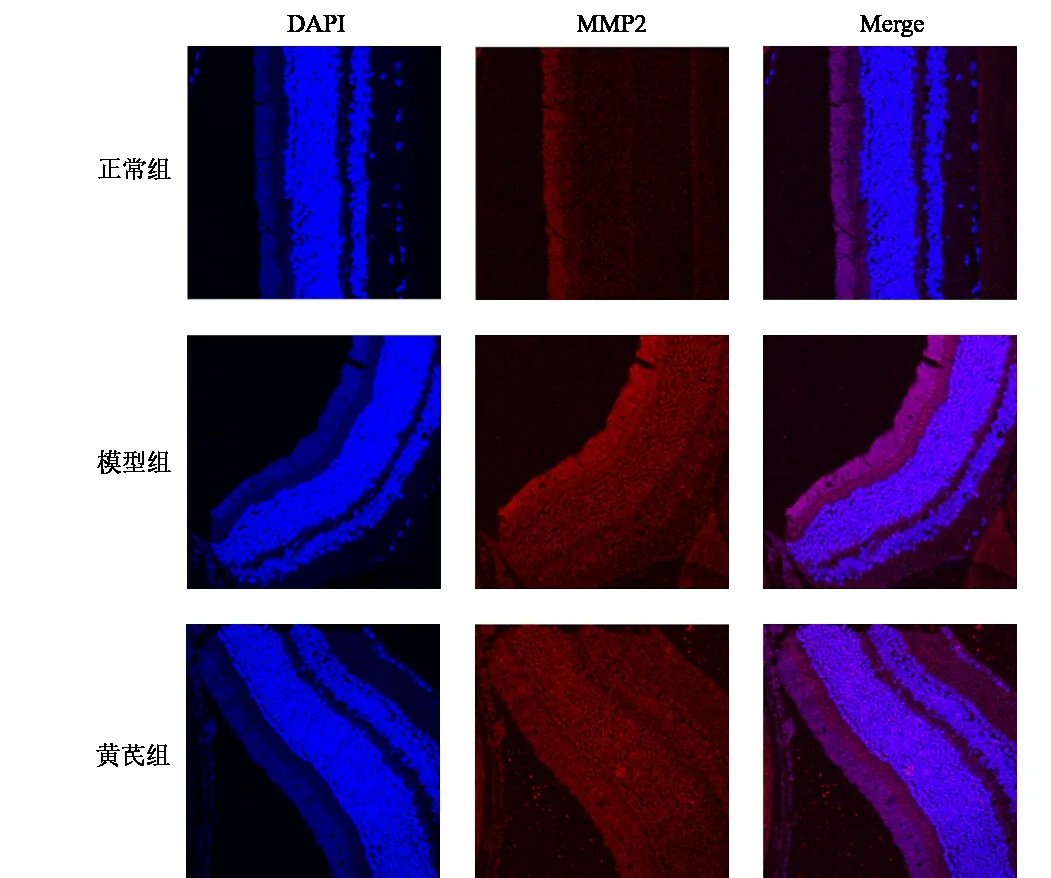
图7 各组小鼠视网膜组织MMP2蛋白表达(免疫荧光染色,×400)
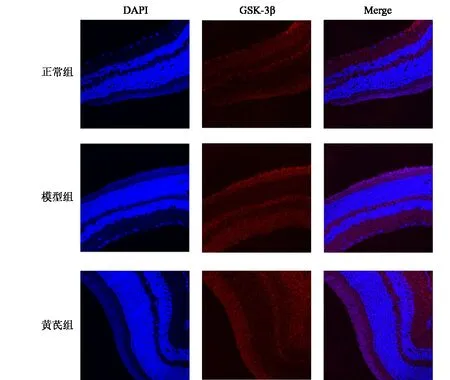
图8 各组小鼠视网膜组织GSK-3β蛋白表达(免疫荧光染色,×400)
表5 各组小鼠视网膜组织MMP2、GSK-3β蛋白表达比较(±s)
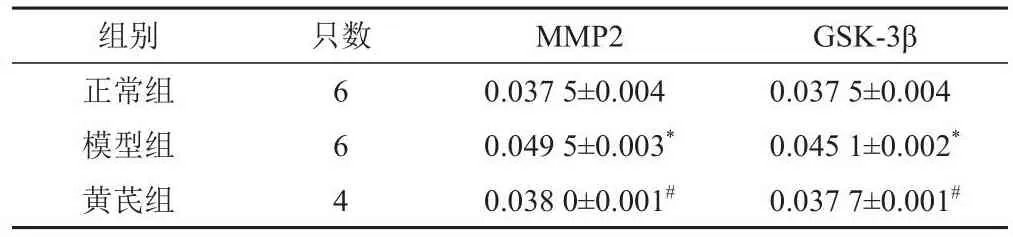
表5 各组小鼠视网膜组织MMP2、GSK-3β蛋白表达比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别正常组模型组黄芪组只数6 6 4 MMP2 0.037 5±0.004 0.049 5±0.003*0.038 0±0.001#GSK-3β 0.037 5±0.004 0.045 1±0.002*0.037 7±0.001#
5 讨论
DR属中医学“消渴目病”范畴[14]。刘完素指出,消渴可“变为雀目或内障”(《宣明论方·消渴总论》),《证治要诀》有“三清久之,精血既亏,或目无视”。其基本病机为本虚标实,以气阴两虚为本,瘀血阻络为标,临床上多用益气养阴、活血化瘀法治疗,效果显著[15-16]。黄芪是临床常用补气药,具有补气升阳、生津养血等功效,对糖尿病及DR有一定作用。
CD105是细胞表面跨膜糖蛋白,在增殖的内皮细胞上表达[17]。有研究表明,CD105可参与血管发育,是新生血管形成的主要标志物[18]。新血管生成是DR的临床特征之一,在DR的各阶段,患者血浆CD105水平均明显升高[19]。通过玻璃体注射DL-α-氨基己二酸建立视网膜新生血管疾病模型发现,模型组视网膜CD105表达较正常组明显升高[20]。本研究采用免疫荧光染色检测DR小鼠视网膜组织CD105表达,结果表明,模型组小鼠视网膜组织CD105蛋白表达较正常组明显升高,黄芪组小鼠视网膜组织CD105蛋白表达较模型组明显降低,说明黄芪能抑制新血管生成。
DR早期特征为血-视网膜屏障破坏,这与内皮细胞紧密连接结构破坏密切相关。MMP2是MMPs家族的一员[21],由内皮细胞分泌[22],并通过调节细胞外基质Ⅳ型胶原以平衡基质合成与降解,进而在维持细胞完整性和细胞存活之间发挥关键作用[23]。研究表明,抑制MMP2过表达可抑制视网膜毛细血管内皮细胞凋亡[24]。在DR晚期阶段,MMP2能促进新生血管生成[25],与非糖尿病组比较,患病12周的糖尿病大鼠视网膜MMP2 mRNA水平显著升高[26]。本研究采用网络药理学分析发现,黄芪多个有效成分对应靶点MMP2,采用免疫荧光染色进一步验证,结果表明,模型组小鼠视网膜组织MMP2表达较正常组明显升高,黄芪组小鼠视网膜组织MMP2表达较模型组明显降低,说明黄芪可能通过抑制MMP2表达抑制新血管生成。
DR发病机制与炎症密切相关,GSK-3β被认为是治疗炎症相关疾病的潜在靶点[27]。GSK-3β是一种丝氨酸/苏氨酸蛋白激酶,在细胞生长、凋亡、信号传导中发挥重要作用[28],其能够调节视网膜内皮细胞黏附分子的表达和细胞周期,进一步导致DR内皮功能障碍及血-视网膜屏障破坏[29]。在STZ诱导的糖尿病小鼠模型中,模型组视网膜组织GSK-3β表达显著升高[30]。本研究网络药理学结果表明,黄芪可调控GSK-3β,并且免疫荧光结果表明,黄芪能下调DR模型小鼠视网膜组织GSK-3β表达,提示黄芪可能通过GSK-3β改善小鼠DR。
综上所述,黄芪对DR有明显改善作用,其机制可能与下调CD105、MMP2、GSK-3β表达,进而抑制新血管生成有关。本研究初步探讨了黄芪防治DR的作用机制,可为临床应用黄芪治疗DR提供实验依据,但未考察不同剂量黄芪的作用效果,今后研究将进一步明确其量效关系。
