加州鲈鱼嗜水气单胞菌的分离鉴定与药敏试验
2023-04-15李文娟廖勤丰
李文娟,廖勤丰,何 航,张 超
(重庆三峡职业学院,重庆 万州 404155)
嗜水气单胞菌(Aeromonas hydrophila)在分类学上隶属弧菌科(Vibronaceae)气单胞菌属(Aeromonas)[1]。该菌广泛分布在水产养殖水体、食物和土壤中,可以侵染多种养殖鱼类,是鱼类暴发性疾病的主要病原[2]。加州鲈鱼学名为大口黑鲈(Micropterus salmoides),分类学上隶属于鲈形目(Perciformes)太阳鱼科(Cehtrachidae)黑鲈属(Micropterus),是一种原产于北美的重要游钓类、淡水食用性鱼类,该鱼生长迅速,抗病能力较强,肉质肥美可口,深得消费者喜爱,于20 世纪80 年代引入中国,并培养繁殖成功,成为中国重要的经济鱼类[3,4]。加州鲈鱼在初养殖时,抗逆性较强,较少发病。但随着养殖密度的增大和环境的恶化,发病率增加,疾病问题凸显[5]。2019年7—9 月重庆市万州区某养殖场加州鲈鱼发病,发病鱼体皮肤出现溃烂、充血,尾鳍腐烂、变形等症状,死亡率高达55%,剖检显示主要脏器伴有充血和肿大等症状。为了确定疾病病原,采取有效的防治措施,笔者对该病例进行了病原分离鉴定和药敏试验,现介绍如下。
1 材料与方法
1.1 样品
样品为重庆市万州区某养殖场有明显症状的自然发病的加州鲈鱼,5 尾,体长为10~15 cm。市场上购买规格大致相同的健康加州鲈鱼20 尾,暂养7 d,随机挑选进行回归感染试验。
1.2 主要试剂
普通营养培养基、DNA 试剂提取盒、DNA 回收试剂盒、DNA Marker 和引物均购自上海生物工程有限公司;生化试剂盒购自杭州微生物试剂有限公司;药敏纸片购自苏州神元科技公司。
1.3 方法
1.3.1 病原菌分离纯化 无菌采集发病鲈鱼的肝肾脾等病变器官,划线接种于制备好的琼脂糖培养基上,28 ℃培养24~30 h 后,挑取单菌落进行纯化培养。观察并记录菌落特征,进行革兰氏染色[6]。
1.3.2 生化试验 挑取分离纯化的单菌落按照细菌微量生化鉴定管的说明书检测该致病菌的生理生化指标。
1.3.3 16S rDNA 基因和gyrB检测 使用细菌基因组DNA 提取试剂盒提取待检菌株DNA。分别使用细 菌16S rDNA 引 物[7](16S-F:5′-AGAGTTTGATC CTGGCTCAG-3′ ,16S-R:5′-TACGGCTACCTTGTTACGACTT-3′)和气单胞菌特异引物gyrB[8](gyrBF:5′-GAAGGCCAAGTCGGCCGCCAG-3′,gyrB-R:5′-ATCTTGGCATCGCCCGGGTTTTC-3′)扩增。16S rDNA 引物扩增体系(25 μL)为模板5 μL,上、下游引物(20 μmol∕L)各0.5 μL,TaqDNA聚合酶(5 U∕μL)1.2 μL ,10×PCR 缓 冲 液5 μL,MgCl2(25 mmol∕L)5 μL,dNTP(10mmol∕L)0.8 μL,以无菌双蒸水补足。PCR 扩增程序为94 ℃预变性10 min;94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1.5 min,30 个循环;72 ℃延伸10 min。gyrB的扩增体系与16S rDNA相同,扩增程序除了56 ℃退火30 s 外,其余都相同。PCR 扩增产物经DNA 回收试剂盒回收后送至上海生物工程股份有限公测序分析。
1.3.4 系统进化树构建 用BLAST 对所测序列进行序列同源性检索。从GenBank 下载嗜水气单胞菌代表菌株15 株,将本研究测得的1 株菌株16S rDNA基因序列和gyrB基因序列与之比较。用CLUSTAL W 进行序列在线比对。基于序列比对结果,用MEGA 5.0 软件构建进化树。
1.3.5 回归感染试验 将市场上购买的加州鲈鱼挑选20 尾,分成2 组,每组10 尾,攻毒组注射浓度为3.0×107CFU∕mL 的菌液,每尾注射0.2 mL。对照组注射0.2 mL 的生理盐水。将试验用鱼置于水温为25 ℃的养殖箱中,每天观察并记录鱼的发病和死亡情况,持续时间为7 d。同时对濒临死亡具有典型症状的鱼或已死亡的鱼进行病原菌再次分离鉴定[3]。
1.3.6 药敏试验 药敏试验采用纸片扩散法。取少量菌液均匀染布于营养琼脂培养基平板上,菌液浓度为1.5×107CFU∕mL,置于28 ℃的恒温培养箱中培养24 h。测量抑菌圈大小,观察并记录数据,判定结果[9]。
2 结果与分析
2.1 病原菌分离纯化
分离的菌株菌落光滑、圆形,颜色为无色、灰白色或淡黄色,有特殊芳香气味。菌体两端稍微弯曲并着生鞭毛,可以运动,菌体周围有菌毛丛生,钝圆(图1)。
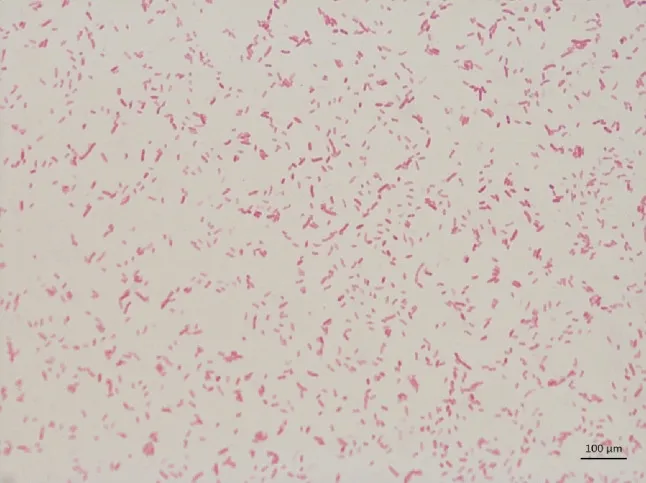
图1 细菌的革兰氏染色
2.2 生化试验
分离菌株有运动性,氧化酶反应、苯丙氨酸脱氢酶反应、V-P 反应、甘露醇反应、鸟氨酸脱羧酶反应阳性,能发酵葡萄糖、麦芽糖、D-半乳糖和纤维二糖,不能发酵阿拉伯糖,硫化氢反应、尿素反应呈阴性,初步鉴定该菌为嗜水气单胞菌。
2.3 病原菌16S rDNA、gyrB 基因的PCR 检测与系统进化分析
16S rDNA 基因扩增得到1 215 bp 的预期片段,gyrB获得198 bp 的预期片段(图2)。检测均显示阳性。PCR 产物经至宝生物科技公司测序后得到gyrB基因获取序列。将获得的序列通过NCBI 的Blast 进行比对,结果显示16S rDNA 和gyrB基因的测序结果与嗜水气单胞菌相关基因的同源性最高,均达99%。基于这2 个基因系统进化分析表明,试验所分离的菌株与嗜水气单胞菌位于同一分支(图3、图4)。
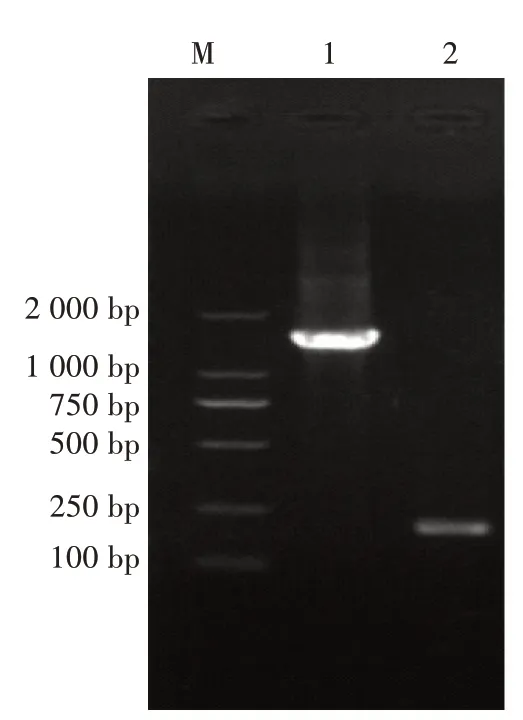
图2 扩增结果

图3 16S rDNA 的系统发育进化树(Ah0813 为分离株)

图4 gyrB 的系统发育进化树(Ah0813 为分离株)
2.4 回归感染试验
攻毒组加州鲈鱼5 d 内全部死亡,症状为体表有充血、全身水肿,剖检可见肝脏、脾脏、肾脏明显肿大、充血。对致死鱼进行细菌分离鉴定,通过对菌落的形态观察及显微镜下的结构观察,表现出与分离菌株相似的特征。回归感染中的对照组无死亡现象,活动正常,表明分离菌株为致病病原。
2.5 致病菌的药敏型检测
分离株对氨曲南、头孢他啶、头孢曲松等高度敏感,对氧氟沙星、氨苄西林等中度敏感,对其他数种抑菌药物如头孢唑啉、麦迪霉素等均呈现出一定的抗药性。
3 讨论
通过病鱼剖检和显微镜观察,排除了寄生虫感染。回归感染试验说明致病菌是由分离的优势菌株所致。PCR 扩增保守基因16S rDNA 和gyrB基因后,经测序通过NCBI 的Blast 比对显示,与嗜水气单胞菌的相似性最高。综合分析基本可以确定嗜水气单胞菌为致病菌。药敏试验表明,从患病鱼体中分离的嗜水气单胞菌其耐药谱较已经报道的菌株更加广泛,对氨苄西林、链霉素、妥布霉素、卡那霉素和麦迪霉素呈现明显抗性,表明其耐药性进一步增强,应该加强对该类致病菌的耐药性研究[10,11]。
嗜水气单胞菌是养殖水体中普遍存在的长居菌,新型致病菌株不断出现,引起养殖鱼类的大量发病或死亡,甚至威胁到人类的健康问题。正常情况下不会导致鱼类的发病,但随着工厂化集约养殖的密度越来越大,水体环境恶化没有及时改善,导致养殖鱼体免疫力下降,暴发严重的流行疾病,给养殖户造成重大的经济损失。
初步的流行病学调查表明,养殖密度过大是该病发生的主要原因。养殖户为追求效益,养殖密度过大,鱼的生存空间受到限制,影响鲈鱼的正常生长,造成疾病大面积流行。其次,养殖户缺乏水体养护意识,放养前没有对水体彻底翻塘消毒,对水体的氨氮、亚硝酸盐、致病微生物没有清理排除导致水体持续恶化,病原菌大量繁殖导致疾病发生。日常管理未做到“早发现、早治疗”,造成疾病的蔓延和恶化,应加强巡塘,及时采取措施,减少损失。
