复方牛至油纳米乳液制备及其对奶牛乳房炎四种病原菌的体外抗菌试验
2023-04-15张文娟朱小甫尹宝英熊忙利
张文娟,朱小甫,尹宝英,熊忙利
(咸阳职业技术学院∕咸阳市动物疫病分子生物学诊断技术研究重点实验室,陕西 咸阳 712000)
奶牛乳房炎是奶牛的三大重要疾病之一,全球每年因奶牛乳房炎造成的经济损失达数十亿美元。奶牛乳房炎是由机械性刺激、病原微生物侵袭、化学物理性损伤所引起的炎症,分为临床型乳房炎和隐性乳房炎2 种类型[1]。该病导致奶牛的产奶量急剧下降,甚至失去产奶能力,同时也会造成牛奶质量下降,其发病率为5%~45%。对奶牛乳房炎的治疗,国内外主要采用抗生素和化学合成药物,容易造成药物在牛奶中残留[2],长期使用可引起奶牛乳房菌群产生严重的耐药性以及对公共卫生健康造成危害等后果[3]。纳米乳液是将油、水、表面活性剂和助表面活性剂按适当比例混合而成的新型药物载体,透明或半透明,低黏度,为动力学和热力学稳定体系,粒径在1~100 nm。纳米乳液不仅制备简单,热力学稳定,还具有增加不溶性药物的溶解度、提高药物的生物利用度和提高易水解药物的稳定性等优点[4]。本研究将中草药提取物牛至油、丁香酚和化学药物醋酸氯已定进行复配,制备成复方牛至油纳米乳液剂,通过对奶牛乳房炎4 种病原菌进行体外抗菌研究,旨在为临床提供一种低耐药性、低残留、使用方便、安全、高效的新型纳米药物制剂提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 金黄色葡萄球菌、大肠杆菌、无乳链球菌、停乳链球菌,均由咸阳职业技术学院咸阳市动物疫病分子生物学诊断技术研究重点实验室保存。
1.1.2 培养基 营养琼脂培养基、营养肉汤培养基、血琼脂培养基、营养肉汤,均从青岛海博生物技术有限公司购买,自制血清肉汤。
1.1.3 试验药品 牛至油,济南凯茵生物科技有限公司生产;丁香酚,南昌贝塔生物科技有限公司;醋酸氯乙定,锦州九泰药业有限公司生产;蓖麻油聚氧乙烯醚(EL40)、氢化蓖麻油聚氧乙烯醚(RH40),西安晋湘药用辅料有限公司生产;吐温-80、乙醇、1,2-丙二醇、1,3-丁二醇、苏丹III 染液、亚甲基蓝染液,天津市科密欧化学试剂有限公司生产。
1.1.4 仪器设备 JEM-1230 型透射电子显微镜,日本JEOL 公司生产;TGL 16B 型台式高速离心机,湖南星科科学仪器有限公司生产;ZetasizerNano ZS 型激光粒度测定仪,英国Ma|vern instrument 公司生产;BS-210S 型电子分析天平,德国赛多利斯(sartorius)股份公司生产;超净工作台,苏净集团安泰公司生产;恒温培养箱,北京科伟永兴仪器有限公司生产;立式压力蒸汽灭菌器,上海博迅实业有限公司生产。
1.2 方法
1.2.1 复方牛至油纳米乳液处方优化 油相选择,纳米乳形成过程中,油应与表面活性剂保持进行互相作用,易于成膜[5]。油相的链越短,越易渗透到膜中,而碳氢链越长的油相,则会提高药物的溶解度。将牛至油和丁香酚按照质量比为2∶1 的比例进行混合作为油相。助表面活性剂选择,助表面活性剂的加入可以调节表面活性剂的亲水亲油平衡值,降低油水界面张力,提高界面膜的流动性,有利于纳米乳的形成[6]。选用无水乙醇、丙二醇、1,3-丁二醇作为助表面活性剂。表面活性剂的筛选及Km 确定,表面活性剂可按亲水亲油平衡值(HLB)来进行筛选,HLB 在3~8 的乳化剂可制备成油包水型(W∕O)纳米乳,HLB在8~16 的乳化剂可制备水包油型(O∕W)纳米乳[7]。本试验待选表面活性剂和HLB 均大于7,分别为EL40、RH40 和吐温-80。室温下,将上述3种表面活性剂分别与助表面活性剂按照Km 分别为2∶1、3∶1、4∶1 混匀,再与油相分别按质量比9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9 的比例混匀,搅拌后逐渐滴入蒸馏水,边加边搅拌,当水加到一定量时,体系会变黏稠,此时为油包水型,继续滴加蒸馏水,当体系突然变得不再黏稠时,即由油包水型转变为了水包油型,此时纳米乳液即形成。记录转相时添加的蒸馏水量,以表面活性剂、油和水的用量作为相图的3 个顶点,利用Origin pro 7.5 软件绘制三元相图,并根据乳化面积大小确定最佳的表面活性剂。复方牛至油纳米乳液制备,称取6 g 牛至油、3 g 丁香酚,将其置于烧杯中混合搅拌均匀,作为油相;然后称取27 g 吐温-80 作为表面活性剂,再称取9 g 乙醇作为助表面活性剂,将0.25 g 醋酸氯已定加入9 g 乙醇中,搅拌使其溶解,然后将其加入27 g 吐温-80 中搅拌均匀,制备成混合表面活性剂;然后将油相和混合表面活性剂混合,搅拌均匀,静置后逐滴缓慢向其中加入蒸馏水54.75 g,边加边搅拌,开始时体系黏度较小,随着水的加入,体系会变黏稠,继续滴加并不断搅拌,直至形成复方牛至油纳米乳液。采用染色法鉴定复方牛至油纳米乳液的结构类型。将亚甲基蓝和苏丹Ⅲ染液分别滴入纳米乳液中,观察2 种染料在纳米乳液中的扩散速度,判断其结构类型[8]。复方牛至油纳米乳液形态观察和粒径分布,将复方牛至油纳米乳液稀释10 倍,分为2 份。将1 份添加到涂有碳膜的铜网格中,2%磷钨酸负染30 s,自然蒸发后用透射电镜观察了纳米乳液的形态。另1 份用激光粒度分析仪测量其平均粒径和多分散系数。牛至油纳米乳的稳定性考察,将复方牛至油纳米乳液置于离心管中,10 000 r∕min 离心20 min,观察其外观是否清澈透明,有无分层、絮凝、脱色、破乳等现象。将3 批复方牛至油纳米乳液密封于玻璃瓶内,置于(4 500±500)lx 条件下,分别于0、5、10 d 观察其性状有无变化,并测定乳滴粒径大小。将3 批牛至油纳米乳密封于玻璃瓶内,置于(30±2)℃、相对湿度(65±5)%条件下6 个月,分别于1、2、3、6 月取样,观察其性状有无变化,并测定乳滴粒径大小。将3批复方牛至油纳米乳液密封于玻璃瓶内,置于(25±2)℃、相对湿度(60±10)%条件下12 个月,分别于0、3、6、9 月和12 月取样,观察其性状有无变化,并测定乳滴粒径大小。
1.2.2 复方牛至油纳米乳液的体外抗菌试验 菌液制备,将大肠杆菌、金黄色葡萄球菌、无乳链球菌和停乳链球菌分别挑取2~3 个接种环,接种到营养琼脂培养基中,并置于37 ℃培养箱中培养24 h。待菌种复壮后,将大肠杆菌和金黄色葡萄球菌分别接种至5 mL 营养肉汤培养基中,无乳链球菌和停乳链球菌分别接种至5 mL 血液琼脂培养基中,置于37 ℃恒温培养箱中进行6 h 的增菌培养。然后采用麦氏比浊法采用灭菌生理盐水将各试验菌稀释到大约0.5麦氏比浊标准(1×108CFU∕mL),置于4 ℃下保存备用[9]。打孔法,在普通营养琼脂平板上分别薄涂各种菌悬液,后在平板中央打φ 3 mm 圆孔,在孔中加入复方牛至油纳米乳液不同浓度稀释液30 μL,然后将接种平皿均置于37 ℃温箱中培养,每日观察记录结果,观察7 d。浓度稀释法,采用试管二倍稀释法测定复方牛至油纳米乳液对金黄色葡萄球菌、大肠杆菌、无乳链球菌和停乳链球菌的最小抑菌浓度(MIC)和最低杀菌浓度(MBC)测定。
MIC,每株菌株为1 组,共4 组,每组取10 根无菌试管,并进行编号。分别向大肠杆菌和金黄色葡萄球菌的1 至9 管中各加入2 mL 无菌营养肉汤,向无乳链球菌和停乳链球菌的1 至9 管中各加入2 mL 血清肉汤。然后分别向每组的第1 管中加入牛至油纳米乳液2 mL,混匀后吸取2 mL,加第2 管混匀,依次稀释到第8 管,从第8 管中取出2 mL 弃去,第9 管肉汤为对照组,第10 管药液为对照组。分别向1 至9管加入试验菌液0.1 mL(1×108CFU∕mL),摇匀。然后将各试管置于37 ℃恒温培养箱中培养24 h,通过肉眼观察无浑浊变化的最高药物稀释浓度作为MIC。
MBC,从肉眼未观察到细菌生长的透明管中取大肠杆菌和金黄色葡萄球菌菌液0.01 mL 接种到营养琼脂平板中,提取乳酸链球菌和停止乳酸链球菌菌液0.01 mL 接种到血琼脂平板中,置于37 °C 恒温培养箱中培养24 h。如果培养皿中的菌落数小于3,即可判定为无菌生长。以无细菌生长的最大稀释药物浓度作为MBC[10]。
2 结果与分析
2.1 复方牛至油纳米乳液的处方优化试验结果
2.1.1 复方牛至油纳米乳液的结构类型 牛至油和丁香酚(质量比2∶1)为油性相,蒸馏水为水相,吐温-80 与无水乙醇在混合表面活性剂中的质量比为3∶1,复合表面活性剂与油的质量比为4∶1 时,亚甲基蓝在纳米乳液中的扩散速度明显快于苏丹红Ⅲ,说明所制备的纳米乳液为水包油型(O∕W)。
2.1.2 复方牛至油纳米乳液的形态及粒径分布 经过透射电镜检测,复方牛至油纳米乳液乳滴呈圆球形,乳滴分散性良好,电镜照片见图1。Z-Average为33.4 nm,PDI为0.062,其粒径分布范围较窄,均为10~100 nm。复方牛至油纳米乳液的粒径分布见图2(数量分布)和图3(密度分布)。

图1 复方牛至油纳米乳液的透射电镜观测效果

图2 复方牛至油纳米乳液的粒径分布(数量分布)

图3 复方牛至油纳米乳液的粒径分布(密度分布)
2.1.3 复方牛至油纳米乳液的稳定性
1)外观。复方牛至油纳米乳液为淡黄色澄明液体,外观清澈透明,无分层、絮凝、脱色、破乳等。
2)高速离心试验。将复方牛至油纳米乳液于10 000 r∕min 离心20 min 后,仍为淡黄色澄清透明的液体,外观清澈透明,无分层、絮凝、脱色、破乳等现象,表明其稳定性良好。
3)光照试验结果。经过光照试验,复方牛至油纳米乳液外观清澈透明,无分层、絮凝、脱色、破乳等现象。其平均粒径随时间变化规律见表1,结果表明该制剂对光照稳定。
4)加速试验结果。经过加速试验,复方牛至油纳米乳液外观清澈透明,无分层、絮凝、脱色、破乳等现象。其平均粒径随时间变化规律见表1,结果表明该制剂在高温和高湿环境下贮存稳定。
5)长期试验结果。经过长期试验,复方牛至油纳米乳液外观清澈透明,无分层、絮凝、脱色、破乳等现象。其平均粒径随时间变化规律见表1,结果表明该制剂在长期贮存条件下性质稳定。

表1 复方牛至油纳米乳液的稳定性试验结果
2.2 复方牛至油纳米乳液的体外抗菌试验结果
2.2.1 打孔法 复方牛至油纳米乳液体外抗菌效果见表2。由表2 可知,复方牛至油纳米乳液对奶牛乳房炎4 种病原菌体外均有抑制作用,其对无乳链球菌和停乳链球菌抑制作用稍强于大肠杆菌和金黄色葡萄球菌。
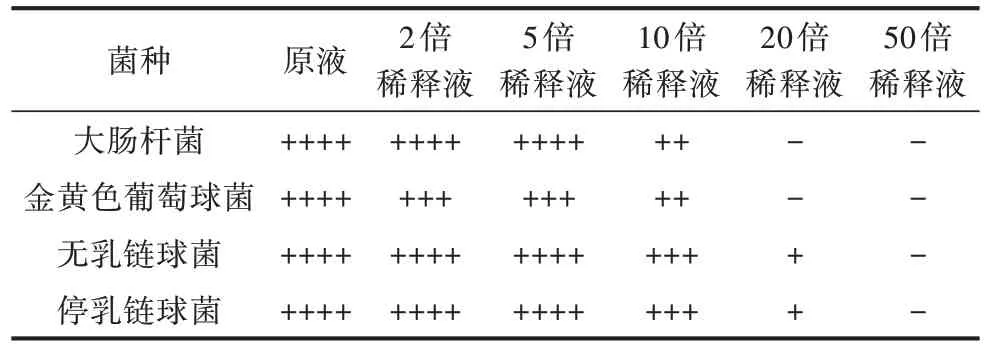
表2 复方牛至油纳米乳液体外抗菌效果
2.2.2 浓度稀释法 复方牛至油纳米乳液对大肠杆菌、金黄色葡萄球菌、无乳链球菌及停乳链球菌的MIC和MBC见表3。由表3 可知,复方牛至油纳米乳液对大肠杆菌、金黄色葡萄球菌、无乳链球菌和停乳链球菌的MIC分别为0.375、0.375、0.187、0.187 g∕mL,其MBC分别为0.750、0.750、0.375、0.375 g∕mL。结果表明,牛至油复合纳米乳剂对4 种病原菌均有较好的抑制作用,对大肠杆菌和金黄色葡萄球菌的抑菌和杀菌作用较弱,对无乳链球菌和停乳链球菌的抑菌和杀菌作用较强。

表3 复方牛至油纳米乳液对4 种病原菌的MIC 和MBC
3 小结与讨论
本研究采用滴定法建立了牛至油复合纳米乳液的伪三元相图,对牛至油复合纳米乳液的配方进行了优化,确定了最佳配方,并对其稳定性进行了测试。观察结果表明,以吐温-80 为表面活性剂时,所形成的纳米乳液的表面积最大,说明所形成的纳米乳液体系更稳定,因此选择了乳化能力强、高安全性的吐温-80 作为表面活性剂,无水乙醇作为表面活性剂,牛至油和丁香酚作为油相,蒸馏水作为水相。采用伪三元相图优化配方。结果表明,当Km为3∶1时,所形成的纳米乳液透明、稳定。由于醋酸氯乙酯可以溶解在无水乙醇中,因此将牛至油复合纳米乳液溶解在无水乙醇助表面活性剂中,最终制备出复方牛至油纳米乳液。用透射电镜对复方牛至油纳米乳液进行检测,发现液滴呈球形、分布均匀、无黏附、粒径分布窄。亚甲基蓝是水溶性染液,苏丹红Ⅲ是油溶性染液,本研究制备的复方牛至油纳米乳液,亚甲基蓝染液在其中的扩散速度比苏丹Ⅲ染液快,故判定为水油型(O∕W)纳米乳液。试验结果表明,牛至油复合纳米乳液在光照、高速离心、加速、长期试验过程中均呈现淡黄色透明液体。随着贮存时间的延长,液滴粒径略有增大,但变化不明显,始终在纳米乳液的粒径范围内,说明该制剂具有良好的贮存稳定性。综上所述,本研究制备的复方牛至油纳米乳液是一种淡黄色透明液体制剂,液滴平均粒径33.4 nm,该制剂制备工艺简单、重复性好、性能稳定、质量可控,工业生产方便[10-14]。
大肠杆菌、金黄色葡萄球菌、乳酸链球菌和乳酸链球菌是引起奶牛乳腺炎的主要病原微生物。使用抗生素治疗奶牛乳腺炎会导致药物在牛奶中残留,危及消费者的健康。中药治疗奶牛乳腺炎疗效高,复发率低,奶中无药物残留,是生产绿色食品的最佳选择。许多中草药具有抗菌作用,其中有些甚至优于抗生素。因此,从中药中寻找替代抗生素的药物用于治疗奶牛乳房炎,不仅可以促进乳品工业的可持续发展,而且可以减少抗生素的残留,具有很大的潜力,还可维护和提高消费者的生活质量。该研究通过打孔法和试管浓度稀释法测定了复方牛至油纳米乳液对奶牛乳房炎病原菌大肠杆菌、金黄色葡萄球菌、无乳链球菌、停乳链球菌的体外抗菌活性,2种试验结果基本一致,均表明复方牛至油纳米乳液对引起奶牛乳腺炎常见病原菌具有良好的抑菌和杀菌效果。该研究为临床防治奶牛乳房炎中药纳米制剂的开发提供了理论依据。
