水稻籽粒伸长突变体lgdp的鉴定与基因定位
2023-04-12林孝欣黄明江朱洪慧王子怡李忠成李彦羲李云峰
林孝欣 黄明江 韦 祎 朱洪慧 王子怡 李忠成 庄 慧 李彦羲 李云峰 陈 锐
研究简报
水稻籽粒伸长突变体的鉴定与基因定位
林孝欣 黄明江 韦 祎 朱洪慧 王子怡 李忠成 庄 慧 李彦羲 李云峰*陈 锐*
西南大学水稻研究所 / 西南大学农业科学研究院 / 转基因植物与安全控制重庆市重点实验室, 重庆 400715
水稻粒形与产量和营养品质密切相关, 挖掘水稻粒形发育相关基因并解析其分子机制, 对提高水稻产量、改善籽粒营养品质具有重要意义。利用甲基磺酸乙酯(ethyl methanesulfonate, EMS)处理籼稻品种西大1B, 获得了1个水稻粒形突变体, 命名为()。表现出外稃伸长, 从而导致籽粒长度增加的特征, 进一步扫描电镜分析发现,籽粒变长主要原因是其外稃细胞数目极显著增加。遗传分析表明该性状受1对隐性基因调控; 利用与ZH11杂交构建的F2分离群体, 通过BSA法将目标基因定位在3号染色体分子标记ZLN43和ZLN-1之间, 物理距离大约810 kb。通过转录测序和PCR分析初步确认候选基因编码一个MADS-box基因。qPCR分析表明,可能通过负向调控、、等水稻粒长正向调控因子的表达, 从而影响了颖壳细胞数目的增殖, 进而影响籽粒长度。本研究结果为应用基因改良水稻粒形提供了新的资源。
水稻; 粒形; 细胞数目; 基因定位
籽粒形态是影响水稻产量与品质的关键因素之一, 其中由长、宽、厚等性状共同决定的籽粒大小是影响水稻产量的一个重要因素, 而长宽比所决定的形态特征是重要的外观品质性状。水稻籽粒最外层是一层坚硬的颖壳(内稃和外稃), 在籽粒形成之后, 颖壳的大小不会再发生变化, 但是会随籽粒的发育进一步硅化、脱水、成熟。所以颖壳发育在很大程度上决定籽粒形态, 进而影响稻米的产量与品质形成[1]。
近年来, 人们鉴定了许多与水稻籽粒形态发育相关的基因, 它们中大多数都是通过调控颖壳的细胞增殖或(和)扩展, 进而决定籽粒形态, 最终在水稻的产量和品质构成中发挥重要作用。这其中大多数的基因按调控途径不同可以分为3类: (1) G蛋白信号途径: G蛋白复合体是一个由Gα、Gβ和Gγ三个亚基组成的异源三聚体。在水稻中,编码Gα亚基, Gβ亚基由基因编码, 通过影响细胞增殖正向调控颖壳发育, 突变后籽粒都变小[2-4];、、、、和编码Gγ亚基, 其中、和编码非典型的Gγ亚基, 研究表明和通过介导G蛋白信号传导正向调控籽粒长度,通过与或竞争性结合Gβ亚基负向调控籽粒长度[5-10]; 而和主要通过调控细胞激素的合成从而负调控水稻籽粒大小[11-12]。(2) 泛素蛋白酶体途径:基因编码一个RING-like E3泛素连接酶, 通过将底物锚定到蛋白酶体进行降解, 从而负调节细胞分裂, 突变后增加了颖壳细胞的数目, 最终粒宽和粒重增加[13]。基因编码一个具有去泛素化酶活性的蛋白酶, 通过影响颖壳细胞扩展来控制水稻籽粒的大小和形状[14-16]。/基因编码一个泛素特异性蛋白酶, 在体外具有去泛素化活性, 通过调控颖壳横向细胞增殖来正向调控水稻籽粒宽度[17]。(3) MAPK信号通路: 丝裂原活化蛋白激酶OsMKK4、OsMKKK10和OsMAPK6组成一个控制水稻籽粒大小的级联反应系统, OsMKKK10能与OsMKK4互作并将其磷酸化, OsMKK4继而磷酸化OsMAPK6, 因此, OsMKKK10、OsMKK4和OsMAPK6形成一个激酶级联模块, 调控颖壳细胞增殖, 最终正向调控水稻籽粒大小[18-20]。(4) 激素信号途径: 在水稻BR合成途径中,和基因都编码细胞色素P450家族蛋白, 是BR油菜素内酯素生物合成过程中的关键酶, 通过调控细胞扩展影响颖壳的发育, 正向调控籽粒大小[21-23]; 在水稻Auxin信号途径中,基因编码一个膜定位蛋白, 通过增加颖壳细胞增殖与扩展正向调控籽粒大小[24]。基因编码一个类家族成员的激酶[25], 能与Auxin应答转录抑制因子互作并将其磷酸化,增强OsARF4积累, 负调控Auxin信号, 减少颖壳中细胞的大小和数量, 从而负向调控水稻籽粒的大小[26-27]。除了这些在信号通路中的基因外,、、和等基因也参与了籽粒长度的调控; 其中具有转录激活活性, 可能作为一个转录激活因子发挥功能, 促进细胞分裂和细胞膨大调控籽粒大小[28-29];编码一个类似糖原合酶激酶GSK3的激酶, 是粒长和粒重的负调控因子, 能协同改变颖壳中细胞的大小和数量[25];编码一个拟南芥LONGIFOLIA蛋白的同源蛋白, 其表达量增加能促进谷粒的纵向细胞分裂, 并减少横向细胞分裂, 导致谷粒变得细长[30-31]。另外,编码IAA-葡萄糖水解酶, 在胚乳果皮的周围积累, 通过限制IAA的供应影响胚乳合体到细胞化阶段的转变, 从而限制了胚乳的细胞数目和籽粒长度, 而与颖壳的发育没有关系[32]。
随着越来越多的粒形突变体被挖掘, 通过对相关基因的功能研究和调控机理分析, 科学家们已经初步解析了调控水稻籽粒形态的分子机制。当前, 进一步鉴定特异的粒形基因资源, 对于完善水稻粒形遗传调控网络, 助力粒形分子设计育种仍然具有重要意义。
本研究报道了一个与水稻粒形发育相关的突变体, 主要表现为外稃伸长导致的籽粒伸长。遗传分析表明该突变性状受一个单隐性基因控制, 我们将其命名为()。通过基因定位, 我们将定位在3号染色体ZLN43和ZLN-1之间, 物理距离大约810 kb。该研究为水稻粒形分子设计育种提供了新的基因资源, 为基因的分子功能解析奠定了基础。
1 材料与方法
1.1 试验材料
突变体来源于保持系西大1B的EMS诱变群体, 连续多代自交和田间观察, 突变性状能够稳定遗传。以为父本, 温敏不育系56S、粳稻中花11 (Zhonghua 11, ZH11)和日本晴为母本, 分别配制杂交组合, 收获的F1和F2用于遗传分析。利用与ZH11杂交的F1和F2用于基因定位。所有材料种植在歇马实验田, 均由西南大学水稻研究所提供。
1.2 形态和组织学分析
在开花期, 使用NIKON SMZ1500体式显微镜分析野生型和突变小穗的表型特征。在抽穗期, 随机选取野生型和突变体小穗进行石蜡制片, 并在NIKON E600光学显微镜观察组织结构; 利用HITACHI SU3800扫描电镜观察野生型和突变体早期幼穗原基。
1.3 主要农艺性状分析
观察水稻野生型和的形态特征及农艺性状。开花期, 随机选取野生型和各10株, 统计每穗小花数; 抽穗期, 调查水稻的株高、节间长度、主穗穗长、一次枝梗数和二次枝梗数; 成熟后, 统计每穗实粒数、粒长粒宽和米长米宽, 并对成熟籽粒颖壳进行扫描电镜观察。
1.4 遗传分析
以和温敏不育系56S、粳稻中花11 (ZH11)和日本晴为亲本杂交获得F1代, 观察由F1代自交获得的F2代群体的分离情况, 并对群体中与突变体相似植株和正常单株进行统计, 利用SAS软件进行卡方测验。
1.5 基因定位与候选基因分析
利用BSA法定位目标基因[33], 采用CTAB法提取亲本和基因池DNA[34], 按碱煮法提取群体DNA[35]。SSR引物序列参照http://www.gramene.org/microsat/, 由北京擎科生物技术有限公司合成。定位区间的注释基因信息来源于生物学网站http://www.gramene.org/和http://rice. plantbiology.msu.edu/。
定位区间的候选基因序列差异分析使用转录组测序数据。在孕穗期, 分别选取野生型与突变体植株的3 cm长的幼穗, 送生物公司(北京诺禾致源科技股份有限公司)进行RNA的提取、建库测序和参考考基因组比对。比对结果转化为bam格式文件, 结合水稻参考基因组和注释文件使用IGV (Integrative Genomics Viewer)浏览器对bam文件进行可视化浏览, 在定位区间内比较野生型与突变体cDNA序列的差异。
1.6 qRT-PCR分析
在孕穗期, 分别选取野生型与突变体植株的3 cm长的幼穗, 提取RNA进行反转录合成cDNA用于实时荧光定量PCR。利用荧光(SYBR Green)定量PCR的预混体系和Bio-RadX96 PCR仪, 以作为内参, 设3次重复, PCR扩增程序如下: 95℃预变性60 s; 95℃变性15 s, 60℃退火15 s, 70℃延伸60 s, 共40个循环。所得数据使用2–ΔΔCt法计算RQ与SD值, 并使用检验法进行差异显著性检测。
2 结果与分析
2.1 lgdp突变体的表型分析
正常的野生型水稻小穗由1对退化的副护颖、1对护颖和1朵顶生小花构成。小花由外稃、内稃、浆片、雄蕊和雌蕊四轮花器官组成。副护颖和护颖及内外稃成1/2互生叶序排列在小穗轴与小花轴上, 内外稃边缘勾合, 能正常结实(图1A~D)。与正常的野生型水稻小穗相比,突变体小穗的内轮花器官基本没有变化, 但突变体外稃长度显著增加, 宽度显著减小, 质地薄软, 内稃退化(图1- F~I, K~N)。根据内稃主体退化程度, 将突变体分为2种类型: Type 1和Type 2。Type 1内稃主体完全退化消失,只留下与外稃勾连的边缘部分, 同时内轮花器官暴露在外(图1-F~I); Type2保留了内稃主体和边缘的完整形态, 内外稃边缘能正常勾合, 但是与野生型相比, 内稃主体部分明显变小, 同时但由于外稃显著伸长, 外稃上半部分不能与内稃形成完全的闭合结构(图1-K~N)。同时观察野生型水稻小穗的外稃和內稃主体部分的细胞组成, 发现其主要由硅化上表皮、纤维后壁组织、海绵薄壁组织和下表皮组成(图1-D)。与野生型水稻小穗相比,突变体2种类型的内外稃厚壁细胞明显减少, 而且上表皮的硅化程度明显减弱(图1-I, N), 这可能是导致颖壳韧性减少的主要原因。进一步利用扫描电镜观察野生型和突变体早期幼穗原基(小穗第6~7期), 发现野生型内外稃原基发育完整, 并呈现“半闭合”状态, 将内轮器官原基包裹在内(图1-E); 与野生型相比, Type1内稃原基已经出现“浅V状”开裂结构(图1-J); Type2内稃原基中部也出现明显的发育迟缓(图1-O), 这与成熟后内稃的退化表型是相符合的。根据表型分析结果,基因可能参与了水稻外稃和内稃主体部分的发育调控。

图1 野生型和突变体lgdp的表型观察
A: 野生型小穗; B: 图A中小穗去掉外稃后的形态; C: 野生型小穗的横切面; D: 图C的局部放大; E: 野生型早期幼穗原基; F, K:的Type1和Type2两种小穗类型; G: 图F中小穗去除外稃后的形态; H:小穗的横切面; I: 图H的局部放大; J: Type1早期幼穗原基; L: 图K中小穗去除外稃后的形态: M:小穗的横切面; N: 图M的局部放大; O: Type2早期幼穗原基。缩写: le: 外稃; sl: 护颖; lo: 浆片: pa: 内稃; pi: 雌蕊。标尺: A为22 mm; B为20 mm; C为240 µm; D为75 µm; E, J, O为100 μm; F, G, K, L为23 mm; H为300 µm; I为78 µm; M为300 µm, N为80 µm。
A: WT spikelet; B: the lemma and palea were removed in A; C: the transverse sections of WT spikelet; D: amplified part of Fig. 1-C; E: scanning electron microscopy (SEM) mi-croscopical structure of wild-type spikelet primordium; F, K: Type1 and Type2 spikelets of; G, L: the lemma and palea were removed in F, K; H: transverse sections of Type1spikelet; I: amplified part of picture H; J: SEM mi-croscopical structure of Type1spikelet primordium; M: transverse sections ofType2spikelet; N: amplified part of picture. O: SEM mi-croscopical structure of Type1spikelet primordium; le: lemma; sl: sterile lemma; lo: lodicule; pa: palea; pi: pistil; st: stamen. Bar: 22 mm (A); 20 mm (B); 240 µm (C); 75 µm (D); 100 µm (E, J, O); 23 mm (F, G, K, L); 300 µm (H); 78 µm (I); 300 µm (M); 80 µm (N).
2.2 lgdp突变体的农艺性状分析
对田间种植的野生型和突变体观察发现, 与野生型相比,突变体的株高显著增高, 增幅达到19.14% (图2-A, F)。统计节间长度和穗长, 发现突变体I至V节间(倒一节间至倒五节间)长度分别较野生型增长10.87%、6.73%、62.41%、298.89%、165.01%, 穗长也较野生型增长8.76% (图2-G, H); 这表明突变体株高增高是由节间长度和穗长伸长所致, 其中节间长度以IV至V增幅最为明显。突变体和野生型在枝梗数、每穗小花数和每穗实粒数也存在显著差异, 其中, 一次枝梗数和二次枝梗数各增多37.5%和19.84% (图2-I, J), 每穗小花数显著增多21.89% (图2-K); 但由于颖壳开裂, 突变体每穗实粒数、结实率和千粒重都极显著下降, 分别降低52.35%、53.33%和44.25% (图2-L, Q~R)。分析成熟籽粒和米粒, 发现突变体粒长显著伸长, 但米长有所下降; 同时粒宽下降, 米宽显著减少(图2-B~E, M~P)。因此突变体成熟籽粒相较于野生型显得更为细长, 但是米粒表现细小。

图2 野生型(WT)和突变体lgdp的株型与粒形
A: 野生型和的植株; B: 野生型和籽粒宽度比较; C: 野生型和籽粒(去壳)宽度比较; D: 野生型和籽粒长度比较; E: 野生型和籽粒(去壳)长度比较; F: 株高统计; G: 节间长度统计; H: 穗长统计; I: 一次枝梗数统计; J: 二次枝梗数统计; K: 每穗小花数; L: 每穗实粒数统计; M: 粒宽统计; N: 籽粒(去壳)宽度统计; O: 粒长统计; P: 籽粒(去壳)长度统计; Q: 结实率统计; R: 千粒重统计。**表示在0.01概率水平差异显著, *表示在0.05概率水平差异显著。标尺: A为40 cm; B为33 mm; C为40 mm; D为90 mm。
A: plants of WT and; B: the comparison of grain width between WT and; C: the comparison of kernel width between WT and; D: the comparison of grain length between WT and; E: the comparison of kernel length between WT and;F: the statistics of plant height. G: the number of internodes; H: the statistics of panicle height; I: the number of primary branch; J: the number of secondary branch; K: the number of spikelets; L: the number of seeds per panicle; M: the statistics of grain width; N: the statistics of kernel width; O: the statistics of grain length; P: the statistics of kernel length; Q: the statistics of seed-setting rate; R: the statistics of 1000-grain weight. ** and * indicate significant difference between WT andby-test at the 0.01 and 0.05 probability levels, respectively. Bar: 40 cm (A); 33 mm (B); 40 mm (C); 90 mm (D).
2.3 lgdp突变体籽粒颖壳细胞学观察
水稻籽粒形态主要由颖壳细胞数目和细胞大小决定。为进一步明确籽粒伸长的原因, 对野生型和突变体成熟籽粒颖壳进行扫描电镜观察分析。首先确定外稃长度较野生型增长11.46%, 但是内稃长度较野生型极显著减低(图3-A, B, G, H); 进一步观察野生型和同一行内外稃外表皮细胞数目, 发现与野生型相比内外稃外表皮上同一行细胞总数各增加11.66%和38.62% (图3-I, J); 同时在相同视野下观察野生型和内外稃外表皮细胞数, 统计分析细胞大小情况, 发现的内外稃外表皮细胞都较野生型变小, 其中外稃外表皮细胞减小34.94%, 内稃外表皮细胞减小15.25% (图3-K, L)。综上, 虽然颖壳细胞大小变小, 但由于外稃细胞数目增加幅度更大, 从而导致外稃和籽粒伸长; 而在内稃中, 由于细胞大小减小的幅度更大, 同时由于内稃主体部分的退化, 从而内稃的长度没有明显的增加。这些结果表明正向调控颖壳细胞的增殖, 同时负向调控颖壳细胞扩展。
2.4 lgdp的遗传分析
以突变体为父本, 温敏不育系56S、粳稻中花11 (ZH11)和日本晴(NIP)为母本, 分别配制杂交组合, F1植株表型未出现表型分化, 然后对F1进行自交, F2出现表型分离, 正常植株和突变植株数量之比经卡方验证符合3︰1 (表1), 这表明突变性状受1对隐性基因控制。

图3 野生型(WT)和突变体lgdp颖壳的扫描电镜(SEM)观察
A: 野生型的成熟籽粒颖壳; B:突变体的成熟籽粒颖壳; C, D: 扫描电镜观察外稃外表皮; E, F: 扫描电镜观察内稃外表皮; G: 外稃长度统计; H: 内桴长度统计; I: 外稃外表皮纵行细胞数目统计; J: 内稃外表皮纵行细胞数目统计: K: 外稃外表皮细胞大小统计; L: 内稃外表皮细胞大小统计。缩写: le: 外稃; pa: 内稃。**表示在0.01概率水平差异显著, *表示在0.05概率水平差异显著。标尺: A、B为5 mm; C~F为300 µm。
A: grain glume of WT; B: grain glume of; C, D: the epidermal cells of lemma of WT andwere observed by scanning electron microscope; E, F: the epidermal cells of palea of WT andwere observed by scanning electron microscope; F: lemma length statistics; G: number of longitudinal epidermal cells in lemma; H: number of longitudinal epidermal cells in palea; I: number of longitudinal epidermal cells in palea; J: number of epidermal cells in lemma per unit area. K: statistics of cell size of palea epidermis. L: statistics of cell size of lemma epidermis. le: lemma; pa: palea. ** and * indicate significant difference at< 0.01 and< 0.05 between WT andby-test, respectively. Bar: 5 mm (A, B); 300 µm (C–F).

表1 野生型和lgdp突变体F2分离的卡方测验
56S: 泸56S ; ZH11: 中花11号; NIP: 日本晴。56S: Lu 56S; ZH11: Zhonghua 11; NIP: Nipponbare.
2.5 LGDP基因的定位与候选基因分析
选用与ZH11的F2群体用于基因定位。首先在F2中选出10株突变单株和10株表型正常的单株构建突变池和正常池, 用先前筛选好的大约100对1B与ZH11差异SSR和In/Del标记筛选基因池, 发现位于3号染色体的SSR标记RM6038和RM1002在基因池间存在差异; 进一步用这2个标记突变体群体, 重组子个数分别为8个和4个, 根据重组子的从属关系将基因初步定位在RM6038和RM1002之间; 进一步在定位区间设计新的SSR和In/Del标记, 发现ZLN30、ZLN43、ZLN-1、ZLN46在亲本和基因池间呈现多态性, 进一步用其分析群体, 分别鉴定出重组子4、3、2和3个, 根据重组子的从属关系将基因初步定位在ZLN43和ZLN-1之间, 物理距离大约810 kb (图4-A)。为了确定候选基因, 首先利用转录组测序数据, 在定位区间中比较野生型和突变体表达基因的序列差异, 在中发现编码MADS-box的转录因子OsMADS1的第8外显子中有一段29 bp的缺失(图4-B); 进一步通过PCR验证了这个结果(图4-C); 在中该缺失会导致基因出现移码突变, 造成蛋白翻译的提前终止, 从而缺失C端的19个氨基酸残基(图4-C)。
2.6 粒形基因的表达分析
为探究调控粒长的机制, 我们对野生型与中已知的控制粒长的基因表达进行了qPCR分析。结果发现, 相比野生型,、、基因在中表达显著上调, 而、基因表达量变化不明显(图5)。由于、都是主要通过调控细胞分裂来正向影响籽粒的长度, 这表明基因可能通过负向调控、等粒长正向调控因子, 从而影响了颖壳的细胞增殖并决定籽粒的长度发育。另外,基因在突变体中的表达也出现显著上调, 然而该基因主要是通过抑制胚乳的发育影响粒长, 这可能与本研究中的米粒变细小有一定的关系。
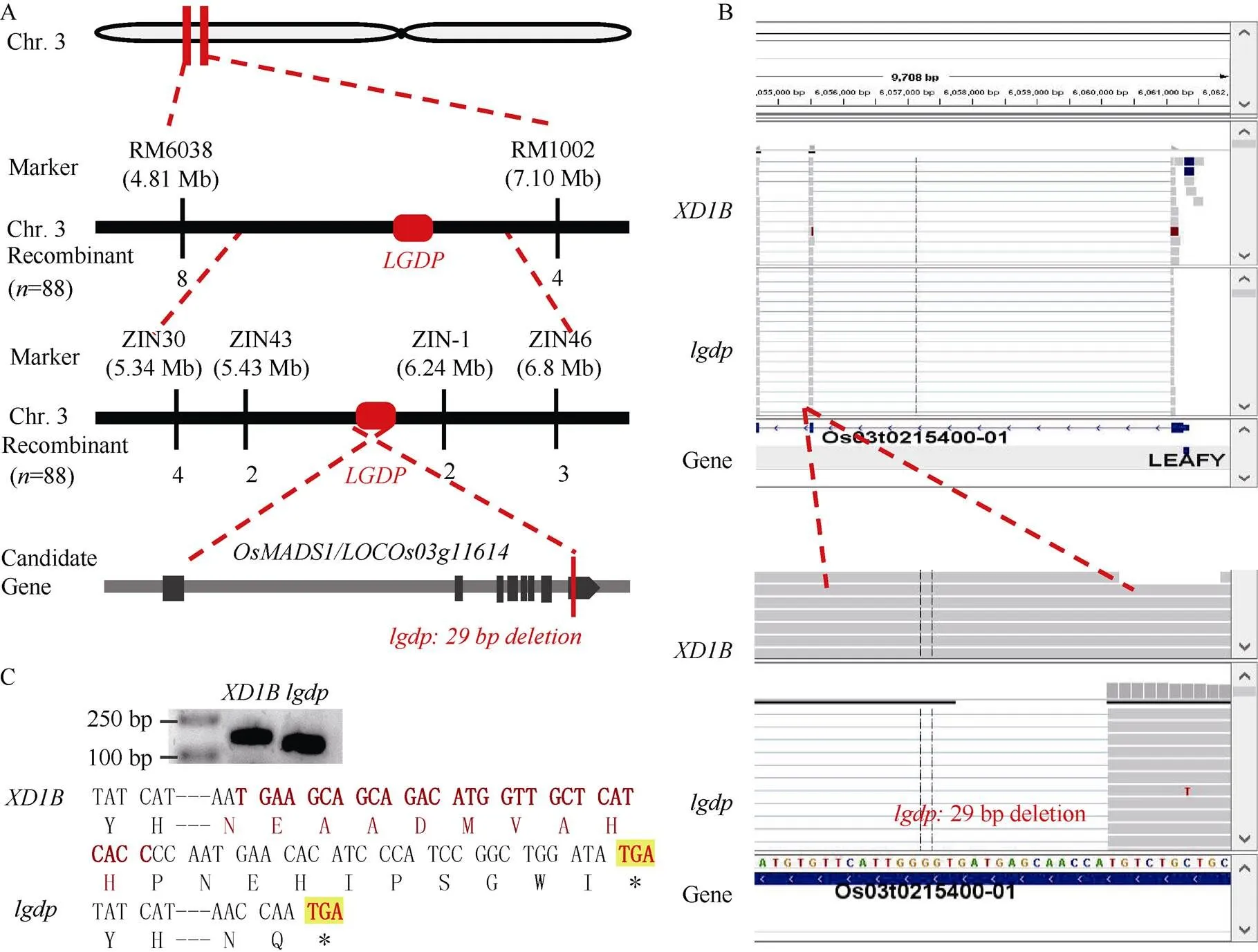
图4 LGDP基因的精确定位
A:基因的定位; B:候选基因的转录组测序分析; C:候选基因的PCR分析和序列比对。N: 天冬酰胺; E: 谷氨酸; A: 丙氨酸; D: 天冬氨酸; M: 蛋氨酸; V: 缬氨酸; H: 组氨酸; TGA: 终止密码子。
A: mapping of thegene; B: RNA-sequencing analysis ofcandidate gene;C: PCR analysis and sequence alignment ofcandidate gene. N: asparagine; E: glutamic acid; A: alanine; D: aspartic acid; M: methionine; V: valine; H: histidine; TGA: the terminate codon.

图5 粒形相关基因表达分析
将1B的穗中的转录水平设置为1.0, Bar值表示3个生物学重复的平均值±SD; **表示在0.01概率水平差异显著。
Set the transcription level in the panicle of 1B to 1.0, Bars represent standard deviation (= 3); ** indicates significant difference at< 0.01 between 1B andby-test.
3 讨论
水稻粒形是衡量稻米外观品质的主要指标, 同时也是影响水稻产量性状的重要因素之一, 因此克隆相关水稻粒形基因对于解析粒形发育调控分子机制具有重要意义。本研究中突变体属于长籽粒类型突变, 表型为外稃伸长变薄, 内稃主体或边缘退化, 我们将其定位到在ZLN43和ZLN-1之间; 进一步通过定位区间测序发现, 与野生型1B对比, 在突变体中编码一个MIKC型MADS-box家族蛋白第8外显子中有一段29 bp的缺失, 这表明突变体的表型是由的突变所引起的。()和()都是基因的等位突变体。突变体表现出内外稃伸长, 颖壳开裂, 雌雄蕊数目异常, 部分颖花甚至产生额外的小花[36];突变体的表型为内外稃过度生长且开裂, 种子裸露, 浆片同源转化为内外稃状结构等[37]; 这种突变程度较为严重的原因可能是突变位点发生在基因中更为保守的区域[36-37], 而突变表型主要位于颖壳上, 对应内轮花器官未见明显异常, 这表明突变体是的弱等位突变体。
在前人研究中还分离并克隆了一个控制水稻产量和提升稻米品质的重要基因QTL位点, 发现其就是的一个可变剪切形式的突变体, 该转录因子可以与G蛋白复合体γ亚基DEP1和GS3直接互作, 并促进对下游基因的转录活性, 从而参与介导了G蛋白对水稻粒形的调控途径[38]。可变剪接蛋白OsMADS1lgy3会产生细长粒, 提高稻谷的品质和产量。是的另外一个等位基因,6剪切方式的改变造成其粒重与产量的增加[39]。比较和、, 它们的突变位点都发生在蛋白质的C区, 说明C区的改变并不会造成基因功能的完全丢失, 但C区与颖壳长度密切相关。从表型和突变位点上看,、、都属于的弱等位突变体, 与不同的是,、后两者的籽粒略微伸长, 内外稃形态正常, 可以直接用于生产当中; 而的籽粒伸长程度虽然明显长于, 但是由于内稃退化, 而造成结实率有所下降, 不能直接利用于实际生长。虽然如此, 本研究为通过为核心的粒形分子设计育种提供了一个新的可能的思路, 即可以通过创造更多基因C区的等位突变体, 去挖掘出粒形更长且内外稃发育正常能直接用于实际生产的突变体; 或通过分子设计育种, 使的内稃形态缺陷恢复正常, 形成产量稳定的细长粒表型。
[1] 施思, 刘坚, 马伯军, 钱前. 水稻颖壳发育的研究进展. 中国稻米, 2012, 18(5): 25–29. Shi S, Liu J, Ma B J, Qian Q. Research progress of rice glume development., 2012, 18(5): 25–29 (in Chinese with English abstract).
[2] Ashikari M, Wu J Z, Yano M, Sasaki T, Yoshimura A.Rice gibberellin-insensitive dwarf mutant gene Dwarf 1 encodes the α-subunit of GTP-binding protein., 1999, 96: 10284–10289.
[3] Wang L, Xu Y Y, Ma Q B, Li D, Xu Z H, Chong K. Heterotrimeric G protein α subunit is involved in rice brassinosteroid response., 2006, 16: 916–922.
[4] Utsunomiya Y, Samejima C, Takayanagi Y, Izawa Y, Yoshida T, Sawada Y, Fujisawa Y, Kato H, Iwasaki Y. Suppression of the rice heterotrimeric G protein β-subunit gene, RGB1, causes dwarfism and browning of internodes and lamina joint regions., 2011, 67: 907–916.
[5] Mao H L, Sun S Y, Yao J L, Wang C R, Yu S B, Xu C G, Li X H, Zhang Q F.Linking differential domain functions of the GS3 protein to natural variation of grain size in rice., 2010, 107: 19579–19584.
[6] Sun H Y, Qian Q, Wu K, Luo J J, Wang S S, Zhang C W, Ma Y F, Liu Q, Huang X Z, Yuan Q B, Han R X, Zhao M, Dong G J, Guo L B, Zhu X D, Gou Z H, Wang W, Wu Y J, Lin H X, Fu X D. Heterotrimeric G proteins regulate nitrogen-use efficiency in rice., 2014, 46: 652–656.
[7] Fan C C, Xing Y Z, Mao H L, Lu T T, Han B, Xu C G, Li X H, Zhang Q F. GS3, a major QTL for grain length and weight and minor QTL for grain width and thickness in rice, encodes a putative transmembrane protein., 2006, 112: 1164–1171.
[8] Takano-Kai N, Jiang H, Kubo T, Sweeney M, Matsumoto T, Kanamori H, Padhukasahasram B, Bustamante C, Yoshimura A, Doi K, McCouch S. Evolutionary history of GS3, a gene conferring grain length in rice., 2009, 182: 1323–1334.
[9] Sun S Y, Wang L, Mao H L, Shao L, Li X H, Xiao J H, Ouyang Y D, Zhang Q F. A G-protein pathway determines grain size in rice., 2018, 9: 851.
[10] Huang X Z, Qian Q, Liu Z B, Sun H Y, He S Y, Luo D, Xia G M, Chu C C, Li J Y, Fu X D. Natural variation at the DEP1 locus enhances grain yield in rice., 2009, 41: 494–497.
[11] Tao Y J, Miao J, Wang J, Li W Q, Xu Y, Wang F Q, Jiang Y J, Chen Z H, Fan F J, Xu M B, Zhou Y, Liang G H, Yang J. RGG1, involved in the cytokinin regulatory pathway, controls grain size in rice., 2020, 13: 76.
[12] Miao J, Yang Z F, Zhang D P, Wang Y Z, Xu M B, Zhou L H, Wang J, Wu S J, Yao Y L, Du X, Gu F F, Gong Z Y, Gu M H, Liang G H, Zhou Y. Mutation of RGG 2, which encodes a type B heterotrimeric G protein γ subunit, increases grain size and yield production in rice., 2019, 17: 650–664.
[13] Song X J, Huang W, Shi M, Zhu M Z, Lin H X. A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase., 2007, 39: 623–630.
[14] Huang K, Wang D K, Duan P G, Zhang B L, Xu R, Li N, Li Y H. WIDE AND THICK GRAIN 1, which encodes an otubain-like protease with deubiquitination activity, influences grain size and shape in rice., 2017, 91: 849–860.
[15] Hao J Q, Wang D K, Wu Y B, Huang K, Duan P G, Li N, Xu R, Zeng D L, Dong G J, Zhang B L, Zhang L M, Inzé D, Qian Q, Li Y H. The GW2-WG1-OsbZIP47 pathway controls grain size and weight in rice., 2021, 14: 1266–1280.
[16] Wang S S, Wu K, Qian Q, Liu Q, Li Q, Pan Y J, Ye Y F, Liu X Y, Wang J, Zhang J Q, Li S, Wu Y J, Fu X D. Non-canonical regulation of SPL transcription factors by a human OTUB1-like deubiquitinase defines a new plant type rice associated with higher grain yield., 2017, 27: 1142–1156.
[17] Shi C L, Ren Y L, Liu L L, Wang F, Zhang H, Tian P, Pan T, Wang Y F, Jing R N, Liu T Z, Wu F Q, Lin Q B, Lei C L, Zhang X, Zhu S S, Guo X P, Wang J L, Zhao Z C, Wang J, Zhai H Q, Cheng Z J, Wan J M. Ubiquitin specific protease 15 has an important role in regulating grain width and size in rice., 2019, 180: 381–391.
[18] Guo T, Chen K, Dong N Q, Shi C L, Ye W W, Gao J P, Shan J X, Lin H X.negatively regulates the OsMKKK10-OsMKK4-OsMPK6 cascade to coordinate the trade-off between grain number per panicle and grain size in rice., 2018, 30: 871–888.
[19] Xu R, Duan P G, Yu H Y, Zhou Z K, Zhang B L, Wang R C, Li J, Zhang G Z, Zhuang S S, Lyu J, Li N, Chai T Y, Tian Z X, Yao S G, Li Y H. Control of grain size and weight by the OsMKKK10- OsMKK4-OsMAPK6 signaling pathway in rice., 2018, 11: 860–873.
[20] Duan P G, Rao Y C, Zeng D L, Yang Y L, Xu R, Zhang B L, Dong G J, Qian Q, Li Y H. SMALL GRAIN 1, which encodes a mitogen‐activated protein kinase kinase 4, influences grain size in rice., 2014, 77: 547–557.
[21] Li N, Xu R, Duan P G, Li Y H. Control of grain size in rice., 2018, 31: 237–251.
[22] Hong Z, Ueguchi-Tanaka M, Umemura K, Uozu S, Fujioka S, Takatsuto S, Yoshida S, Ashikari M, Kitano H, Matsuoka M. A rice brassinosteroid-deficient mutant, ebisu dwarf (d2), is caused by a loss of function of a new member of cytochrome P450., 2003, 15: 2900–2910.
[23] Tanabe S, Ashikari M, Fujioka S, Takatsuto S, Yoshida S, Yano M, Yoshimura A, Kitano H, Matsuoka M, Fujisawa Y, Kato H, Iwasaki Y. A novel cytochrome P450 is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant, dwarf11, with reduced seed length., 2005, 17: 776–790.
[24] Liu L C, Tong H N, Xiao Y H, Che R H, Xu F, Hu B, Liang C Z, Chu J F, Li J Y, Chu C C. Activation of Big Grain1 significantly improves grain size by regulating auxin transport in rice., 2015, 112: 11102–11107.
[25] Hu Z J, Lu S J, Wang M J, He H H, Sun L, Wang H R, Liu X H, Jiang L, Sun J L, Xin X Y, Kong W, Chu C C, Xue H W, Yang J S, Luo X J, Liu J X. A novel QTL qTGW3 encodes the GSK3/ SHAGGY-like kinase OsGSK5/OsSK41 that interacts with OsARF4 to negatively regulate grain size and weight in rice., 2018, 11: 736–749.
[26] Ying J Z, Ma M, Bai C, Huang X H, Liu J L, Fan Y Y, Song X J. TGW3, a major QTL that negatively modulates grain length and weight in rice., 2018, 11: 750–753.
[27] Xia D, Zhou H, Liu R J, Dan W H, Li P B, Wu B, Chen J X, Wang L Q, Gao G J, Zhang Q L, He Y Q. GL3.3, a novel QTL encoding a GSK3/SHAGGY-like kinase, epistatically interacts with GS3 to produce extra-long grains in rice., 2018, 11: 754–756.
[28] Hu J, Wang Y X, Fang Y X, Zeng L J, Xu J, Yu H P, Shi Z Y, Pan J J, Zhang D, Kang S J, Zhu L, Dong G J, Guo L B, Zeng D L, Zhang G H, Xie L H, Xiong G S, Li J Y, Qian Q. A rare allele of GS2 enhances grain size and grain yield in rice., 2015, 8: 1455–1465.
[29] Duan P G, Ni S, Wang J M, Zhang B L, Xu R, Wang Y X, Chen H Q, Zhu X D, Li Y H. Regulation of OsGRF4 by OsmiR396 controls grain size and yield in rice., 2015, 2: 15203.
[30] Wang S K, Li S, Liu Q, Wu K, Zhang J Q, Wang S S, Wang Y, Chen X B, Zhang Y, Gao C X, Wang F, Huang H X, Fu X D. The OsSPL16-GW7 regulatory module determines grain shape and simultaneously improves rice yield and grain quality., 2015, 47: 949–954.
[31] Wang Y X, Xiong G S, Hu J, Jiang L, Yu H, Xu J, Fang Y X, Zeng L J, Xu E B, Xu J, Ye W J, Meng X B, Liu R F, Chen H Q, Jing Y H, Wang Y H, Zhu X D, Li J Y, Qian Q. Copy number variation at the GL7 locus contributes to grain size diversity in rice., 2015, 47: 944–948.
[32] Ishimaru K, Hirotsu N, Madoka Y, Murakami N, Hara N, Onodera H, Kashiwagi T, Ujiie K, Shimizu B I, Onishi A, Miyagawa H, Katoh E.Loss of function of the IAA-glucose hydrolase gene TGW6 enhances rice grain weight and increases yield., 2013, 45: 707–711.
[33] Michelmore R W, Paran I, Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis: a rapid method to detect markers in specific genomic regions by using segregating populations., 1991, 88: 9828–9832.
[34] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8: 4321–4326.
[35] Sang X C, He G H, Zhang Y, Yang Z L, Pei Y. The simple gain of templates of rice genomes DNA for PCR., 2003, 25: 705–707.
[36] Jeon J S, Jang S, Lee S, Nam J, Kim C, Lee S H, Chung Y Y, Kim S R, Lee Y H, Cho Y G, An G. Leafy hull sterile1 is a homeotic mutation in a rice MADS box gene affecting rice flower development., 2000, 12: 871–884.
[37] Chen Z X, Wu J G, Ding W N, Chen H M, Wu P, Shi C H. Morphogenesis and molecular basis on naked seed rice, a novel homeotic mutation of OsMADS1 regulating transcript level of AP3 homologue in rice., 2006, 223: 882–890.
[38] Liu Q, Han R X, Wu K, Zhang J Q, Ye Y F, Wang S S, Chen J F, Pan Y J, Li Q, Xu X P, Zhou J W, Tao D Y, Wu Y J, Fu X D. G-protein βγ subunits determine grain size through interaction with MADS-domain transcription factors in rice., 2018, 9: 852.
[39] Wang C S, Tang S C, Zhan Q L, Hou Q Q, Zhao Y, Zhao Q, Feng Q, Zhou C C, Lyu D F, Cui L L, Li Y, Miao J S, Zhu C R, Lu Y Q, Wang Y C, Wang Z Q, Zhu J J, Shangguan Y Y, Gong J Y, Yang S H, Wang W Q, Zhang J F, Xie H A, Huang X H, Han B. Dissecting a heterotic gene through Graded Pool-Seq mapping informs a rice-improvement strategy., 2019, 10: 2982.
Identification and gene mapping of long grain and degenerated palea () in rice (L.)
LIN Xiao-Xin, HUANG Ming-Jiang, WEI Yi, ZHU Hong-Hui, WANG Zi-Yi, LI Zhong-Cheng, ZHUANG Hui, LI Yan-Xi, LI Yun-Feng*, and CHEN Rui*
Rice Research Institute, Southwest University / Academy of Agricultural Sciences, Southwest University / Transgenic Plants and Safety Control, Chongqing Key Laboratory, Chongqing 400715, China
The grain shape, which consists of grain length and grain width, is the primary determinant of grain yield and one of the important appearance quality traits in rice. It is of great significance to identify the related genes associated with grain shape and to study molecular mechanisms for improving the yield and quality of rice. In this study, a long grain mutant named() deriving from EMS (ethyl methane sulfonate) mutation groups of1B was reported.Inmutant, the elongation of lemma resulted in a long grain. Further SEM analysis revealed that the main reason for lemma elongation was the extremely significant increase in the number of glume cells. Genetic analysis showed that thetrait was regulated by a pair of recessive genes. Using BSA method and the F2population crossingwith ZH11, the target gene was located between the molecular markers ZLN43 and ZLN-1 on chromosome 3, with a physical distance of about 810 kb. The analysis of RNA-seq and PCR indicated thecandidate gene might encode a MADS-box protein. The qPCR referred thatnegatively regulated the relative expression levels of several positive grain length regulatory factors,,,, which affected the cell proliferation of glumes and the grain length. The results of this study laid a foundation for the molecular function analysis ofgene in the future.
rice (L.); grain shape; cell number; gene mapping
10.3724/SP.J.1006.2023.22028
本研究由国家自然科学基金项目(32172044)资助。
This study was supported by the National Natural Science Foundation of China (32172044).
陈锐, E-mail: chenruin998@gmail.com; 李云峰, E-mail: liyf1980@swu.edu.cn
E-mail: 2393551889@qq.com
2022-05-09;
2022-10-10;
2022-11-17.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20221116.1824.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
