土沉香优势结香真菌分离筛选及鉴定
2023-04-05陈彧周国英彭江涛董晓娜饶丹丹韩豫
陈彧,周国英,彭江涛,董晓娜,饶丹丹,韩豫
1.海南省林业科学研究院(海南省红树林研究院),海南海口 571100;
2.中南林业科技大学生命科学与技术学院,湖南长沙410004
土沉香(Aquilaria sinensis),又名白木香、女儿香、莞香、崖香,为瑞香科沉香属植物,国家二级重点保护野生植物[1-2],是中国名贵芳香类药材沉香的唯一植物来源[3],主产于海南、广西、广东、福建、台湾等省份及香港特别行政区。健康的土沉香植株,在人为或者自然方式胁迫条件下树干木材组织发生的生物化学防御反应,导致酯类物质逐渐增多的过程称为结香,形成的树脂的木块为沉香[4]。沉香因具有抗菌、抗氧化和抗肿瘤等药用功效[5],在亚洲、中东和欧洲被广泛用于医药。同时沉香具有独特的香味,也是一种传承历史悠久的名贵香料,品质好的沉香在市场上甚至可以卖到上万元或者几万元的价格,被称为“香中的钻石”[6-7]。随着沉香市场价格走高,土沉香的野生资源被人为滥伐,导致野生资源破坏。为了保护野生沉香资源,同时增加沉香产量,中国海南、广东、台湾、福建、广西等地开始了广泛的土沉香培育及促进土沉香结香技术研发工作。目前关于土沉香的结香机制,国内外学者开展了大量研究[8-16],无统一标准,但是大多数认为土沉香结香与真菌侵染有关。目前从土沉香植物结香部位分离出的内生真菌主要有黄绿墨耳菌(Melanotus flavolivens)、镰刀菌(Fusarium)、可可毛色二孢菌(Lasiodiplodia theobromae)、曲霉(Aspergillus)、砖红镰孢(Fusarium laseritum)、青霉(Penicillium)、毛霉(Mucor)、木霉(Trichoderma)、裂褶菌(Schizophyllum)、刺盘抱菌(Colletotrichum)等。但是关于是否促进土沉香结香还存在争议。该研究采用平板组织分离法从土沉香已结香部位分离内生真菌;选用沉香主要成分苄基丙酮筛选耐药性强的内生真菌;通过输液人工造香法测定内生真菌侵染力及促进结香研究,为后续高效生物复合结香诱导剂的研制及其应用奠定良好的基础,为沉香产业可持续性发展提供科学依据和理论基础。
1 材料与方法
1.1 试验材料
试验材料采自海南省海口市琼山区云龙镇海南省林业科学研究院(海南省红树林研究院)云龙科研基地(19°52′N,110°28′E)10 年生土沉香在人工创伤2 年自然结香木块。沉香样品采集后于48h内进行表面消毒。
1.2 供试培养基
PDA 培养基:将马铃薯刮去表皮,切成大小基本一致的小块,称取200g 去皮后的马铃薯小块,放入电磁炉中煮,煮至可用玻璃棒轻轻戳烂,之后用纱布过滤得到马铃薯滤液,往滤液中加入葡萄糖20g、琼脂20g,最后加蒸馏水定容至1L。PDB 培养基中不需要添加琼脂。
1.3 试验方法
1.3.1 样品的采集
利用已经消毒的生长锥进行取样。取样部位表面采用75%酒精进行消毒,取样后立即放入灭菌袋中,储藏运输。在进行下一次取样之前,生长锥用75%酒精和无菌水灭菌,最后用无菌滤纸擦拭。
1.3.2 内生真菌分离纯化
样品表面消毒,依次使用无菌水冲洗样品表面3 次,冲洗完之后将样品用灭菌好的镊子夹入75%酒精中自然漂洗30s,漂洗过后在反复使用无菌水冲洗样品表面3 次,冲洗完之后在将样品放入升汞中自然浸泡3min,最后在使用无菌水反复冲洗4 次;吸取最后处理样本的无菌水冲洗液涂布于完全培养基中作为相应的对照培养。若培养后出现菌落,则说明样品表面消毒不彻底。
样品表面消毒完成后,采用组织分离法用无菌刀片切去表面材料,将样品的结香部分均切成小块,将样品对称放置于含链霉素(50U/mL) 的PDA 平板上,恒温箱中28℃培养。待有菌落形成后,使用菌丝尖端挑取法,将长出的菌落菌丝体转接至新的PDA平板上,重复纯化3 次~4 次直至获得纯培养的菌株。
1.3.3 内生真菌分子鉴定
使用真菌基因组DNA 提取试剂盒,提取筛选出来的内生真菌DNA,利用真菌ITS 通用引物对从白木香中分离得到的内生真菌基因组进行PCR 扩增;初步了解内生真菌的分类地位。
1.3.4 促结香真菌筛选
(1)耐药性优势菌株筛选
配制PDA 培养基,待培养基冷却到50℃~60℃,往培养基里滴加2 滴0.10%吐温-80 作为乳化剂,加入沉香主要成分之一的苄基丙酮,快速混匀后倒平板,配置成体积分数为0.05%浓度的苄基丙酮培养基。用6mm 的打孔器在接有活化好的内生真菌的PDA 平板上打出直径约为6mm 的圆形菌饼,然后用灭菌接种针各挑取1 块圆形菌饼置于含苄基丙酮的培养基平板中央,同时以置于不含苄基酮的空白处理,每个处理和对照均设置3 次重复,置于26℃下恒温避光培养4d 后,观察真菌的生长状况,计算苄基丙酮对菌株的抑制率,选取对耐受能力较强的菌株进行下一步复筛。
(2)促结香真菌复筛
将分离出来并初步鉴定的内生真菌接种到PDB培养基中,28℃、180r/min 摇床培养7d~9d,液体培养物经慢速过滤得到孢子悬浮液备用。在8 年生土沉香植株高80cm 处用直径0.8cm 电钻打孔,采用输液法将发酵液注射入树体中,每个树体注入200ml发酵液。将孢子悬浮液接种到8 年生土沉香树上,每个菌种接种3 棵树,三个月后观察树体注射孔颜色变化,并采取部分材料进行燃烧,观察燃烧情况,根据燃烧香味,初步筛选优势结香真菌。
1.3.5 促结香真菌分子鉴定
由于单基因鉴定对亲缘关系较近的物种分辨率较低,鉴定误差也相对较高;因此针对促结香真菌,采用多基因进行联合鉴定,以确保鉴定的准确性。针对镰刀菌属促结香真菌,利用ITS、TEF、histone H3三基因进行PCR 扩增与鉴定;利用ITS、β-tub、RPB2 三基因对毛色二孢属的促结香真菌进行扩增和鉴定(引物序列、PCR 反应程序及体系见表1、表2),委托湖南某公司完成PCR 产物测序。将测序结果在NCBI 数据库中blast,在Gen Bank 数据库中下载同源性高的基因序列,利用mafft 软件进行比后,在SequenceMatrix 软件中进行多基因序列的连接,最后在MEGA 7.0 软件中构建系统发育进化树,从而确定筛选的促结香真菌分类地位。

表1 基因引物序列及PCR 反应程序Tab.1 Gene Primer Sequence and PCR Reaction Program

表2 PCR 反应体系Tab.2 The PCR Reaction System
2 结果与分析
2.1 内生真菌分离及鉴定
通过组织分离方法,共从土沉香结香木质部中分离纯化出34 株内生真菌,根据ITS 单基因测序鉴定结果,可以初步分为10 个属(镰刀菌属Fusarium、毛色二孢属Lasiodiplodia、间座壳属Diaporthe、Crassiparies、棒束孢属Isaria、拟茎点霉属Phomopsis、格孢腔属Pleosporales sp、轮层炭菌属Daldinia、环纹炭团菌属Annulohypoxylon、炭团菌属Hypoxylon),其中镰刀菌属4 个种共15 株占比44.11%、毛色二孢属2 个种共7 株占20.58%、轮层炭菌属2 个种5株占14.7%、Hypoxylon2 个种2 株占5.88%。
2.2 促结香真菌筛选结果
2.2.1 耐药性优势菌株筛选
将分离筛选的34 株内生真菌,分别接种在含有苄基丙酮(体积分数0.05%)的PDA 培养基上,同时接种在空白的PDA 培养基上,3 次重复(结果见表3)。从表3 可以得出,苄基丙酮对所分离的内生菌株均有一定程度的抑制作用,其中CX-3-2 的抑制率最低,为33.76%,该菌株的耐苄基丙酮的能力最强,CX-3 等15 个菌株的抑制率低于60%,具有一定的耐药性,初步入围耐药性优势菌株,主要为镰刀菌属和毛色二孢菌属真菌。

表3 优势耐药内生菌株耐苄基丙酮效果Tab.3 The Effect of Endogenous Fungi Resistant to Benzyl Acetone

注:菌落直径大小为3 次重复平均值,抑制率(%)=(对照菌落直径—处理菌落直径)*100/(对照处理直径-6);同行中的“**”标示在P<0.01 水平差异显著。
2.2.2 促结香真菌复筛
将2.2.1 初步筛选的15 株优势耐药内生菌孢子悬浮液接种到8 年生土沉香树上,每个菌种接种3 棵树。接种后三个月后,用砍刀将菌种发酵液注射孔及其周围的表皮去掉后,部分处理肉眼观察发现孔洞周围的木质部已经发黑变色,变色方向主要是向两端纵向延伸(图1),能引起树体接种口颜色变化的内生真菌分别属于镰刀菌属和毛色二孢菌属真菌CX-1-1、CX-G-3-2、CX-1-2、CX-G-2-2、CX-1-5和CX-C3-1。因此选定CX-1-1、CX-G-3-2、CX-1-2、CX-G-2-2、CX-1-5 和CX-C3-1。将取出的黑色木块组织肉眼观察无腐化烂木现象,且经燃烧试验后无异味黑烟,而是白色带有淡香的烟气。初步认为,变色树脂部分为沉香,所筛选的耐药菌可以促进结香。

图1 菌液对土沉香树体结香影响(A:注射菌液;B:侵染能力调查;C:注射孔颜色变化)Fig.1 Fungal Inoculation induces Agarwood in Aquilaria sinensis(A:Fungal Inoculation,B:Infection Investigation,C:Injection Hole Color Changes)
2.3 促结香真菌分子鉴定结果
将镰刀菌属真菌的三基因序列进行Nu-cleotide Blast 分析,结果显示CX-1-1 的ITS、TEF、histone H3 三基因分别与Genbank 登录号MT529824.1、MN386735.1、MK482251.1 均具有99%的同源性,CX-1-2ITS 基因与 Genbank 登录号MN871563.1 具有99%同源性,TEF 基因与Genbank登录号JQ412106.1 具有100%同源性,histone H3基因与Genbank 登录号KX681550.1 具有99%同源性;CX-G-2-2 的ITS 基因与Genbank 登录号MT509801.1 具有100%同源性,TEF 和histone H3基因分别与 Genbank 登录号 MK414218.1 和GU737427.1 均具有99%同源性;CX-G-3-2 的ITS 和TEF 基因分别与Genbank 登录号MF281192.1 和KC820964.1 均具有98%同源性,histone H3 基因与Genbank 登录号KM231522.1 具有100%同源性。如图2,CX-1-1 与Fusarium oxysporum、CX-1-2 与Fusarium fujikuroi、CX-G-2-2 与Fusarium proliferatum 和CX-G-3-2 与Fusarium solani 均聚在同一支,并且支持率分别为100%、95%、91%和100%。结合形态学特征可以将菌株分别鉴定为CX-1-1 为Fusarium oxysporum(尖孢镰刀菌)、CX-1-2 为Fusarium fujikuroi(藤仓镰刀菌)、CX-G-2-2 为Fusarium proliferatum(层出镰刀菌)、CX-G-3-2 为Fusarium solani(腐皮镰刀菌)。

图2 镰刀菌属三基因系统发育树Fig.2 Phylogenetic Tree Obtained from Combined Sequence Data of ITS,TEF and Histone H3 Gene Regions and Generated from Maximum Likelihood Analysis of Fusarium
毛色二孢属真菌三基因blast 结果显示:CX-1-5 的ITS、β-TUB 和RPB2 三基因分别与Genbank 登录号MN887200.1、MN867365.1 和MF410182.1 均具有100%同源性;CX-C3-1 的ITS 和RPB2 基因分别与 Genbank 登录号 MH644067.1 和XM_035516989.1 均具有99%同源性,β-TUB 基因与Genbank 登录号MG813976.1 具有98%同源性;如图3 所示,CX-1-5 与 Lasiodiplodia pseudotheobromae聚在同一分支,并且支持率有99%,CX-C3-1 与Lasiodiplodia theobromae 有97%的支持率聚在同一分支上;结合形态特征可将CX-1-5 鉴定为Lasiodiplodia pseudotheobromae(假可可毛色二孢)、CX-C3-1鉴定为Lasiodiplodia theobromae(可可毛色二孢)。
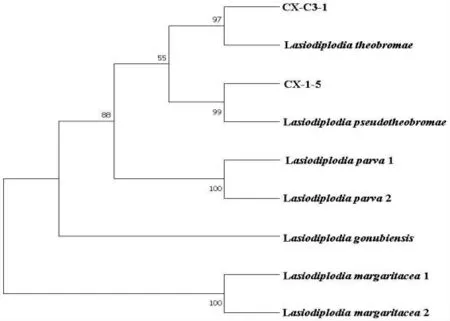
图3 毛色二孢属三基因系统发育树Fig.3 Phylogenetic Tree Obtained from Combined Sequence Data of ITS,β-TUB and RPB2 Gene Regions and Generated from Maximum Likelihood Analysis of Diospora
3 结论与讨论
3.1 结论
采用平板组织分离法从土沉香结香部位分离内生真菌,通过沉香主要成分苄基丙酮耐药性初筛及打洞输液法结香复筛土沉香优势结香真菌,并进行分子鉴定。从已结香的土沉香木质部中初步分离出内生真菌34 株,通过形态学及ITS 分子初步鉴定归于7 目7 科10 属,其中镰刀菌属(Fusarium)为优势属,其次为毛色二孢属(Lasiodiplodia)。经苄基丙酮耐药性及人工造香复筛,筛选出6 种优势促结香真菌,鉴定为尖孢镰刀菌(Fusarium oxysporum)、藤仓镰刀菌(Fusarium fujikuroi)、层出镰刀菌(Fusarium proliferatum)、腐皮镰刀菌(Fusarium solani)、假可可(毛色二孢Lasiodiplodia pseudotheobromae)、可可毛色二孢(Lasiodiplodia theobromae)。
3.2 讨论
内生真菌普遍存在于植物中,内生真菌的种类和数量与植物种类、生长环境、分离方法密切相关。该研究从已结香的沉香木质部中初步分离出内生真菌34 株,通过形态学及ITS 分子初步鉴定归于7 目7 科10 属,其中镰刀菌属为优势属,其次为毛色二孢属。张秀环等[17]从树龄为7a 的白木香健康部位和树脂形成部位共分离出42 株内生真菌,还发现枝顶孢霉属为健康部位优势菌属,青霉属为结香部位优势菌属,而Gong[18]和王磊[19]、黄秋伟[20]等人研究均发现白木香结香部位中优势属为镰刀菌属,马华明[21]通过对比土沉香创伤组和结香组真菌种类差异,认为括多变根毛霉(Rhizomucor variabilis)、再育镰刀菌(Fusarium proliferatum)和哈茨木霉(Hypocrea lixii),能促进沉香的形成。该研究结果与前人分离真菌结论有差异也有相似之处,这可能与样品的所处地域环境不同,该研究样品来自土沉香原生地-海南,属于潮湿温暖热带地区,微生物多样性更丰富,或者是环境条件这些外在因素影响了内生真菌的侵染和多样性,进一步验证沉香的形成是多种真菌复合作用的结果。
内生真菌与植株形成了互惠互利的共生关系,不但可以自身合成与宿主植物相似活性成分,还具有促进宿主植物合成活性成分的能力[22]。苄基丙酮是沉香芳香族化合物的代表性活性成分,对于促进结香的内生真菌首先在一定程度上对沉香活性成分具有耐受性[20]。该研究通过沉香主要成分苄基丙酮耐药性及人工造香筛选,筛选出6 株优势促结香真菌,经形态学及多基因系列分子鉴定为尖孢镰刀菌、藤仓镰刀菌、层出镰刀菌、腐皮镰刀菌、假可可毛色二孢、可可毛色二孢。Tabata 等人[23]研究发现5 种镰刀菌均能促使白木香结香。陈旭玉等人[24]研究发现沉香木中优势菌种为可可毛色二孢菌,在可可毛色二孢菌的发酵液中检测到茉莉酸类物质,并且白木香愈伤组织在被其发酵液处理过后,可以检测出3 种倍半萜物质[25]。腐皮镰刀菌与白木香粉末进行固体发酵,经过波谱分析鉴定出了7 种沉香的有效成分,腐皮镰刀菌的发酵液也可以诱导白木香产生倍半萜物质[26],并且在大米上进行发酵后,其发酵产物中含有脂肪烃类、甾体类和镰红菌素类[27]。尖孢镰刀菌的发酵液中会含有一种抗肿瘤的吲哚生物碱长春新碱和纤维素酶[28-29]。因此可推测在多种真菌的作用下,真菌和其发酵液产物对促进白木香结香均具有一定的作用,为下一步生物复合结香诱导剂的研制奠定基础。
