电性分析:促进化学学科理解的重要手段
——以钠、氯相关知识的教学为例
2023-04-03刘莹赵拯
刘 莹 赵 拯
(1.江阴市第二中学 江苏 无锡 214400;2.江苏省江阴高级中学 江苏 无锡 214443)
一、问题的提出
在《普通高中化学课程标准(2017年版)》中,明确地提出要进一步增进化学学科理解,并将化学学科理解定义为:教师对化学学科知识及其思维方式和方法的一种本原性、结构化的认识,它不仅是对化学知识的理解,还包括对具有化学学科特质的思维方式和方法的理解。[1]增进化学学科理解是落实学生学科核心素养的重要目标,是提升学科教学专业化水平的重要依据。如何通过培育学生的核心素养来提升其学科理解力是非常值得研究的课题。众所周知,高中元素化合物知识内容丰富、反应众多、转化复杂、应用广泛。如果没有形成化学学习方法,往往呈散点式学习,所学知识孤立、分散,缺少知识间的联系与对比,缺乏概念与理论之间的融合促进,无法揭示其内在本质规律,自然就无法形成化学核心素养,而大部分教师对此认识不足,主要原因就是学科理解不够。近年来,应用于真实化学问题情境的高考化学试题呈不断上升趋势,但师生对于该试题的解答却往往不得要领,表层原因是元素化合物知识学习不得要领,深层次原因在于对化学反应过程的本质认识不深、思维训练不足。受到有机反应机理中电性分析的启发,笔者尝试对高一钠和氯元素相关知识进行再设计,从学科理解角度来启发研究学习的新视角,共同提高师生对化学学科的深度理解。
二、研究思路
化学原理和化学知识是相互联系、相互促进、螺旋式上升的。化学原理性知识是化学元素知识的内在本质表现,只有对原理性知识有深入理解,才能立体地掌握化学元素化合物基本性质;化学知识的迁移应用是化学元素知识的外在实用体现,表现出化学知识学习的意义和价值。在有机化学学习过程中,东北师范大学的郑长龙团队就通过醛的结构与性质进行学科理解研究。[2]其中一个重要的观点,就是从电子云角度和键的极性来预测和验证醛类性质。根据学生已有的知识水平,我们将电子云、分子极性等知识简化为电性作用,同时利用氧化还原反应和离子反应的相关内容知识,在一定层面上解释和预测化学变化中的一些原理性知识。化学学习是累积、递进式进行的,在教学设计时,笔者采用整本书整体设计,采用“左顾右盼,瞻前顾后”的方式进行备课,具体为学习钠和氯元素相关性质时,回顾运用前面学过的氧化还原、离子反应等相关知识,也为后续的元素原子性质和化学键等内容积累素材;同时在类似知识之间进行比较,寻找相同点与不同点,从而整体认识物质的性质。
三、教学过程主要片段
在进行高一必修1 的教学时,全教研组对全书内容通读研究,厘清内在逻辑性,特别在物质分类与转化、氧化还原反应和离子反应等知识的教学时,就考虑到后续元素化合物知识的需求,同时将最后一章的元素周期律相关内容在讲授元素性质时有意识地渗透。在教学实践中,我们在学习离子反应、电解质时,花了较多时间来建立微粒电性模型。具体设计如下:
1.氯化钠是如何溶于水的?初步建立微粒电性模型
氯化钠固体溶于水,学生的直观感受集中在固体体积变小并消失上。如果这样描述实验现象,思维仍停留在宏观层面。在电解质概念学习时,以氯化钠为例,教师通常聚焦于溶液中自由移动的钠离子与氯离子,认为电离是在水的作用下氯化钠离解成氯离子和钠离子,通过电离方程式书写后就结束了该内容的教学。在初三化学学习时,学生已具备氯化钠由氯离子和钠离子组成的基本认识。在高中教学时,我们不仅要将眼光放在氯离子和钠离子上,更需要关注到水分子的作用,要启发学生关注微观层面,结合图像从微观层面来想象钠离子和氯离子是怎么被水分子“抬”入溶液。根据教材图片信息提示(见图1),引导学生观察水分子在钠离子和氯离子周围的取向,将之类比于磁铁的磁性作用,建构水分子电性模型:氧原子吸引电子能力比氢原子强,所以在氧原子一边显负电性,氢一头显正电性,化合价的正负性与之呼应。根据电性的信息,对水分子建构一边带正电,一边带负电的微粒电性模型,见图2:

图1 氯化钠固体溶于水的微观表征
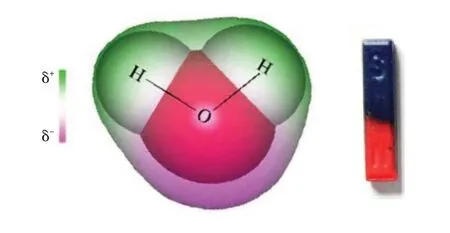
图2 氯化钠固体溶于水的微观表征
该模型能很好地从微观层面解释氯化钠在水中的电离机制。那这个模型是否具有一定的科学性呢?那就带领学生用摩擦毛皮的塑料棒吸引细水流实验来验证(如图3所示)。我们继续扩展:如何解释氯化氢极易溶于水?氯化氢中由于氯原子和氢原子对电子吸引力不同,氯原子端显负电,氢原子端显正电,在水分子的电性作用下发生“撕裂”成自由移动的阴阳离子。

图3 水流在电性作用下偏转
评析:宏观辨识与微观探析是化学核心素养的重要组成部分。在高中教学中,要注意培养学生从宏观层面深入到微观层面的认识视角。通过整本书的设计,我们认为,在水分子电性模型上花精力是值得的,因为后续很多内容都能通过微粒电性模型来解释与推理。虽然氯化钠溶于水并不是难点,但其中水分子作用及其机理却是值得深入研究的。鉴于学生认知,水分子微粒电性模型时,显得相对粗糙,甚至不够严谨,但模型构建主要揭示其关键要素,忽略次要因素。如何判断模型的优劣,关键在于能否解释现象,解决问题。
2.进一步厘清并补充适量的原理性知识,为学生的积极建构提供足够的支持
在学习钠和氯相关性质知识之前,复习回顾1-18号元素符号和原子核外电子排布式。再针对原子核外电子排布,介绍因发现了六种稀有气体,1904年的诺贝尔化学奖授予了英国化学家威廉·拉姆塞的化学史。为什么稀有气体的发现如此重要呢?因为稀有气体揭示了各种元素原子核外电子得失趋向的问题。我们知道,化学变化往往是最外层电子发生转移。为此,我们介绍电子式,让学生明确电子式的特点和意义。明确原子间可以通过电子转移形成相对稳定的水分子、氯气、氯化氢和氯化钠等物质。
评析:化学是在分子、原子角度研究物质组成和性质的学科。原子最外层电子与化学性质密切相关,根据这个逻辑很顺畅地引入电子式,并通过这种化学用语来表示常见的物质。其中,诺奖的引入以及稀有气体的单原子分子的事实,让学生感受到电子式的意义与价值。虽然这部分内容是安排在必修1 第四章“物质结构和元素周期律”中,但教学中将之提前引入并应用,并不感觉到突兀。当然,也只介绍最常见且马上需要的物质电子式,学生学习难度并不大。事实上,电子式的提前引入和应用,也为后续化学键提供了大量事实性的素材,有利于化解化学键过于抽象的问题。
3.钠相关化学反应原理的研究,初步运用微粒电性模型来表示物质的反应
结构决定性质,这是化学学科的大概念。根据钠原子的结构示意图,预测金属钠具有很强的还原性。根据钠与氧气反应的实验现象,得出钠与氧气反应生成氧化钠、过氧化钠。在此基础上,师生合作写出钠与氧原子的电子式来表示形成氧化钠和过氧化钠的过程。通过符号表征,深刻观察到钠与氧原子之间的电子转移情况。观察氧化钠的电子式,氧化钠中O2-离子,与水接触时即发生电性作用分裂为两个OH-,电子式表示如下:。这样推理是否有道理呢?进行实验,氧化钠加水再滴入酚酞变红,确实发生了反应。接着进行过氧化钠与水反应的实验,感受到试管壁发烫,滴加酚酞,溶液先变红后褪色,并产生使带火星的木条复燃的气体。有了前面模型推演的基础,师生共同合作进行了电子式推理,分析如下实验过程中有氢氧根生成,使酚酞变红;过氧化氢的氧化性使酚酞漂白而褪色;反应放热过氧化氢受热分解。
评析:在钠与氧气的反应中,师生合作练习电子式的表示方式。针对氧化钠,借助水分子的微粒电性模型,与氧化钠中的O2-离子发生作用,预测并通过实验验证,说明了微粒电性模型的有效性,同时与电子式的符号表征得到印证。对于现象相对复杂的过氧化钠与水的反应,我们先实验演示,再用电子式的电性作用推理,与实验现象进行互相验证,初步形成了用电子式结合微粒电性模型研究化学反应的方法。整个过程,学生既感觉到具有很大的挑战性,又体验到明显的成就感,这对于激发学生勤于思考、乐于探究,具有很好的引领作用。
4.深入探索氯气与水反应机理,提升对电性作用模型迁移应用能力
通过前面的探索,我们坚定了化学学习是有规律的,规律是可以探索的。教师的重要作用是提供工具,启迪方法,激励自主探究。下面进一步研究氯气溶于水的实验。首先提出问题:氯化氢在水中溶解度极大,但为什么氯气的溶解度就不大呢?写出两种气体的电子式,氯化氢对外显电性作用,而氯气分子Cl Cl,由于电荷均匀分布,所以不像氯化氢那样对外显电性,根据微粒电性作用很容易解释氯气在水中的溶解度相对比较小的原因。将氯气通入水中形成饱和溶液,在其中滴加硝酸银溶液,有白色沉淀析出,说明氯气与水发生了反应。这就与氯气不显电性,难以与水分子作用产生认知冲突了。教师启发:铁块没有磁性,但如果被磁铁吸引,也有可能产生磁性。那么氯气分子在水分子电性的“诱扰”下,氯分子可能在端点上显示少量的电性,在这少量电性的作用下,水分子带负电性的部分就会与正电性部分的氯原子作用,并形成HOCl(习惯上写成HClO,即次氯酸),另一个氯原子转化为Cl-,水中一个氢原子转化为H+,电性模型分析:。当然水分子对氯分子的“诱扰”作用是微弱的,自然氯气与水反应程度也很微弱。而产物氯离子也是带有负电性,次氯酸中的氯原子又与氧共用电子,共用电子偏向氧原子而带正电性(化合价为+1),那么,两个不同的氯之间同样会有电性作用,反向结合成氯气的趋势,而且一旦两个氯结合成氯气,次氯酸剩余部分就生成负电的OH-,溶液中的H+与OH-迅速结合成水分子。这种对于反应本质的研究,对于后期可逆反应的建构具有极大的促进作用,还有一个额外收获就是意识到体系的酸碱性在一定程度上也会影响反应的进行。理论必须要通过实践检验才能有生命力。同样通过实验来验证,将洁厕剂(主要成分是浓盐酸)和84 消毒液(主要成分是NaClO)混合,就会发生上述反应,很明显产生有毒气体氯气。
评析:在传统的教学中,大家比较推崇实验探究来分析氯水的成份,通过实验中各成分共存来说明该反应是可逆反应。这种推理是有一定的瑕眦的,因为无法反驳该反应速率小的假说。而这里通过电性作用进行研究,不仅成功地克服了反应物与生成物共存是速率还是限度的问题,而且还能为深入研究次氯酸是怎么分解的,是如何漂白的,以及为什么氯水长时间放置最终会转变为稀盐酸的一系列问题打下基础。如何把握好这一系列的问题契机,都显示出教师对课堂的把控能力,显示出教师对核心素养的认识层次以及教师对化学学科的理解力。
四、结语
分子电性模型作为学习化学的重要认知工具,通过简单易懂的原理,在化学反应的机理认识和结果解释过程中发挥了非常有意义的作用。有研究认为:基于预测的认识过程会让大脑释放多巴胺,促进前额皮层的活动,大脑体验到这种活动的价值,会付出更多的努力投入到认识活动中。[3]我们的这种教学方式,极大地激发了学生的研究热情。在教学实践中,在建构电性分析模型后,学生马上主动地进行反应过程的预测,不断尝试,不断提问,享受着探索的乐趣。教师更多的是要发现培养学生核心素养的契机,不失时机地提出疑问,鼓励科学探究,训练化学思维,并且在与学生一起探索的过程中,不断提升化学学科理解力。
