特发性肺动脉瘤3D打印模型的构建与评估
2023-04-03齐哲孜陈春兰游仕煜魏萍魏桂花
齐哲孜,陈春兰,游仕煜,魏萍,魏桂花
1 西南交通大学生命科学与工程学院,成都 611756;2 四川省中西医结合医院影像科
肺动脉瘤(pulmonary artery aneurysm, PAA)是多种病因导致的肺动脉血管壁全层病理性扩张,主要累及主肺动脉或相关分支动脉[1]。肺动脉瘤的发病率极低,据Deterling等[2]统计,尸检中肺动脉瘤发生率仅为0.073‰。根据病因肺动脉瘤可分为原发性、继发性[3]和特发性[4]。其中特发性肺动脉瘤较为罕见[1]。特发性肺动脉瘤患者常无慢性心脏疾病、动脉炎或肺动脉粥样硬化等继发性因素,早期明确诊断较困难。电子计算机断层扫描(CT)检查可直接反映特发性肺动脉瘤的瘤体大小、位置和范围等信息,但传统影像学成像技术局限于二维平面,二维图像无法显示肺动脉瘤的复杂结构,导致特发性肺动脉瘤的临床诊断、术前规划较难。3D打印(Three Dimensional Printing,3D)技术,又称“增材制造”或“增量制造”,是一种通过连续逐层堆叠实现制造的新型成型技术[5],克服传统二维图像可视化的局限性,目前已陆续用于复杂疾病的诊断、手术规划中。3D打印技术可克服复杂结构定位困难、技术设备要求高、空间概念化、二维局限性等问题,可临床应用于打印器官病理模型帮助诊断与辅助治疗、内置物支架的创建、医患沟通、教学等方面,对制定完善的手术计划、辅助医生进行病灶可切除性判断等提供重要依据,有助于改善治疗效果、降低手术风险,帮助提升医患沟通效果[6-8]。研究[9]证实,与原始图像数据相比,3D打印的器官病理模型已有较高精度。目前3D打印技术用于特发性肺动脉瘤的诊断及治疗相关研究仍较少。2022年5—10月,我们构建了1例特发性肺动脉瘤患者的肺动脉瘤3D打印模型,并对模型的准确性进行评估。现报告如下。
1 资料与方法
1.1 特发性肺动脉瘤患者的CT影像学资料获取 1例四川省中西医结合医院收治的特发性肺动脉瘤患者,男,56岁,无其他伴发性疾病;CT图像中肺主动脉直径>45 mm(正常值<15 mm),结合临床症状诊断为特发性肺动脉瘤。采用美国GE公司128层螺旋CT机,在管电压120 kV、管电流200 mAS、层厚1 mm、间距1 mm、对比剂80 mL条件下,以速率5 mL/s自动触发扫描,扫描范围为患者的肺尖至肺底,收集该患者CT影像学资料。
1.2 肺动脉瘤3D模型的构建与优化
1.2.1 特发性肺动脉瘤CT模型的构建 用医学三维重建Mimics Research20.0软件处理肺动脉瘤患者的CT影像学DICOM数据,识别肺动脉所在图像区域。调试界定阈值为50~500 HounsField单位,确保肺动脉完全处于选区内。再根据肺动脉的解剖结构进行标识,提高生成3D模型的准确性。最后,将肺动脉模型从周围组织中组织分离出来,修剪补充,得到初始肺动脉瘤模型(CT模型)。
1.2.2 CT模型的优化 利用Mimics Research软件对CT模型进行优化,修剪、优化遮罩,调整未识别区域及识别错误区域,选择特发性肺动脉瘤对应选区,计算得到对应选区的PA计算机三维模型。对模型进行修剪去除非肺动脉部分,得实心的肺动脉瘤血管造影模型。用三维建模3-Matic Research12.0软件对Mimics Research构建肺动脉瘤模型进行包覆及平滑处理,设立壁厚等对应参数,调整后获得优化后的肺动脉瘤模型(优化模型)。
1.2.3 肺动脉瘤3D模型的打印 将优化模型数据导出为STL文件,采用SLA光固化快速成型3D打印技术, kings-800激光雕刻打印机,打印获得肺动脉瘤3D打印模型(3D模型),使用蓝色丙烯燃料对肺动脉瘤病变部位染色。
1.3 肺动脉瘤3D模型的评价 为后续评价3D模型,对肺动脉瘤模型进行切割处理,分别在肺动脉干、左肺动脉弓、肺动脉小分支(左)、肺动脉小分支(右)、右上肺动脉、右下肺动脉6个部位进行切割,建立肺动脉瘤解剖切割模型。
1.3.1 CT模型与优化模型的数据测量 肺动脉瘤资料利用Mimics和3-Matic中的Clip在肺动脉瘤资料横、纵、竖轴三个方向选取六个相同位置进行测量对比,如图1所示。分别是肺动脉干、左肺动脉弓、右上肺动脉、右下肺动脉、肺动脉小分支(左)、肺动脉小分支(右)部位易于测量的分辨点,然后得到两模型相同部位从不同轴向测量的距离。在Mimics Research中确定第一帧(即出现遮罩的起始点)到所选位置的距离,并用Measure功能测量该切割位置两易于分辨点之间的距离。在3-matic Research中,根据Mimics Research中第一帧到所选位置的距离,切割优化模型,用Measure功能测量与mimics中相同两分辨点的距离。由于CT模型为血液造影模型,优化中需行空心、向外拓展处理,扩展距离为2 mm,所以在数据分析的过程中,将优化模型数据整体减去双倍扩展距离为最终数据。
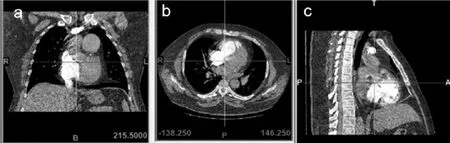
图1 基于CT影像学资料的肺动脉瘤模型竖横纵轴示意图
1.3.2 优化模型和3D模型的数据测量 利用3-Matic Research中的Measure功能测量优化模型肺动脉干、左肺动脉弓、右上肺动脉、右下肺动脉、肺动脉小分支(左)、肺动脉小分支(右)部位,每个部位测量3组易于区分的分辨点之间的距离。用游标卡尺直接测量切割模型数据代表3D打印模型数据。③肺动脉瘤直径测量:用游标卡尺测量3D模型不同方向的肺动脉瘤直径,得到肺动脉瘤直径范围及平均直径。
1.4 统计学方法 采用 Origin 2021软件进行数据处理。采用Shapiro-Wilk检验数据的正态性,符合正态分布的计量资料以-表示,数据比较采用配对t检验;采用线性拟合回归方式验证不同模型测量距离数据的相关性;采用Bland-Altman分析[10]验证测量相同参数的两种模型的一致性。
2 结果
2.1 3D模型构建结果 最终构建打印得到的3D模型如图2所示。

图2 本例患者的肺动脉瘤3D打印模型图像
2.2 CT模型、优化模型及3D模型准确性评估结果
2.2.1 CT模型、优化模型及3D模型线性拟合分析结果 CT数据与优化模型横、纵、竖轴测量距离数据见表1~3。

表1 CT模型与优化模型6个血管的横轴直径(mm)

表2 CT模型与优化模型6个血管的纵轴直径(mm)
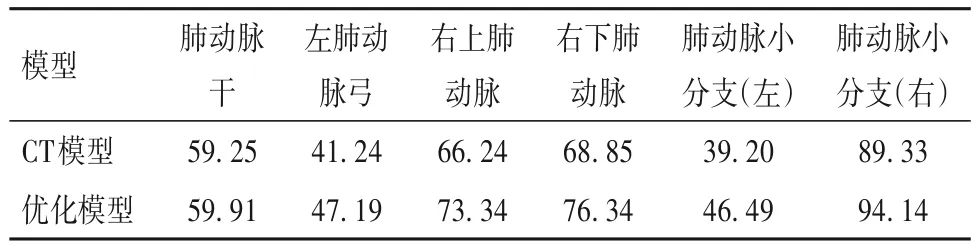
表3 CT模型与优化模型6个血管的竖轴直径(mm)
优化模型和3D打印模型模型测量距离数据见表4~6。
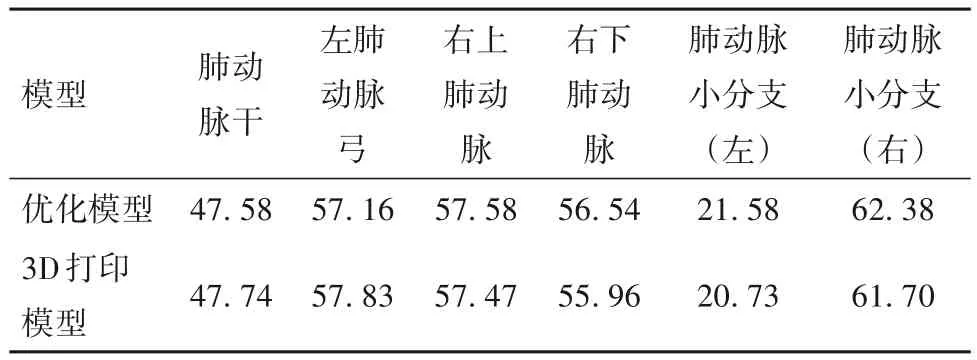
表4 优化模型与3D打印模型6个血管直径(mm)

表5 优化模型与3D打印模型6个血管直径(mm)
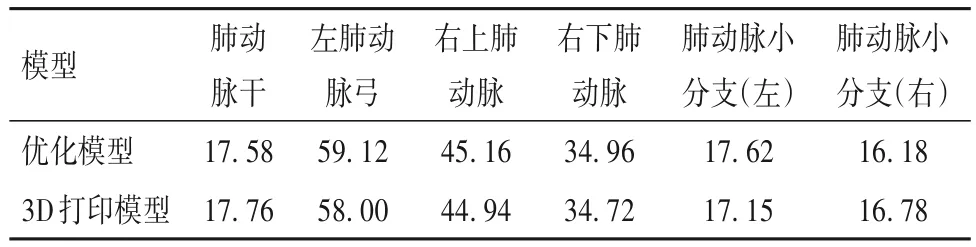
表6 优化模型与3D打印模型6个血管直径(mm)
对于CT模型与优化模型,对每个部位的测量距离数据差值进行正态检验,符合正态分布(P=1.063),配对t检验分析每个部位的两组横、纵、竖轴三个方向测量距离数据之间是否存在显著差异。其次,对于优化模型与3D打印模型,对每个测量点测量距离数据差值进行正态检验,符合正态分布(P=0.920 78),配对t检验分别分析六个部位的测量距离数据结果显示无显著差异,说明在0.05水平下,数据差值显著来自正态分布总体,没有统计学意义。进行正态性检验和t检验确定两组数据无显著差异之后,为验证两组测量距离数据相关性同时建立线性拟合回归方程,对两组数据分别进行相关性分析和线性拟合分析,结果如表7、图3、图4所示:CT模型和优化模型数据的相关性均大于99%,线性拟合回归方程斜率均接近于1,且所有数据都在95%置信区间内。优化模型与3D打印模型数据的相关性均大于99%,线性拟合回归方程斜率均接近于1,且所有数据都在95%置信区间内。说明CT模型与优化模型数据、优化模型与3D打印模型数据存在线性正相关,且无异常值,数据一致性高。
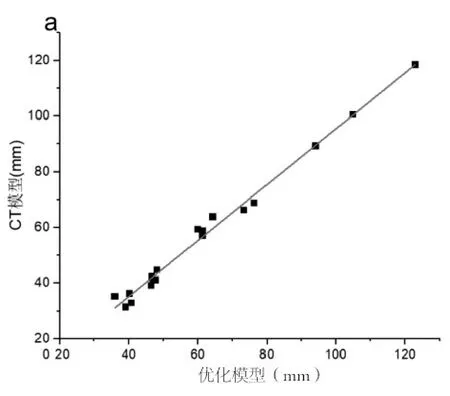
图3 优化模型与CT模型的6个血管直径的一致性图

图4 3D打印模型与优化模型的6个血管直径的一致性图

表7 CT模型、优化模型和3D打印模型的线性拟合分析结果
2.2.2 CT模型与优化模型、优化模型与3D模型数据的一致性分析结果 Bland-Altman中,对于CT扫描文件和优化模型两种方法差值的均值为-0.649,差值的 95%CI为-5.435 ~ 4.136,所有测量距离数据均介于95%CI范围内。对于优化模型和实体模型,两种方法差值的均值为0.149,差值的95%CI为-0.829 ~ 1.127,所有测量距离数据均介于95%CI范围内。说明本次数据具有良好的一致性水平,见图5。

图5 CT模型和优化模型、优化模型和3D模型肺动脉直径平均值的一致性Bland-Altman图
2.3 3D打印模型肺动脉瘤直径 3D打印模型测得肺动脉干直径范围在47.22~61.09 mm,平均直径55.38 mm,和患者确诊时CT图像中肺动脉瘤直径>45 mm一致,可明确诊断为为肺动脉瘤。
3 讨论
本研究中,我们收集了1例特发性肺动脉瘤患者的CT影像学资料,利用Mimics Research和3-Matic Research软件围绕CT数据进行肺动脉瘤建模,并对模型进一步优化,打印得到肺动脉瘤3D打印模型,所得3D模型为1:1人体等比模型。研究过程实现了二维图像向三维实体模型的转变,易于对模型进行各个方向的测量,且可以直观立体地对病变部位进行观察。
在CT扫描文件与优化模型及优化模型与实体模型两组内,准确性评估每组各测量了18组数据,通过相关性分析及线性拟合和Bland-Altman分析等,对两组进行准确性评估,分析结果表明两组数据在0.05的水平下不存在显著差异,证实两组均具有高的模型准确性。由此可推算出CT扫描文件与3D打印模型具有高的准确性。现有3D打印进行准确性评估中多为心脏、肺部模型打印[11-12],特发性PAA的打印和准确性评估都尤其少见,本研究恰好补足这部分空白,在模型准确性高的前提下分析肺动脉瘤的病变大小,更具有说服力和科学性,最后实现辅助手术治疗、教学、医患沟通等临床作用。
本研究通过收集整理医学影像、三维建模、3D打印等知识,完成了从CT影像数据到三维实体模型的制作。评估数据显示,肺动脉3D打印实体模型效果优良,病变部位清晰,可以明显见到肺动脉瘤的位置,通过测量,此部位的肺动脉瘤直径达到55.38 mm,诊断为特发性PAA。3D打印模型让医生更直观的了解肺动脉瘤的情况,进行手术方案设计[13-14]。二维成像将患者肺部及附近的影像呈现在同一平面上,难以提供肺动脉瘤和其周围结构的关系,且医生的手术经验深浅不同,会使手术过程中存在很大的不确定性,而3D打印模型的直观准确、结构清晰等优点,能更好地将脏器的形态和其与相邻组织间的结构关系具体呈现,为手术风险的评估和手术计划的制定提供依据,从而增加了手术的准确度和成功率。同时,在教学过程中3D打印的肺动脉模型让学生更形象地了解肺动脉与肺动脉瘤的实际情况[15-16]。与传统的教学中学生通过二维图像学习复杂的结构时,二维图像比较复杂,并且很难展现肺动脉瘤准确的状态,学生对于其结构、病理状态及手术的切除的学习中存在一定的认知困难,辨识难度较大。3D打印实体模型扩充了教学方式,使学生有更直观的观察,促进了学生对此类知识的掌握。其次,在与患者的沟通过程中,特发性PAA难以用语言准确描述,医生与患者沟通时难以让患者清晰了解病变器官情况,利用3D打印模型,可使患者更好地了解病情和大致的手术操作流程,提高患者及其家属的满意度,在一定程度上可以改善医患关系[13,17]。
随着3D打印技术的更新,精度的提高,成本大幅度降低,其在临床研究的应用中也越发广泛[18-19]。但3D打印也存在一定的局限性[20],在此研究中,我们所获取到的CT影像数据不清晰、具有噪点、相关部位之间分界模糊等,因此在建模过程中,算法模拟的连续点生长后,难免会出现建立的模型不准确、边缘粗糙等情况。这也是本研究的缺点所在,最终制作的模型与实际器官相比,还是存在一定的偏差,并不能完全准确代表人体器官的实际情况。
综上所述,成功构建1例患者的特发性肺动脉瘤3D模型,且模型的准确性较高。3D打印模型测量得到肺动脉干平均直径55.38 mm,结合病史诊断为特发性肺动脉瘤。
