血清CEA、CA125、CA153联合HER2对乳腺癌的诊断价值
2023-03-31傅静芬
傅静芬
乳腺癌是发生于乳腺上皮或乳腺导管上皮的恶性肿瘤,临床上较常见[1]。近年来,乳腺癌的发病率及死亡率逐年增高,但该病早期缺乏典型症状表现,多数患者确诊时肿瘤已发展至中晚期[2]。传统的彩超、磁共振、乳腺钼靶X 线成像等检查特异度不高,且易与乳腺纤维腺瘤、乳腺囊性增生混淆,易出现误诊及漏诊[3]。因此,需寻找有效的诊断评估指标以早期诊断及治疗乳腺癌,改善患者预后。血清肿瘤标志物的测定具有无损伤、操作简便等优势,已广泛应用于乳腺癌的诊断中,并在乳腺癌早期诊断与筛查中发挥了重要作用[4]。血清癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原153(carbohydrate antigen 153,CA153)及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)均为肿瘤标志物,且在乳腺癌诊断中已有一定的应用[5],但四者联合应用是否能提高乳腺癌的诊断效能尚不明确。基于此,本研究特开展关于血清CEA、CA125、CA153 及HER2 对乳腺癌的诊断价值研究,以为病情评估与治疗提供可靠的依据,现报道如下。
1 资料与方法
1.1 一般资料 选取2019 年6 月-2021 年6 月南昌市第三医院收治的108 例乳腺癌患者和110 例乳腺良性肿瘤患者,分别设为乳腺癌组、乳腺良性肿瘤组。(1)纳入标准:①乳腺癌组符合原发性乳腺癌诊断标准[6]且经病理检查确诊;②乳腺良性肿瘤组均经影像学检查和病理学检查确诊;③未接受过放、化疗等治疗。(2)排除标准:①合并其他恶性肿瘤;②合并心、肝、肾等重要脏器功能障碍;③合并自身免疫、血液系统疾病;④合并精神疾病或认知功能障碍;⑤依从性较差;⑥因各种原因不能全程参与本研究。另选取同期体检健康者100 例作为健康对照组。研究经医院医学伦理委员会批准,参与人员均签署知情同意书。
1.2 方法 三组受检者均在清晨空腹状态下采集5 mL 静脉血,采血后尽快进行离心处理,分离血清,血清CEA、CA125、CA153 及HER2 水平均采用罗氏全自动电化学发光免疫系统Cobas e601 进行检测,试剂盒由罗氏公司提供,严格按照仪器操作流程及试剂盒说明书进行操作。
1.3 统计学处理 采用SPSS 27.0 软件进行数据分析。计量资料行Shapiro-Wilk 正态检验,以()描述正态分布资料,两组间比较采用独立样本t检验,以M(P25,P75)描述偏态分布资料,两组间比较采用Mann-WhitneyU检验,多组间比较采用单因素方差分析和SNK-q检验;计数资料以率(%)描述,采用χ2检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析血清CEA、CA125、CA153、HER2 单独及联合对乳腺癌的诊断价值,曲线下面积(area under curve,AUC)比较采用秩和检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 三组一般资料 乳腺癌组年龄25~70 岁,平均(48.45±9.25)岁;临床分期:Ⅰ期20 例,Ⅱ期29 例,Ⅲ期31 例,Ⅳ期28 例。乳腺良性肿瘤组年龄26~71 岁,平均(47.89±9.24)岁;乳腺纤维腺瘤45 例,乳腺囊性增生39 例,乳腺脂肪瘤26 例。健康对照组年龄25~69 岁,平均(46.88±9.20)岁。三组年龄比较,差异无统计学意义(P>0.05),具有可比性。
2.2 三组血清CEA、CA125、CA153、HER2 水平比较 三组血清CEA、CA125、CA153、HER2 水平比较,差异均有统计学意义(P<0.05);乳腺癌组和乳腺良性肿瘤组的血清CEA、CA125、CA153、HER2 水平均高于健康对照组(P<0.05),且乳腺癌组以上血清指标水平均高于乳腺良性肿瘤组(P<0.05)。见表1。
表1 三组血清CEA、CA125、CA153、HER2水平比较()

表1 三组血清CEA、CA125、CA153、HER2水平比较()
*与乳腺癌组相比,P<0.05;#与乳腺良性肿瘤组相比,P<0.05。
2.3 不同临床分期乳腺癌患者血清CEA、CA125、CA153、HER2 水平比较 乳腺癌Ⅲ、Ⅳ期患者的血清CEA、CA125、CA153、HER2 水平均高于Ⅰ、Ⅱ期患者(P<0.05),见表2。
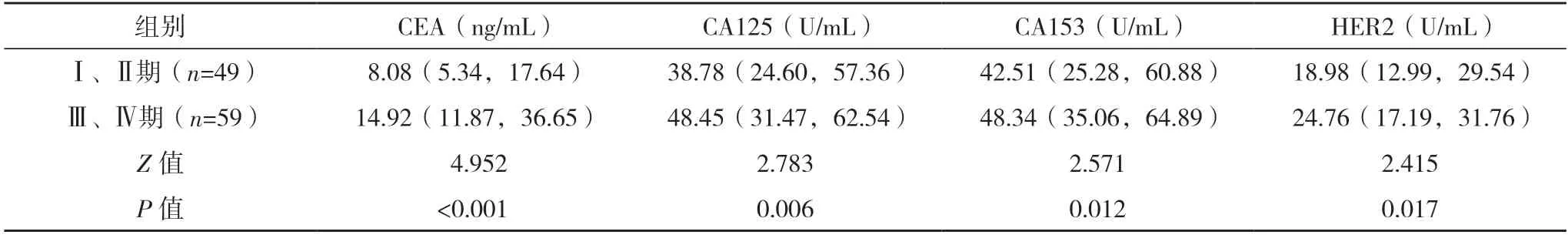
表2 不同临床分期乳腺癌患者血清CEA、CA125、CA153、HER2水平比较[M(P25,P75)]
2.4 血清CEA、CA125、CA153、HER2及联合对乳腺癌的诊断价值分析 血清CEA、CA125、CA153 及HER2 联合诊断乳腺癌的敏感度均高于各指标单独诊断(χ2=25.936、P<0.001;χ2=13.276,P<0.001;χ2=22.199,P<0.001;χ2=17.544,P=0.001),AUC 均高于各单独指标诊断(Z=4.532,P<0.001;Z=2.182,P=0.029;Z=2.716,P=0.007;Z=2.696,P=0.007),特异度与各单独诊断比较,差异均无统计学意义(P>0.05)。见表3、图1。

表3 血清CEA、CA125、CA153及HER2对乳腺癌的诊断价值

图1 血清CEA、CA125、CA153、HER2及联合对乳腺癌发生情况的ROC曲线
3 讨论
我国乳腺癌的发病率仅次于女性生殖系统恶性肿瘤的首位—子宫颈癌[7],严重损害女性健康。随着人们对乳腺癌更加深入的认识,乳腺癌的筛查力度也不断加大,但由于乳腺癌早期临床表现常无特异性,因此其早期诊治问题成为目前临床研究的热点[8]。随着对乳腺癌的深入研究发现血清肿瘤标志物的检测已逐渐应用于乳腺癌的早期诊断中,通过测定其水平可对乳腺癌的治疗方案及预后评估等提供重要依据[9]。
本研究结果显示,乳腺癌组和乳腺良性肿瘤组的血清CEA、CA125、CA153、HER2 水平均高于健康对照组,乳腺癌组均高于乳腺良性肿瘤组,且乳腺癌Ⅲ、Ⅳ期患者均高于Ⅰ、Ⅱ期患者(P<0.05),表明血清CEA、CA125、CA153、HER2 水平在乳腺癌中表达均显著升高,且与临床分期相关。血清CEA 是一种具有人类胚胎抗原特性的酸性糖蛋白,王秀梅[10]研究报道血清CEA 水平在乳腺癌患者中呈高表达,高娜等[11]研究发现血清CEA 水平在乳腺癌淋巴结转移患者中的表达水平高于未发生转移患者,均提示其表达水平与乳腺癌的发生及临床分期密切相关。血清CA125 是存在于细胞表面分子量较大的一种糖蛋白抗原,是临床诊断卵巢癌的常用血清标志物[12]。但也有研究发现血清CA125 在乳腺癌患者中呈高表达,且对乳腺癌具有一定的检出率[13]。此外,齐小芬等[14]报道乳腺癌血清CA125表达与乳腺癌淋巴结转移存在联系,对临床分期的判断具有一定指导意义。血清CA153 为乳腺细胞上皮表面糖蛋白变异体,是乳腺癌的最重要的特异性标志物之一[15]。有资料显示,有30%~50%的乳腺癌患者血清CA153 显著升高,尤其在转移性乳腺癌患者血清中升高明显[16]。HER2 作为一种原癌基因,具有增加肿瘤细胞的侵袭力,促进肿瘤血管新生和淋巴管新生的能力[17]。有研究表明,乳腺癌组织中HER2 阳性表达率高达83.47%[18],通过检测HER2水平有助于诊断乳腺癌,但HER2 还存在弱、中度表达,故其潜在机理仍需进一步的临床探索说明。
本研究进一步采用ROC 曲线分析血清CEA、CA125、CA153、HER2 水平对乳腺癌的诊断价值,结果显示四者联合诊断乳腺癌的敏感度、AUC均高于各项单独诊断(P<0.05),表明血清CEA、CA125、CA153、HER2 联合在诊断乳腺癌中具有较为理想的应用价值。既往研究报道显示,吸烟、机体炎症和一些良性肿瘤也会导致血清CEA 表达升高,影响其检测准确率;CA125 敏感度较低,不宜通过单项检测来诊断肿瘤疾病;CA153 易受雌激素受体、临床分期等各种因素影响,在早期乳腺癌中的敏感度较差;HER2 对于早期乳腺癌诊断不敏感,故单一使用以上指标检测很难满足临床需要[19-22]。本研究将四者联合,不但提高了诊断敏感度,还未显著降低特异度,能够在一定程度上减少误诊、漏诊,提高检出率。
综上所述,血清CEA、CA125、CA153 和HER2 联合检测用于乳腺癌早期诊断,弥补了单一指标检测的不足,还可提高乳腺癌检出率,在疾病严重程度、良恶性病变鉴别诊断方面均有重要应用价值,值得临床推广。
