山药块茎膨大期淀粉积累及淀粉合成相关基因表达分析
2023-03-30索宁宁张艳芳高圆丽赵令敏葛明然刘杰才霍秀文
索宁宁,张艳芳,高圆丽,赵令敏,葛明然,刘杰才,霍秀文
(内蒙古农业大学园艺与植物保护学院 呼和浩特 010019)
山 药(Dioscorea oppositaThunb.)是 薯 蓣 科(Dioscoreaceae)薯蓣属(DioscoreaL.)一年生或多年生缠绕性草质藤本,为单子叶植物[1]。山药块茎中含有丰富的淀粉(70%)、蛋白质(9%)、还富含矿物质、尿囊素、皂苷等活性物质,并且与其他作物如马铃薯、木薯和甘薯相比,山药有着更好的感官特性,因此,近年来对山药的需求量逐年增多[2]。
淀粉是山药块茎中最丰富的碳水化合物,含量约占块茎干质量的80%左右。淀粉积累不仅影响块茎膨大,对山药直接经济效益的产生和品质形成也具有重要作用。前人通过对马铃薯块茎的研究发现,叶片光合作用产生的同化物以蔗糖的形式通过韧皮部输送到块茎内,然后经由ADP-葡萄糖焦磷酸化酶(glucose-1-phosphate adenylyltransferase,AGPase)、可 溶 性 淀 粉 合 成 酶(starch synthase,SSS)、束缚态淀粉合成酶(granule bound starch synthase,GBSS)、淀粉分支酶(starch-branching enzyme,SBE)等淀粉合成关键酶的协同作用催化淀粉的合成[3]。AGPase 催化形成淀粉合成的底物ADPG,是途径中的关键酶和限速酶。据前人报道,利用Patatin 启动子驱动马铃薯AGPase表达,转基因马铃薯的淀粉含量较野生型提高了35%[4]。利用基因沉默抑制AGPase表达,马铃薯淀粉含量比对照低4%~35%[5]。马铃薯块茎中AGPase的下调会引起GBSSI的表达[6]。GBSS 主要负责直链淀粉的合成,还未有其他合酶可以取代该功能。Kitahara等[7]利用RNAi 技术抑制GBSSI表达,发现GBSS不仅有助于直链淀粉的积累,而且还参与支链淀粉长链的合成。根据氨基酸序列的相似性,SSS 被分成多种异构体,在块茎作物中主要是指SSⅡ和SSⅢ,其在支链淀粉的合成中起重要作用[8-9]。拟南芥SSⅡ的缺失不会影响叶片生长速度和淀粉的含量,但抑制了中等长度支链淀粉的合成,这在马铃薯块茎的研究中也得到了类似的结果[10-11]。SSⅢ的过表达会使细胞中产生大量的小淀粉粒,中心位置通常有裂纹[10]。SBE 主要包含两类同工酶SBEⅠ和SBEⅡ;主要影响支链淀粉的分支[12]。抑制SBEⅡ的表达,马铃薯淀粉粒结构发生改变,支链淀粉和直链淀粉的含量增加;抑制SBEⅠ的表达对直链淀粉含量的影响不显著;而同时下调SBEⅠ和SBEⅡ,马铃薯中直链淀粉含量增加75%[13-14]。异淀粉酶、普鲁兰酶(pullulanase,PUL)及蔗糖合成酶(sucrose synthase,SUS)也参与了淀粉合成。增强转基因马铃薯中SUS 的活性,块茎的淀粉含量和产量也得到提高[15]。此外,一些代谢物如3-磷酸甘油酸、焦磷酸盐等可以激活或抑制淀粉合成相关酶的活性进而影响淀粉积累[16]。近年来,基于山药块茎的生长分析、营养成分分析、细胞学特征分析或分子水平评价等对山药的淀粉积累特性和淀粉代谢调控方面的研究逐渐变多[17-19]。然而,迄今关于山药块茎淀粉合成关键酶与其编码基因表达量的综合性分析却鲜有研究,诸多未知点有待进一步挖掘。
为此,笔者以田间条件下内蒙古主栽山药品种大和长芋为试验材料,研究块茎膨大期淀粉的积累及相关淀粉合成关键酶的基因表达和活性变化;分析淀粉积累与相关淀粉合成关键酶活性和基因表达的相关性;通过通径分析进一步探索其对各类淀粉积累的影响。这不仅有助于揭示山药块茎淀粉合成的分子机制,而且对旨在获得高淀粉含量、高品质性状的山药育种目标具有实践指导意义。
1 材料与方法
1.1 材料
山药品种为大和长芋山药(Dioscorea opposita‘Dahechangyu’),为笔者所在课题组上一年收获的自留种,于2021 年5 月初至10 月末种植在内蒙古农业大学山药种质资源圃。试验选取15 cm 左右晾晒好的的山药栽子播种,采用搭架栽培、双行种植的方式,行距60 cm,株距20 cm,于5 月7 日人工种植,常规田间管理。
1.2 方法
内蒙古地区大和长芋山药约在种植后75 d 块茎开始膨大,165 d 截止。试验于种植后的90、105、120、135、150、165 d 取样,每个时期设置3 次生物学重复,每次重复随机挖取3 株长势一致的山药进行地下块茎采样。去除残留土壤后,从块茎中部称取2 g,3 株等量混样,用锡纸包裹并标记,液氮速冻,-80 ℃冻存。
1.3 项目测定
1.3.1 山药块茎形态指标的测定 用游标卡尺和软尺测量清洗干净后块茎的直径和长度,电子秤称取块茎质量。
1.3.2 淀粉含量的测定 参照崔晋[20]等利用双波长法测定块茎淀粉含量。支链淀粉含量测定以538 nm 为测定波长,758 nm 为参比波长;直链淀粉含量测定以624 nm 为测定波长,410 nm 为参比波长。总淀粉含量/%=直链淀粉含量(%)+支链淀粉含量(%)。
1.3.3 淀粉形成关键酶活性的测定 称取约1.0 g左右的块茎,在预冷的研钵中磨成粉末,加入5 mL提取液[含100 mmol·L-1pH 7.5 的HEPES-NaOH,2 mmol·L-1EDTA,8 mmol·L-1MgCl2,12.5%甘油;50 mmol·L-1β-巯基乙醇,1% PVP-40],再次研磨后,在4 ℃10 000 r·min-1离心15 min,上清液作为测定AGPase、SSS 和SBE 活性的粗酶液。沉淀中再次加入5 mL 提取液,振荡悬浮均匀后作为测定GBSS 活性的粗酶液。参考程方民等[21]的方法测定AGPase、SSS 和GBSS 活性。SBE 活性测定参照李太贵等[22]和赵法茂等[23]的方法。
1.3.4 淀粉形成关键酶的基因表达量 从-80 ℃冻存的块茎样品中提取总RNA。吸取2 μg 提取出的总RNA 利用反转录试剂盒(PrimeScriptTMII 1st Strand cDNA Synthesis Kit)合成单链cDNA。从笔者课题组前期山药转录组测序结果中获得AGPase、SSII、SSIII、GBSSI、SBEI、SBEII的基因序列,使用Primer Premier 5.0 软件设计用于实时荧光定量PCR(quantitative reverse transcription polymerase chain reaction,qRT-PCR)的引物(表1)。以合成的cDNA 为模板,山药的18S为内参基因,利用TagSYBR®Green qPCR Kit(Bio- Rad)试 剂 盒 进 行qRT-PCR。扩增反应结束后,绘制熔解曲线以确保引物的特异性。每个基因分析设置3 次重复,2−ΔΔCT法计算基因的相对表达量。

表1 用于qRT-PCR 的引物序列
1.4 数据分析
采用Microsoft Excel 2021 进行试验数据分析及制图,采用SPSS v27.0 软件进行方差分析、相关性分析及通径分析。
2 结果与分析
2.1 山药块茎形态指标的变化
由图1 可知,整体来看,块茎质量、直径和长度的生长曲线呈“S”形变化。随着块茎的膨大,其质量、长度和直径不断增加,种植后90~150 d 是其快速增长期,完成整个膨大期质量、长度和直径增长的80%左右,150 d 后其生长速度放缓,进入平台期。
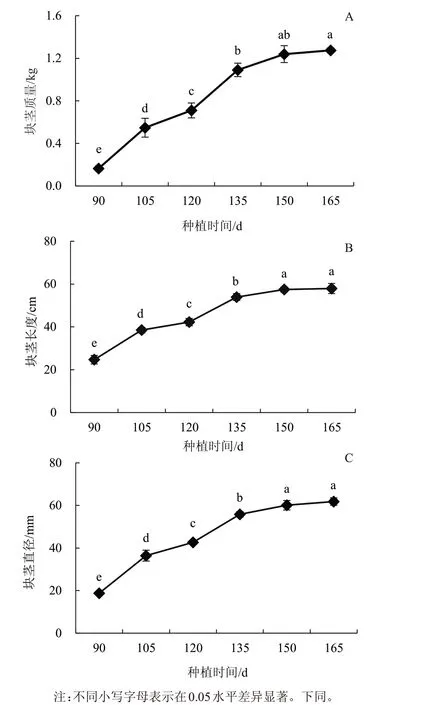
图1 山药块茎形态指标的变化
2.2 山药块茎中淀粉含量的变化
由图2-A 可知,块茎总淀粉含量随时间推进呈升高趋势,且90、105、120 d 间差异显著,这段时期淀粉积累迅速,而135 d 以后淀粉积累基本进入平台期。直链淀粉在整个膨大期含量较低,最高时(135 d)约占总淀粉含量的10%(图2-B)。支链淀粉含量变化的总体趋势与总淀粉含量相似,种植后135~165 d 差异不显著(图2-C)。山药种植后90 d 淀粉直/支比为0.253,而150 d 时直/支比减少为0.132(图2-D);150 d 时,支链淀粉的积累达到峰值,占总淀粉含量的88.35%。因此,山药块茎总淀粉含量的增加主要是由于支链淀粉的积累。
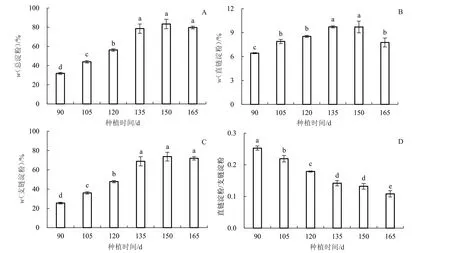
图2 山药块茎中淀粉含量的变化
2.3 山药块茎中淀粉形成关键酶活性的变化
随着种植时间的推移,山药块茎中淀粉形成 关 键 酶AGPase、SSS、GBSS 和SBE 活 性 变化基本一致,均在90~135 d 酶活性提高,并且都在135 d 时达到峰值,135~165 d 又显著降低(图3)。
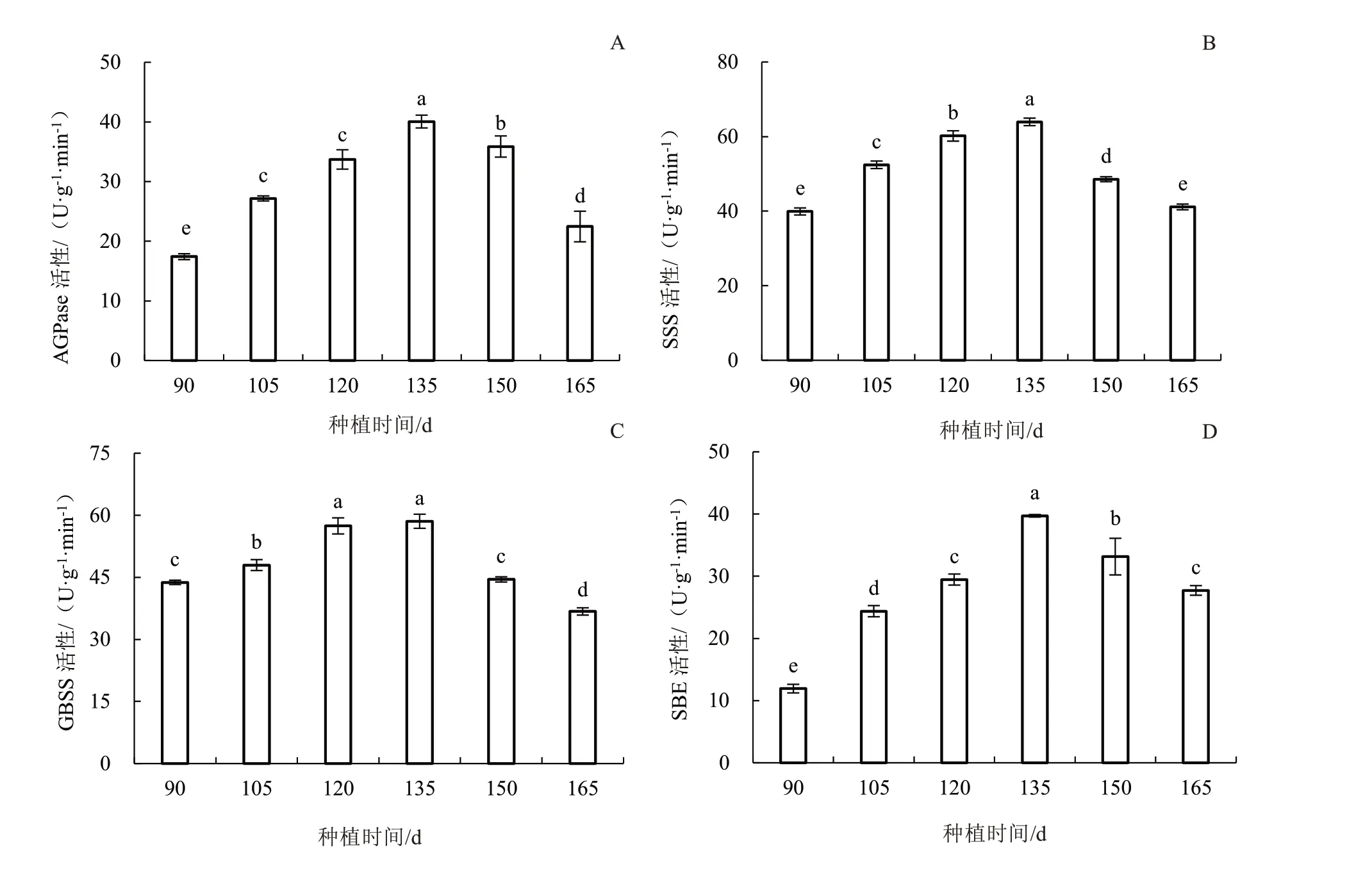
图3 山药块茎中淀粉形成关键酶活性的变化
2.4 山药块茎中淀粉合成关键酶的基因表达量
为进一步了解块茎中淀粉合成关键酶相关基因的表达及其在块茎发育中的作用,采用qRT-PCR对6 个基因的转录水平进行了研究。AGPase的表达量在135 d 之前显著增加,然后在150 d 后显著下降到120 d 前的水平(图4-A)。SSⅡ在块茎中的表达量基本稳定,135 d 时有显著高表达(图4-B)。SSⅢ在90~105 d 的表达量较低,且无显著差异;120 d 后SSⅢ的表达量显著升高,135 d 达到最大值后又显著降低(图4-C)。GBSSⅠ在块茎中的表达量呈“升-降-升-降”波浪变化趋势,且在105 d 的表达量显著高于其他时期(图4-D)。SBEⅠ基因从105 d显著升高后一直保持在恒定的高表达量水平,然后在165 d 显著降低(图4-E)。SBEⅡ与SSⅡ的表达模式相似,在整个膨大期保持恒定的高表达量水平(图4-F)。
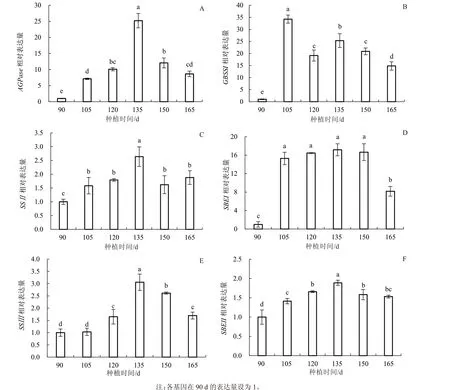
图4 山药块茎中淀粉合成关键酶的基因表达变化
2.5 山药块茎淀粉积累的相关性分析
笔者的研究中,块茎淀粉含量与淀粉合成关键酶活性及其基因表达呈正相关(表2)。块茎总淀粉含量与AGPase、SBE 活性呈极显著正相关。支链淀粉含量与AGPase、SBE 活性也呈极显著正相关,与SSS 活性呈正相关。直链淀粉含量与4 种淀粉合成关键酶活性均呈正相关。说明AGPase、SSS、GBSS、SBE 等活性在块茎淀粉合成中发挥了重要作用。因此,在一定范围内,当参与山药块茎淀粉合成的这些酶的活性越高,越有利于淀粉的积累。块茎总淀粉含量与AGPase、SSⅡ、SSⅢ、SBEⅡ等基因的表达量呈极显著正相关,与SBEⅠ基因的表达量呈显著正相关。与总淀粉含量一致,支链淀粉含量与AGPase、SSⅡ、SSⅢ、SBEⅡ等基因的表达量也呈极显著正相关,与SBEⅠ基因的表达量呈显著正相关。直链淀粉含量与淀粉合成关键酶基因的表达量均为显著或极显著正相关,表明这些编码淀粉合成关键酶的基因表达量与山药块茎淀粉的积累有密切的联系。
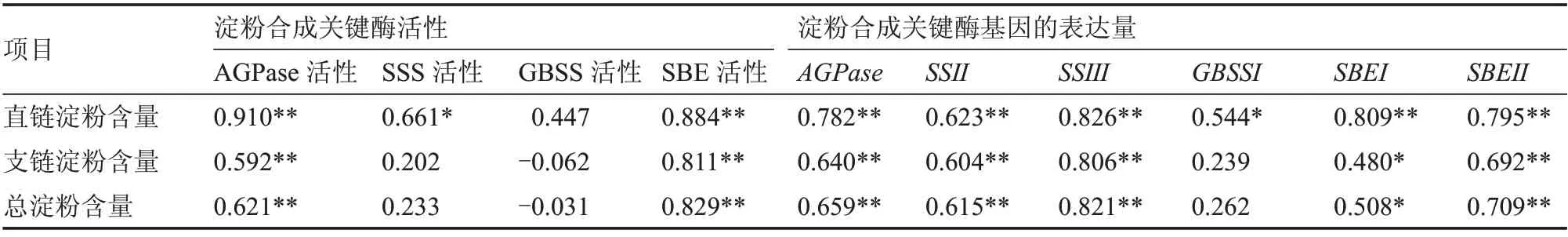
表2 块茎淀粉积累的相关性分析
2.6 山药块茎淀粉积累的通径分析
借助通径分析进一步研究淀粉合成关键酶及其相对基因表达量对总淀粉、支链淀粉和直链淀粉积累的影响(表3)。直接通径系数表明,SBE(S4)是对总淀粉和支链淀粉积累唯一表现为直接正效应(0.897,0.874)的淀粉合成关键酶;通过SBE 的间接影响,AGPase(S1)、SSS(S2)、GBSS(S3)对总淀粉和支链淀粉积累又表现了一定的间接正效应(0.785、0.634、0.421;0.765、0.618、0.410)。AGPase、SSS 虽然对支链淀粉积累表现为负效应(-0.329,-0.234),但其通过GBSS、SBE 等其他因子对支链淀粉积累产生了间接正效应(合计0.920,0.435),抵消了它们的直接负效应。AGPase 和GBSS 对直链淀粉积累直接贡献作用仅次于SBE。
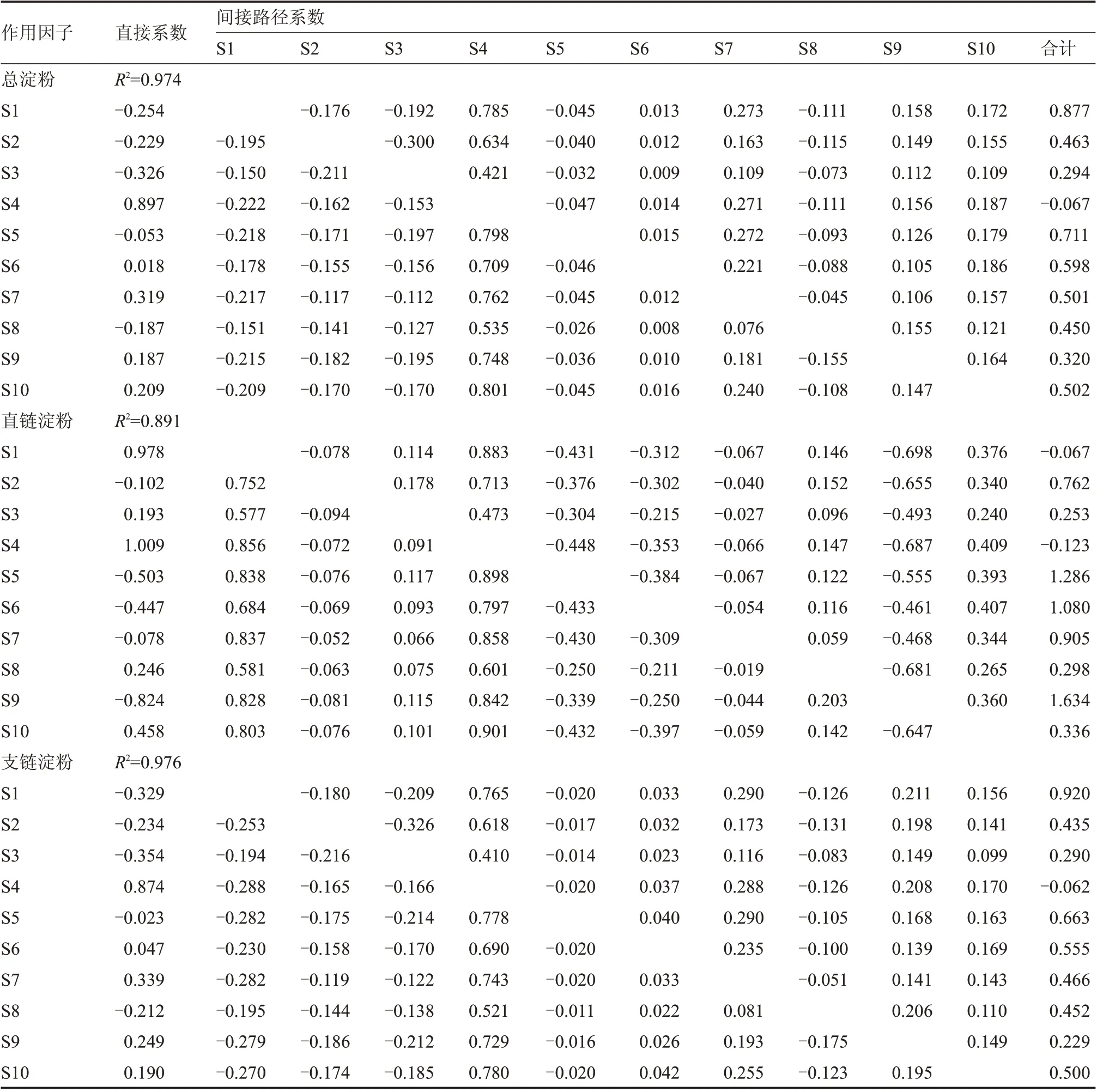
表3 块茎淀粉积累的通经分析
AGPase(S5)、SSⅡ(S6)、SSⅢ(S7)、GBSSⅠ(S8)、SBEⅠ(S9)、SBEⅡ(S10)对块茎总淀粉和支链淀粉积累的影响均为间接通径系数大于直接通径系数,说明这些作用因子都通过其剩余因子的间接作用来调控淀粉积累。AGPase和GBSSⅠ两类基因的表达量对支链淀粉积累表现为直接负效应(-0.023,-0.212)。GBSSⅠ和SBEⅡ对直链淀粉积累表现了一定的直接正效应(0.246,0.458),又表现了间接正效应(0.298,0.336)。
3 讨论与结论
淀粉是植物体内主要的碳水化合物储存库,广泛存在于光合组织以及非光合组织中,是农业生产研究的重点[9]。在山药块茎中,淀粉是含量最丰富的碳水化合物,种植后90~150 d 是其快速增长期,与此同时,块茎也在快速膨大,所以,块茎的膨大与淀粉的积累密切相关,淀粉是山药块茎质量、长度、粗度变化的重要贡献因子[17]。然而,目前关于山药块茎淀粉生物合成的机制尚不明晰。淀粉有直链淀粉和支链淀粉两种存在形式,通过直链淀粉与支链淀粉含量的比值能够快速评判粮食作物食味品质的优劣[24]。成熟山药块茎中支链淀粉约占总淀粉含量的80%,直链淀粉占20%左右[20]。支链淀粉含量高的淀粉往往黏性也较高,口感柔软;糯玉米淀粉主要由支链淀粉组成,直链淀粉很少[25]。在笔者的试验中,块茎膨大期间直/支比呈逐渐下降的趋势,支链淀粉含量变化的总体趋势与总淀粉含量相似,总淀粉含量的增加主要是支链淀粉含量的增加,这与柳强娟等[3]在马铃薯上的研究结果一致;甘薯块茎膨大期淀粉直/支比呈现波浪状曲线的变化趋势,与笔者研究中直/支比呈显著下降的趋势略有不同,这可能是与物种、气候条件差异有关;但柳强娟等[3]发现在甘薯种植后80~110 d 直/支比显著下降,有可能是这段时期直链淀粉积累速率明显小于支链淀粉的缘故,这与笔者的研究结果一致[26]。
淀粉合成开始于1-磷酸葡萄糖和ATP 在AGPase 的催化下合成ADPG,该反应是淀粉合成的中枢限速步骤,催化淀粉底物的合成,决定着淀粉合成和积累的速率[27]。SBE基因的表达模式和活性对支链淀粉的合成有重要影响,对最终淀粉积累及贮藏器官的生长发育有关键作用[28]。据报道,同时抑制SBEⅠ和SBEⅡ小麦直链淀粉含量从25.5%提高到70.0%[29];而SBE的过表达可使转基因水稻支链淀粉分支数增加[30]。笔者研究发现,淀粉形成关键酶AGPase、SSS、SBE 在山药块茎淀粉积累过程中活性变化基本一致,呈先不断升高后显著降低的趋势,种植后135 d 时活性都达到最大值,AGPase、SBE 与支链淀粉的积累呈极显著正相关,这与马铃薯[3]、葛根[31]等的试验结果相符。前人研究发现马铃薯块茎形成过程中淀粉合成关键酶基因AGPase、SSⅡ、SSⅢ、SBEⅡ的相对表达量均呈不断上升的趋势[32]。笔者研究中AGPase、SSⅡ、SSⅢ、SBEⅡ基因的相对表达水平在135 d 前持续增高,并与支链淀粉含量呈极显著正相关,这与苏旺等[32]的研究结果一致。
已有前人研究指出支链淀粉的合成需要淀粉合成相关酶之间一定程度的协调配合来实现[33]。对小麦胚乳支链淀粉的试验表明,支链淀粉合成中一些关键酶的磷酸化使其形成蛋白异聚复合物。前人对玉米淀粉体的研究表明,SSⅠ、SSⅡ和SBEⅡ之间存在蛋白-蛋白相互作用,复合物的形成依赖于蛋白质 磷 酸 化[34]。SSI-SBEIIa、SSI-SBEIIb 和SSIIa-SBEIIb 蛋白质的相互作用在小麦、玉米、水稻中很常见[33]。水稻中还报道了SBEⅠ与PUL 的相互作用[35]。山药作为一种具有双子叶植物特征的单子叶植物,淀粉的积累主要在地下块茎中进行而不是玉米、小麦、水稻等作物的胚乳,这可能导致与其相比,淀粉合成和积累的功能机制不同。笔者研究中参与淀粉积累的关键酶都同时表达;SBE 是对支链淀粉和总淀粉积累表现为直接正效应的淀粉合成关键酶,而通过SBE 的间接影响,AGPase、SSS、GBSS 对支链淀粉积累又表现出一定的间接正效应,SBE 与支链淀粉的积累呈极显著正相关也印证了这一点,推测SBE 可能是通过与其他酶的协同作用促进块茎中支链淀粉的积累,具体机制还有待进一步研究。
综上所述,大和长芋山药块茎中总淀粉含量的增加主要是由于支链淀粉的积累,直链淀粉含量较少,种植后135 d 淀粉积累基本进入平台期;AGPase、SSS、SBE 对山药块茎淀粉的积累是必要的,AGPase、SBE 可能是直接参与支链淀粉积累的重要功能酶;AGPase、SSⅡ、SSⅢ、SBEⅡ基因正向调控块茎支链淀粉的积累。另外,SBE 对各类淀粉积累均表现为直接正效应,AGPase、GBSS 对直链淀粉积累的直接贡献也较大。
