辣椒炭疽病菌Colletotrichum nigrum 鉴定、生物学特性及药剂敏感性研究
2023-03-30陈鹏宇杨立辉翟长兰田慧迪白庆荣赵廷昌
陈鹏宇,杨立辉,翟长兰,田慧迪,张 敏,白庆荣,2,赵廷昌
(1.吉林农业大学植物保护学院 长春 130118;2.绿色农药全国重点实验室·绿色农药与农业生物工程教育部重点实验室·贵州大学精细化工研究开发中心·贵州大学 贵阳 550025;3.中国农业科学院植物保护研究所 北京 100193)
辣椒炭疽病是由炭疽菌属(Colletotrichumspp.)真菌引起的一种常见病害,可导致幼苗死亡、叶片和果实腐烂,发病严重时,病果率在30%~40%[1],严重影响辣椒的产量和品质。炭疽菌属(Colletotrichum)真菌是世界上重要的植物病原真菌群[2],无性态为无性态真菌(Anamorphic fungi)炭疽属(Colletotrichum),有性态为子囊菌门(Ascomycota)小丛壳属(Glomerella)[3]。
在辣椒炭疽菌的早期分类中,根据病害症状分为红色炭疽病菌、黑色炭疽病菌和黑点炭疽病菌[4]。目前在我国天津、四川、贵州、广东、甘肃、陕西等地均有辣椒炭疽病的报道,引起辣椒炭疽病的病原菌主要包括C.acutatum(尖孢炭疽菌)、C.truncatum(平头炭疽菌)、C.spinaciae(菠菜炭疽菌)、C.boninense(博宁炭疽菌)、C.gloeosporioides(胶孢炭疽菌)、C.siamense(暹罗炭疽菌)、C.fructicola(果生炭疽菌)、C.scovillei(斯高维尔炭疽菌)、C.karstii(喀斯特炭疽菌)[5-11]。
2021 年辣椒炭疽病在吉林省多地和内蒙古自治区东部地区的辣椒主产区大面积发生,对辣椒产业造成了十分严重的危害。笔者所在团队于2021年在吉林省洮南市、双辽市、长春市农安县、松原市长岭县和内蒙古自治区通辽市开鲁县的辣椒主产区进行辣椒炭疽病病样的采集,对病样进行分离纯化,明确病原菌分类地位,并对主要病原菌生物学特性及药剂敏感性进行研究,以期为辣椒炭疽病的防治提供理论依据。
1 材料与方法
1.1 材料
2021 年9—10 月对吉林省及内蒙古自治区东部地区的辣椒主产区进行辣椒病样采集,记录发病特征并拍照,标本保存于吉林农业大学植物保护学院植物病理学教研室。分离物致病性测定供试菌株:在不同地区分离菌株中随机挑选1 株,分别为HS4Y- 2- 19、DSD2Y- 1- 41、QTXB2Y- 2- 5- 1、QJB1-2-36、HJ1Y-2-50、HLHY9-1-4-1。分子生物学测序供试菌株:在不同采样点分离菌株中随机选取以下菌株,分别为HS4Y-2-19、DSD2Y-1-41、MX6-1-45、QTN2Y-2-4-2、QTXB2Y-2-5-1、HLHY9-1-4-1、BPY1-3-49、HJY3-1-55、BPY3-2-60、QTN1Y-1-35、HJY1-2-50、QJB1-2-36。生物学特性及室内药剂敏感性供试菌株为HS4Y-2-19。选用25 种化学杀菌剂作为供试药剂,药剂名称及生产厂家见表1。供试试剂有β-巯基乙醇、乙二胺四乙酸(EDTA)、无水乙醇、75%乙醇、琼脂糖、Ezup 柱式真菌基因组DNA 抽提试剂盒(生工生物工程上海股份有限公司)。

表1 供试药剂
供试培养基为马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA)、燕麦琼脂培养基(Oatmeal Agar,OA)、水琼脂培养基(Water Agar,WA)、西红柿燕麦琼脂培养基(Tomato Oatmeal Agar,TOA)、马铃薯蔗糖琼脂培养基(Potato Sucrose Agar,PSA)、胡萝卜琼脂培养基(Carrot Agar,CA)、玉米粉琼脂培养基(Corn Meal Agar,CMA)、V8 碳酸钙琼脂培养基(V8 Agar,V8)、查氏培养基(Czapek-Dox Agar,Czapek)。
供试仪器为光学显微镜(ZEISS ImagerA.2)、超景深显微镜(VHX-600)、GI80DWS 高压蒸汽灭菌锅(上海言和)、SW-CJ-2D 型双人净化工作台(浙江苏净净化)、BIC-300 人工气候培养箱(上海博讯)、DHG-9140A 电热恒温鼓风干燥箱(上海申贤恒温设备厂)、BCD-217CHG 立式冷藏柜(河南新飞电器有限公司)等。
1.2 方法
1.2.1 辣椒炭疽病病原菌的分离纯化 2021 年9—11 月,将采集到的辣椒炭疽病标本用无菌水清洗并消毒后,用灭菌剪刀剪取病健交界处的组织块5 mm×5 mm,组织块经体积分数为75%乙醇消毒,无菌水漂洗3 次,在无菌操作台内将表面水分晾干后,放入事先准备好的PDA 平板中,在恒温培养箱中25 ℃暗培养。待组织块在PDA 平板上长出菌丝后,用灭菌牙签在菌落边缘挑取菌丝块放在新的PDA 平板中,置于恒温培养箱25 ℃暗培养。
1.2.2 分离物的致病性测定 2021 年11 月,采用菌丝侵染和孢子侵染2 种方式进行致病性测定。待分离物在PDA 培养基上长至直径为培养皿2/3时,选取不同地区的代表菌株1 株,用打孔器制备直径为6 mm 的菌饼备用,另用无菌水将孢子洗脱制备成浓度为1.0×106个·mL-1孢子悬液备用。用无菌水将新鲜辣椒果实(辣帝1 号,山东寿禾种业有限公司)表面冲洗干净后,使用75%乙醇对其进行表面消毒并使用无菌接种针制造细微伤口,分别将制备好的菌饼贴在细微伤口处;孢子悬浮液涂抹在细微伤口处,以无菌水作为对照,于25 ℃恒温培养箱中保湿培养,逐日观察发病情况。
1.2.3 病原菌形态特征观察 2021 年11 月,在PDA 培养基上观察菌落生长状况。用光学显微镜(ZEISS ImagerA.2)观察分生孢子器和分生孢子的形态并拍照记录,用超景深显微镜(VHX-600)测量孢子大小(测量100 个),初步确定病原菌的分类地位。
1.2.4 病原菌的分子生物学鉴定 2021 年11-12 月,在吉林农业大学经济作物病害与生物防治研究室内进行病菌分子生物学鉴定。采用Ezup 柱式真菌基因组DNA 抽提试剂盒提取不同地区的代表菌株基因组DNA(供试代表菌株信息见表2),选用ITS、ACT、TUB2、GAPDH和CHS-1进行PCR 扩增,各基因扩增所需引物见表3。

表2 供试代表菌株

表3 引物信息
引物由生工生物工程(上海)股份有限公司合成,25.0 μL 的反应体系为Taqmixture 12.5 μL,上下游引物各1.0 μL,DNA 模板1.0 μL 以及9.5 μL 的dd H2O,扩增程序见表4。

表4 PCR 扩增信息
PCR 产物用1.0%的琼脂糖凝胶电泳检测,得到清晰且单一的条带委托生工生物工程(上海)股份有限公司进行双向测序并拼接。将所得序列在NCBI网 站(http://www.ncbi.nlm.nih.gov/blast)上与Gen-Bank 中相关序列进行一致性比对分析,使用MAGEX软件最大似然法中的ML 方法构建系统发育树。
1.2.5 病原菌的生物学特性 2022 年1 月,对病原菌进行生物学特性的研究,具体内容如下:
(1)不同培养基对病菌生长的影响 将供试菌株HS4Y-2-19 制成直径为6 mm 的菌饼放置在PDA、OA、WA、TOA、PSA、CA、CMA 和V8 培养基制成的平板中央,每个平板定量15 mL,25 ℃黑暗条件下恒温培养,3 次重复,8 d 后采用十字交叉法测量菌落直径[12]。
(2)不同碳源对病菌生长的影响 以查氏培养基为基础培养基,分别以等量的葡萄糖、可溶性淀粉、D-麦芽糖、D-果糖、木糖醇、D-甘露糖、山梨醇、D-甘露醇、乳糖代替蔗糖。每个平板定量15 mL 培养基,25 ℃黑暗条件下恒温培养,3 次重复,8 d 后采用十字交叉法测量菌落直径。
(3)不同氮源对病菌生长的影响 以查氏培养基为基础培养基,分别以等量的L-丙氨酸、L-赖氨酸、蛋白胨、甘氨酸、磷酸二氢铵、L-胱氨酸、硝酸铵、硫酸铵、硝酸钾、尿素替换硝酸钠。每个平板定量15 mL 培养基,25 ℃黑暗条件下恒温培养,3 次重复,8 d 后采用十字交叉法测量菌落直径。
(4)不同温度对病菌生长的影响 以PDA培养基为基础培养基,每个平板定量15 mL 培养基,分别置于4、10、15、20、25、30、35 ℃培养箱黑暗培养,3 次重复,8 d 后采用十字交叉法测量菌落直径。
(5)不同光照对病菌生长的影响 以PDA 培养基为基础培养基,每个平板定量15 mL 培养基,分别置于25 ℃全光照、12 h 光照/12 h 黑暗、全黑暗条件下恒温培养,3 次重复,8 d 后采用十字交叉法测量菌落直径。
(6)不同pH 值对病菌生长的影响 以PDA培养基为 基 础 培 养 基,用HCl(1 mol·L-1)和NaOH(1 mol·L-1)调试培养基pH 值分别为5.0、6.0、7.0、8.0、9.0、10.0 和11.0,每个平板定量15 mL培养基,25 ℃黑暗条件下恒温培养,3 次重复,8 d后采用十字交叉法测量菌落直径。
1.2.6 病菌对药剂的敏感性测定 2022 年3 月,分别采用菌丝生长速率法和孢子萌发法测定病菌对药剂的敏感性[13]。
(1)菌丝生长速率法 向50 mL 三角瓶中注入27 mL 的PDA 培养基,高压蒸汽灭菌锅灭菌。将不同杀菌剂稀释为1×103mg·L-1、1×102mg·L-1、1×10 mg·L-1、1 mg·L-1、1×10-1mg·L-1、1×10-2mg·L-16个质量浓度,按照PDA 培养基、药液的体积比为9∶1 制备成混药平板,每个平板定量10 mL 混药培养基,空白对照组以等量无菌水代替药液,每个浓度设3 次重复。将供试菌株HS4Y-2-19 制成直径为6 mm 的菌饼放置在混药平板中央,置于25 ℃培养箱中黑暗条件下恒温培养8 d 后,采用十字交叉法测量菌落直径。
抑菌率/%=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-菌饼原始直径)×100。
计算出抑制率后,通过SPSS25 软件计算不同药剂对病原菌的抑制中浓度(EC50)并建立毒力回归方程,得出相关系数。
(2)孢子萌发法 向50 mL 三角瓶中注入27 mL 的WA 培养基,高压蒸汽灭菌锅灭菌。不同杀菌剂的稀释浓度如下:12%苯甲·氟酰胺SC 和10%苯醚甲环唑WG 质量浓度配置分别为1×104、5×103、2.5×103、1.67×103、1.25×103、1×103mg·L-1,其他杀菌剂配置质量浓度分别为1×103、1×102、10、1、1×10-1、1×10-2mg·L-1,按照WA 培养基、药液的体积比为9∶1 制备成混药平板,每个平板定量10 mL 混药培养基,空白对照组以等量无菌水代替药液。待病原菌在PDA 培养基上长至8 d 时,用无菌水洗平板制备成浓度为1.0×106个·mL-1孢子悬浮液。用移液器吸取100 μL 孢子悬浮液滴在不同浓度的混药平板上并使用一次性涂布器将孢子悬浮液均匀涂布,置于25 ℃培养箱中黑暗条件下恒温培养10 h 后,在显微镜下随机观察多个视野,记录孢子萌发情况并计算抑制率,每个处理观察100 个孢子以上。
孢子萌发率/%=(萌发孢子总数/孢子总数)×100;
孢子萌发抑制率/%=(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率×100。
计算出相对抑制率后,通过SPSS25 软件计算不同药剂对病原菌的抑制中浓度(EC50)并建立毒力回归方程,得出相关系数。
2 结果与分析
2.1 病原菌分离结果
将采集到的标本通过组织分离得到212 个菌株,见表5。

表5 病原菌信息统计
2.2 分离物致病性测定
辣椒炭疽病在田间侵染辣椒果实时产生椭圆形或不规则形病斑,初期表面稍凹陷,病斑中部黑色并产生黑色颗粒,边缘黄色(图1-A)。将供试菌株HS4Y- 2- 19、DSD2Y- 1- 41、QTXB2Y- 2- 5- 1、QJB1-2-36、HJY1-2-50、HLHY9-1-4-1 接种到新鲜的健康青尖椒果实上(辣帝1 号),以无菌水作为空白对照,接种3 d 后3 个接种点开始表现发病症状,接种7 d 后完全发病,产生黑色、中间处略凹陷、圆形、椭圆形或不规则形病斑,发病部位伴生黑色小颗粒(图1-B、C),空白对照无发病迹象(图1-D),接种发病的植株经再分离,获得与接种菌株形态一致的分离物,证明接种用的分离物为该病害的病原菌。

图1 辣椒炭疽病田间发病症状及致病性测定结果
2.3 辣椒炭疽病病原菌鉴定
2.3.1 病原菌形态学鉴定 将病原菌放置在PDA培养基上培养,置于25 ℃培养箱中黑暗条件下恒温培养,初期菌落呈淡粉色(图2),在菌落表面形成黑色微菌核和分生孢子盘,分生孢子盘着生刚毛,分生孢子椭圆形、单孢、无色、中间较两端略窄,分生孢子大小为(11.84~23.41)μm×(2.29~8.47)μm,菌丝体附着孢灰黑色,形状不规则,与C.nigrum形态特征一致。
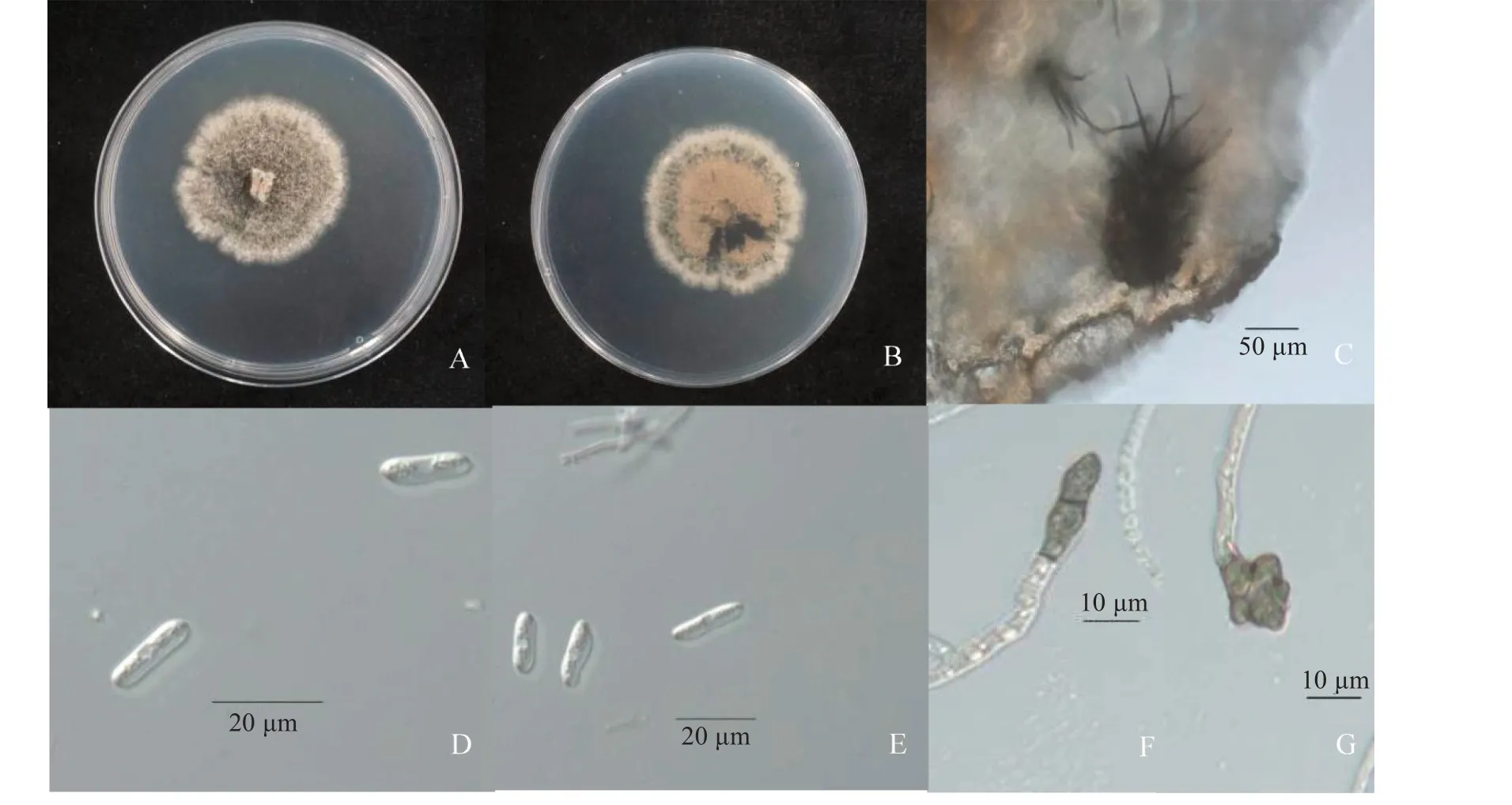
图2 菌株HS4Y-2-19 在PDA 培养基上的形态学特征
2.3.2 病原菌分子生物学鉴定 将供试菌株HS4Y-2-19 测序结果在GenBank 数据库中进行BLAST 一致性比对,结果表明,该菌株的ITS、TUB2、ACT、CHS-1、GAPDH序列与GenBank 中C.nigrumCBS 132451 各序列(JX546846、JX546893、JX546654、JX546701、JX546750)的 一 致 性 均 为100%。
基于12 个供试菌株的ITS、TUB2、ACT、CHS-1和GAPDH的序列构建系统发育树发现,供试菌株与炭疽菌属C.nigrum的遗传距离最近(图3),支持率为99%且聚在同一分支,表明供试菌株均为C.nigrum。结合培养性状和形态观察,以及分子生物学鉴定结果,确定笔者在吉林及内蒙古东部地区辣椒炭疽病发病株上所分离纯化的菌株为C.nigrum。

图3 基于ITS、TUB2、ACT、GAPDH 和CHS-1 基因序列构建的系统发育树
2.4 不同条件对病原菌菌丝生长的影响
2.4.1 不同培养基对病原菌菌丝生长的影响 供试菌株HS4Y-2-19 在8 种培养基上均可生长,在OA 培养基上菌丝生长速度最快,显著大于在其他培养基上的菌丝生长速度;在CA 培养基上菌丝生长速度最慢,显著小于其他培养基(图4-A)。
2.4.2 不同碳源对病原菌菌丝生长的影响 供试菌株HS4Y-2-19 在不同碳源条件下均可生长,以D-麦芽糖为碳源的菌丝生长速度最快,与以淀粉为碳源的差异不显著;以D-果糖为碳源的菌丝生长速度最慢,与以乳糖为碳源的差异不显著(图4-B)。
2.4.3 不同氮源对病原菌菌丝生长的影响 供试菌株HS4Y-2-19 在不同氮源条件下均可生长,在以蛋白胨为氮源的菌丝生长速度最快,显著大于其他氮源的菌丝生长速度;在以L-胱氨酸为氮源的菌丝生长速度最慢,显著小于其他氮源的菌丝生长速度(图4-C)。
2.4.4 不同温度对病原菌菌丝生长的影响 供试菌株HS4Y-2-19 在不同温度下菌丝生长速度存在一定差异,在20 ℃菌丝生长速度最快,显著大于其他温度条件下的菌丝生长速度,在4 ℃和35 ℃菌丝停止生长(图4-D)。
2.4.5 不同光照对病原菌菌丝生长的影响 供试菌株HS4Y-2-19 在不同光照下菌丝都可以生长,在全黑暗条件下菌丝生长速度最快,与其他光照条件下菌丝生长速度相比差异不显著(图4-E)。
2.4.6 不同pH 值对病原菌菌丝生长的影响供试菌株HS4Y-2-19 在不同pH 值下均可生长,在pH 值为10 时菌丝生长速度最快,与pH值为9 时相比差异不显著;在pH 值为7 时菌丝生长速度最慢,与pH 值为5 时相比差异不显著(图4-F)
2.5 病原菌对杀菌剂的敏感性测定结果
2.5.1 病原菌菌丝生长对药剂的敏感性 由表6可知,代表菌株HS4Y-2-19 的菌丝生长对75%肟菌·戊唑醇WG、400 g·L-1氯氟醚·吡唑酯SC、240 g·L-1氯氟醚·吡唑酯EC、42.4%唑醚·氟酰胺SC、40%唑醚·戊唑醇SC、43%氟菌·肟菌酯SC、43%唑醚·氟酰胺SC 较为敏感,EC50<1 mg·L-1;对40%苯醚甲环唑SC、430 g·L-1戊唑醇SC(拜耳)、430 g·L-1戊唑醇SC(宁波)、25%咪鲜胺EC、200 g·L-1氟酰羟·苯甲唑SC、50%腐霉利WP、250 g·L-1嘧菌酯SC、10%苯醚甲环唑WG 敏感性略低,1 mg·L-1<EC50<10 mg·L-1;对50%多菌灵WP、25%溴菌腈EC、25%溴菌腈WP、6%寡糖·链蛋白WP、70%甲基硫菌灵WP、12%苯甲·氟酰胺SC、22.5%啶氧菌脂SC、50%福美双WP、4%四氟醚唑EW、50%异菌脲WP 的敏感性较低,EC50>10 mg·L-1。

表6 代表菌株HS4Y-2-19 菌丝对25 种杀菌剂的敏感性
2.5.2 病原菌孢子萌发对药剂的敏感性 由表7可知,代表菌株HS4Y-2-19 的孢子萌发对400 g·L-1氯氟醚·吡唑酯SC、50%福美双WP、240 g·L-1氯氟醚·吡唑酯EC、250 g·L-1嘧菌酯SC、43%唑醚·氟酰胺SC、22.5%啶氧菌脂SC、40%唑醚·戊唑醇SC、25%溴菌腈EC、42.4%唑醚·氟酰胺SC、25%溴菌腈WP 的敏感性均较高,EC50<1 mg·L-1;对50%多菌灵WP、25%咪鲜胺EC 敏感性略低,1 mg·L-1<EC50<10 mg·L-1;对43%氟菌·肟菌酯SC、75%肟菌·戊唑醇WG、50%腐霉利WP、70%甲基硫菌灵WP、200 g·L-1氟酰羟·苯甲唑SC、6%寡糖·链蛋白WP、430 g·L-1戊唑醇SC(拜耳)、4%四氟醚唑EW、10%苯醚甲环唑WG、12%苯甲·氟酰胺SC 的敏感性较低,EC50>10 mg·L-1。40%苯醚甲环唑SC、50%异菌脲WP、430 g·L-1戊唑醇SC(宁波)效果不理想,在试验最高质量浓度(1×103mg·L-1)下对孢子萌发无明显抑制作用,未在表7 中列出。

表7 代表菌株HS4Y-2-19 孢子萌发对22 种杀菌剂的敏感性
3 讨论与结论
C.nigrum由Halsted[14]首次于1891 年发现并命名,也有学者将其与C.gloeosporioides归为一类,并认为在以辣椒为寄主时才被称为C.nigrum[15]。在进行分子生物学鉴定过程中,发现其与C.coccodes的遗传关系较近,据Liu 等[16]报道,C.nigrum和C.coccodes都可以侵染辣椒和番茄,但是只有C.coccodes可以侵染马铃薯。在贵州[17]、山东[18]均有C.nigrum侵染辣椒的报道,《中国真菌总汇》记载该病原菌在东北地区、内蒙古、陕西、江苏、广东、广西、河南、河北等地均有侵染辣椒的记录[19]。除此之外,该病原菌还可以侵染葫芦[20]等作物。
马荣群等[18]研究发现,最适合C.nigrum菌丝生长的碳源为麦芽糖,氮源为甘氨酸,pH 值为5~6,而笔者研究发现,最适碳源为D-麦芽糖,最适氮源为蛋白胨,最适pH 值为9~10。可能与病菌对辣椒品种及环境的适应性不同有关,有待于进一步研究确认。
笔者首次采用孢子萌发法测定C.nigrum孢子萌发对药剂的敏感性,发现50%福美双WP 对孢子萌发抑制作用较强(EC50为0.008 mg·L-1),但病原菌菌丝生长对50%福美双WP 的敏感性较差(EC50为93.355 mg·L-1),因此可将该药剂可用于预防C.nigrum侵染,这与李小霞等[17]的研究结果一致。C.nigrum菌丝生长对75%肟菌·戊唑醇WG 敏感性最高(EC50为0.021 mg·L-1),但其孢子萌发对该药剂敏感性略低(EC50为35.039 mg·L-1),可用其进行发病后病害防治。在实际生产中,也要注意保护剂和治疗剂使用的最佳时期,建议多种有效药剂的轮换使用,以延缓抗药性的发生。
通过对2021 年吉林省及内蒙古自治区东部地区的辣椒主产区辣椒炭疽病病样的采集和病原菌的分离,并进行致病性测定,共计分离到212 株形态一致的病原菌,结合形态学特征和相关分子序列确定病原菌为Colletotrichum nigrum。病原菌的生物学特性研究发现,OA 培养基适合病原菌菌丝生长;D-麦芽糖是最佳碳源;蛋白胨为最佳氮源;最佳pH 为10;最适培养温度为20 ℃;全黑暗时最适合菌丝生长。病原菌C.nigrum的菌丝生长和孢子萌发对药剂敏感性测试结果表明,该菌对400 g·L-1氯氟醚·吡唑酯SC、240 g·L-1氯氟醚·吡唑酯EC、42.4%唑醚·氟酰胺SC、40%唑醚·戊唑醇SC、43%唑醚·氟酰胺SC 的敏感性均较高(EC50<1.0 mg·L-1),可作为该病害预防和治疗的优选药剂。
