新冠病毒抗原/抗体检测闭环管控体系构建
2023-03-30温天文袁学军肖大伟张旭雯
温天文,巫 军,袁学军,肖大伟,刁 勇,张旭雯
(1.江苏科兴诺生物技术有限公司,江苏 泰州 225300;2.南京为绿生物科技有限公司,江苏 南京 210032;3.南京鼓楼医院集团高新医院医学临床中心,江苏 南京 210032;4.华侨大学医学院,福建 泉州 362021)
自2019 年新型冠状病毒肺炎[COVID-19,简称新冠肺炎(现已统称新冠病毒感染,下文同)]疫情发生以来,全球累计确诊病例超6 亿例,累计死亡病例超650 万例。随着各国多种新冠疫苗用于临床,该病的重症率和死亡率大幅降低[1]。然而,一方面,全球新冠病毒感染人群基数依然很大,尤其是境外感染人员的输入及症状感染者的大量存在,给境内新冠疫情防控带来了极大隐患和挑战;另一方面,在目前对新冠病毒变异情况、感染者病程潜在发展情况等不确定及无特效药的情况下,新冠疫情防控工作仍不可松懈。同时,新冠病毒不断变异[2-3],尤其是Omicron 变种的传播极快,传染性极强,而各国防疫限制的不断放开,加紧了我国新冠防控形势,也大幅加重了新冠肺炎感染检测任务。目前,核酸检测仍是COVID-19 确诊的“金标准”[4],但检测时间较长,对仪器设备条件及人员要求较高,常不能满足基数较大人群的检测需求,也大量占据了医务人员、医疗物资、医疗职能等资源。基于上述情况,结合对新冠病毒、COVID-19、新冠病毒传染流行病学的不断深入研究及专家共识[5],逐步推行抗原/抗体检测方法是对目前检测方法必要的辅助与补充。截至本文撰写时,我国批准的新冠病毒抗原/抗体检测试剂产品厂家已有20 多家,但有关该检测管控的防疫相关文献报道较少。在此,尝试构建该领域全过程闭环管控体系,以确保新冠病毒抗原/ 抗体检测工作高效、有序地开展。
1 核酸检测与抗原/抗体检测对比分析
1.1 检测原理
核酸检测:最常采用荧光定量聚合酶链式反应(PCR)法检测新冠病毒特异序列[6-7],可将新冠病毒核糖核酸(RNA)逆转录为脱氧核糖核酸(DNA)。在PCR 反应体系中,包含1 对特异性引物及1 个Taqman探针(其为1 段特异性寡核苷酸序列,两端分别标记报告荧光基团和淬灭荧光基团)。探针完整时,报告基团发射的荧光信号被淬灭基团吸收;当存在靶序列时,探针与模板结合,DNA 聚合酶利用其外切酶活性沿模板将探针酶切降解,使报告基团与淬灭基团分离,发出荧光。每扩增一条DNA 链,就有一个荧光分子产生。荧光定量PCR 仪能监测出荧光到达预先设定阈值的循环数(4~6 h出结果),病毒核酸浓度越高,该值越小。
抗原/抗体检测原理:通常采用胶体金法/荧光免疫层析法。将特异性的抗原或抗体以条带状固定在膜上,胶体金标记试剂(抗体或单克隆抗体)吸附在结合垫上,当待检样本滴加到试纸条一端的样本垫上后,通过毛细作用向前移动,溶解结合垫上的胶体金标记试剂并相互反应,再移动至固定的抗原或抗体区域时,待检物与胶体金标记试剂的结合物又与之特异性结合而被截留,聚集在检测带上,一般约等待15 min 即可通过肉眼观察到定性显色结果或通过配套荧光免疫分析仪进行定量检测的结果。
可见,前者能将极微量的病毒经逆转录后进行倍量扩增,且为直接检测病毒RNA,检测结果特异性(阳性检出准确率接近100%)、灵敏度、可靠性更高,为确诊的“金标准”;后者需抗原/ 抗体达一定浓度方可检出,且为间接检测病毒RNA 表面的抗原蛋白或相应抗体,检测结果受病毒浓度、试剂组成成分差异性、取样、加样、时间、环境等因素影响,存在一定的假阳性/假阴性(发生率1%~5%),灵敏度较低,可作为病毒感染的辅助筛查措施。
1.2 流通与应用
试剂流通与管控:核酸检测产品的采购与使用均在特定机构或单位部门由专人完成处理,其采购数量、使用数量、剩余量能得到有效监控;新冠病毒抗原/抗体检测产品本身涉及生物源性物质,虽具有一定管控要求,但其流通涉及单位、团队、个人,其采购数量、使用数量、剩余数量均不可控,不确定性较大。
检测条件与环境:核酸检测在PCR 实验室标准条件与环境内完成;新冠病毒抗原/抗体检测可在一般室温环境(居家、交通卡口等)下完成,检测产品本身对温湿度有要求,而一般开放性环境下,不仅温湿度差异较大,且开袋后时长也对结果有一定影响。此外,两者采样操作是否规范也会影响检测结果。
适用人群:核酸检测适用于所有人群;新冠病毒抗原/ 抗体产品应先区分非检测与检测产品,并根据不同适用人群(密接者、次密接者)先用不同样本类型进行适配。
检测及采样:核酸检测全过程由专业人员完成,较规范、统一;抗原/抗体检测更多由非专业人员自行检测完成,在检测操作、采样操作方面存在较大的个体差异及不确定因素[8-9]。
1.3 结果报告与管控
报告与判定:核酸检测报告由检测部门统一、规范、定时上报对接系统,且对报告的真实性有职业规范和责任感约束,并对检测结果报告与判定进行签字负责;抗原/抗体检测结果的报告与判定,则具有不确定性、随意性、不及时性、分散性。
废品处理:核酸检测后废弃物统一回收处理,抗原/抗体检测废弃物因分为阳性结果、阴性结果、无效结果,以及失效产品的废弃物,且分散到各场所及个人,为阳性废弃物的管控增加了不确定性和难度,同时,大量使用抗原/抗体检测产品必然导致医疗废弃垃圾大量产生。
数据结果管理:核酸检测可实现各份检测结果数据统一、及时、定期汇总对接相关部门系统管理[10];抗原/ 抗体检测结果分散到个人,结果管控存在不确定性,上传存在不定时性。
2 抗原/抗体检测闭环管控体系构建
2.1 闭环管控体系构建流程
针对以上两种检测方法的特点与区别,从产品、场所、人员、检测、监管等方面分析抗原/抗体检测闭环管控的科学、合理、可行性措施,以此构建抗原/抗体检测产品闭环管控体系[11-14],详见图1(UDI 为赋予的唯一识别码)。
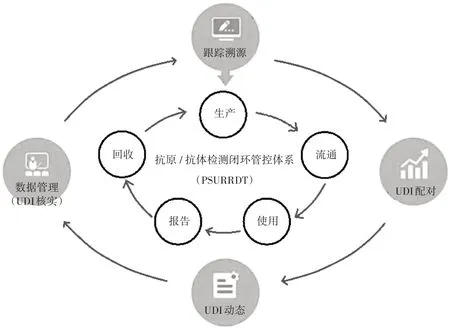
图1 抗原/抗体检测全过程闭环管控(PSURRDT)体系Fig.1 Schematic diagram of closed-loop overall process management and control(PSURRDT)system for antigen / antibody detection
2.2 具体措施
2.2.1 UDI 赋码管理
试剂来源与管控,除生产厂家对原料来源按生物源性物质相关规定管控外,生产厂家生产的抗原/抗体检测试剂产品应按《医疗器械唯一标识系统试点工作方案》管理规定实施生产[15],对每一个最小单元抗原/抗体检测试剂产品赋UDI后才可出厂销售。使每个检测试剂产品可追溯流通全过程,直至销售到个人。同时,多个最小单元整体包装均赋该包装内所有最小单元唯一识别码,整箱包装单元,以此类推。如为未赋码销售,可能导致检测试剂流通及使用过程的不可控。
2.2.2 分情况逐步实施
可按不同风险等级区、交通检验口、出入境检查口、人群密集或聚集场所实施开展。既可建立检测数据,又可在先行实施区域积累经验,不断完善检测过程(包括检测方法、相关制度规定等),建立科学、可行的实践基础与提供依据,便于进一步推广。对于治疗期间确诊患者、定点隔离人员、居家隔离人员、特定岗位及区域人员、防疫人员、检测人员等,新冠病毒感染、发病、治疗、治愈过程中体内病毒抗原/抗体不断发生变化,不同时期不同阶段人员检测时增加抗原/抗体检测作为补充,可及时便捷了解病程基本情况,尤其是定量检测诊断试剂,更可较准确了解情况,基本满足在特定区域、特定时间范围内对检测人员的监测要求,也大幅减小了医务人员工作量。同时,也为进一步开放性推广建立基础和提供依据。
2.2.3 详细简明编写说明书
说明书文字需简明、通俗,步骤清晰,并配以操作流程与步骤示意图,可增加二维码安装下载操作视频。检测产品说明书的内容、格式、语言文字等需区别于非检测产品,适用于大众阅读与理解。注意事项部分,增加提示扫描与关联及检测注意细节(尽量保持室温、确保开袋后多长时间内使用等),警示结果一旦阳性,主动联系社区报备,并将检测废弃物专门包装、于指定点回收。明确适用样本类型、明确适用不同人群对象和场所所应注意事项和特定要求。提供专门的咨询电话等联系方式。
2.2.4 相关管控
规格设计:建议当以家庭为单位时,单盒少则配2~3 人份,多则配10~12 人份;用于员工数超过10 人的企事业单位、集体,单盒配备数量不宜少于20 人份。以此避免过度浪费,也便于产品使用跟踪管理,以及增加购买依从性。同时便于第1次检测出现阳性结果时再进行1~2次检测复核。
组分与材质选择:建议采用复合铝膜包装,保证产品储存密封性,每个最小单元检测试剂条和采样棒(拭子)均单独包装;应配套较齐全的辅助工具或器材,必要时对其赋予与检测试剂产品一一对应的UDI。
检测与报告:基于检测试剂UDI与个人身份证相关联,检测结果与卫健委等相关部门对接,与相关防疫措施工具对接,跟踪销售流通的检测试剂。建立检测数据库,对数据库设立检测结果上报自动警报功能,定期统计检测结果并分析,为疫情应急防控监测系统收集必要的基础数据[9-12]。
跟踪回访:基于报告数据,有关部门不定期对购买及使用数量、检测情况、报告情况、废品处理情况进行跟踪流调。并收集存在的问题或困难,以便不断完善相关管控,以及设立对检测过程中遇到问题的答疑或咨询相关平台。
报废回收:分区定点回收处可以小区、生产队、街道、片区等为单位,由专人负责,根据报告数据库进行精准跟踪。对于在效期内未使用检测试剂建库跟踪[16]及过期检测试剂自行失效,以日常垃圾处理,或定点回收。或采用84消毒液等有效消毒剂集中处理,并上报处理结果。
流程宣讲:根据产品应用情况,分区域、街道、社区、单位,集中组织有关专业人员指导讲解检测程序、注意事项,并贯彻抗原/抗体检测相关政策法规。
3 讨论
根据国际疫情形势与我国国情,目前完全放开管控为时尚早,有必要在产品生产、流通、使用、报告、回收处理、数据库管理、跟踪溯源等环节,构建科学、有效、可行的抗原/抗体检测长效全过程闭环管控体系,分区、分类逐步推广且实行[17]。进一步促进防疫抗疫长效机制的建立与完善,以及产品创新研发与应用。
国内外新冠病毒检测产品与技术存在一定差异[18],就检测方法而言,其过程控制对检测十分关键[19-21],抗原检测与抗体检测仍存在产品组成成分、样本类型、检测方法(乳胶法、胶体金法、荧光免疫层析法等)等方面的差异,比核酸检测影响因素干扰更大。因此,应用场景及适用人群也存在一定差异,在抗原/抗体检测全过程闭环管控体系下,可研发更安全、有效、便捷的检测产品。不同检测方法、不同检测样本的检测产品,应有序、分区、分步推广,尤其对于面向大众的检测产品,不宜在同一时间窗内推行多种方法、多种检测样本的产品,抗体检测相对抗原检测受限因素更多。目前,抗原检测比抗体检测更适合先推行,并且检测产品应开展更广泛、深入、全面的干扰因素试验,不断提高检测产品的质量和可应用性。
国外许多国家与地区抗原检测完全放开,但未建立检测闭环管控体系,而是自行、自由、自主检测,存在数据结果混乱、感染与交叉感染风险增加等问题。由于文化和体制差异,建立抗原/抗体检测全过程闭环管控体系未必在这些国家和地区具有可行性。也有些通过唾液居家采样,然后送样到指定实验室进行检测[22]。
抗原/ 抗体检测结果上报需基于构建的抗原/ 抗体检测闭环管控体系,尤其适用于抗原/ 抗体居家自测、特定场所检测,可起到可追溯、预警、可控效果。与此同时,也需更多部门的协作,未来将会有更人性化、智能化配套的数据工具、计算机工具用于抗原/抗体检测全过程闭环管控中,进一步提升管控质量及效果。
