小鼠体内金银花提取物绿原酸的药动学研究
2023-03-29翁子依段义君肖瑞杨慧杰糜志远张佳
翁子依,段义君,肖瑞,杨慧杰,糜志远,张佳*
湖北工业大学(武汉 430068)
金银花为忍冬科植物忍冬(Lonicera japonicaThunb.)的干燥花蕾或带初开的花[1],在我国主要产于华东、中南、西南及河北、山西、辽宁、陕西、甘肃等地。金银花的药源植物的花、茎、叶均可入药。性味甘、寒,具有清热解毒、疏散风热的功效。金银花常用于外感咳嗽发热、败血症、腮腺炎、麻疹、菌痢、肠炎、阑尾炎、中暑感冒、外伤感染、肠道传染等疾病[2]。金银花的主要化学成分有挥发油、有机酸、黄酮类及三萜类,金银花化学成分复杂,具有多种功能性成分,主要包括有机酸类、挥发油、黄酮及其苷类[3-4]。金银花中抗菌消炎的主要成分为有机酸,其中绿原酸是主要有效成分[5]。绿原酸又名咖啡鞣酸,是一种广泛存在于植物中的多酚类化合物[6],具有抗菌[7-8]的作用。其药理作用有抑菌[9]、抗病毒[10]、抗炎[11-12]解热、抗氧化[13-14]、降血脂[15]、降血糖[16]、免疫调节[17]、抗肿瘤[18]等。此外,金银花多糖对葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎有保护作用[19],金银花果胶可促进神经发生,可能是治疗阿尔兹海默病的潜在靶向药物[20]。已有一些对绿原酸含量测定方法的文献报道,郑雪媚[21]利用高效液相色谱仪测定银黄甘颗粒中金银花有效成分绿原酸的含量。肖文平等[22]利用紫外分光光度法测定金银花中绿原酸的含量。金银花提取物绿原酸的药代动力学报道较少,邢晓玲等[23]研究银黄颗粒中绿原酸在大鼠血浆的药代动力学。吴磊等[24]研究大鼠灌胃清热养心颗粒后血浆中咖啡酸、绿原酸的药代动力学。绿原酸的提取方法也各不相同,Xu等[25]基于高速切均质机Ultra-Turrax的超声波辅助提取金银花中5种有机酸,Liu等[26]通过乙醇/盐水溶液两相法从金银花中选择性分离黄酮和糖类。试验使用甲醇超声提取绿原酸,采用高效液相色谱法分别测定小鼠血浆、肝、肾中金银花提取物含量变化,并对其进行小鼠体内的药代动力学研究,为更进一步挖掘金银花的药用价值提供一定参考。
1 仪器与材料
1.1 仪器与设备
Thermo Ultimate 3000型双三元液相色谱仪、VWD-3100型双光束可变波长紫外-可见检测器、Wps-3000sl·Analytical型全自动进样器、变色龙工作站(美国Thermo Fisher公司);TGL-16C型离心机(上海安亭科学仪器厂);UPT-I-10T型超纯水仪(四川优普超纯科技有限公司);BP121S型电子天平(德国赛多利斯集团公司);0.1~5 000 μL移液枪(德国Eppendorf公司);QL-901型旋涡混合器(江苏海门市麒麟医用仪器厂)。
1.2 药品与试剂
金银花购自武汉市金松大药房;甲醇(分析纯,国药集团化学试剂有限公司);绿原酸标准品(批号110753-201817,中检所对照品);肝素钠(≥180 USP,美国Sigma Aldrich公司);乙腈(色谱纯,德国CNW科技公司);试验所用溶液为实验室自制超纯水配制。
1.3 动物
昆明种小鼠[SPF级,体重30±2 g,许可证号SCXK(鄂)2021-0008,湖北省实验动物研究中心]。
2 方法与结果
2.1 色谱条件
色谱柱C18柱(4.6 mm×250 mm,5 μm);以V(甲醇)∶V(0.2%磷酸溶液)=12∶88为流动相;柱温箱35 ℃;流速1.0 mL/min;检测波长327 nm;进样量20 μL。
2.2 溶液的制备
2.2.1 金银花提取物制备
称取200 g金银花于烧杯中,加入1 000 mL水,回流提取5 h,纱布过滤,静置12 h,弃去沉淀,提取液减压浓缩至相对密度约1.7(50 ℃),放入鼓风干燥箱干燥至水分低于5%。得到金银花提取物。
2.2.2 样品处理
金银花提取物含量测定样品:精密称定0.1 g金银花提取物固形物,置于具塞锥形瓶中,加入50 mL 50%甲醇,超声5 min,移入100 mL容量瓶,用50%甲醇定容,经0.22 μm微孔滤膜过滤,取续滤液待用。
血浆样品处理:从小鼠眼球采集1 mL全血,置于加入抗凝血肝素的5 mL离心管,立即离心(12 000 r/min,10 min),取100 μL上清液于另一洁净离心管,加入1 mL甲醇,超声10 min,按12 000 r/min离心10 min,上清液用0.22 μm微孔滤膜过滤,所得滤液于棕瓶保存。
肝肾样品处理:取约0.18 g小鼠肝肾组织于玻璃匀浆器中,加入1.5 mL生理盐水后研磨成组织匀浆,涡旋5 min,立即离心(12 000 r/min,10 min),取100 μL上清液于另一洁净离心管,加入1 mL甲醇,超声10 min,按12 000 r/min离心10 min,上清液用0.22 μm微孔滤膜过滤,所得滤液于棕瓶保存。
2.2.3 标准品储备液的制备
精密称取0.05 g绿原酸于25 mL容量瓶内,用50%甲醇溶解并定容,得到标准品储备液。
2.2.4 质控样品的制备
取适量绿原酸储备液,加入空白血浆稀释,按2.2.2的样品处理方法处理,制成质量浓度16,20和24 μg/mL的绿原酸血浆溶液,作为血浆质控样品。肝肾组织处理方法同血浆样品,作为肝脏质控样品和肾脏质控样品。
2.3 方法学验证
2.3.1 专属性试验
分别取空白血浆样品、绿原酸标准溶液(20 μg/mL)、空白血浆,加100 μL绿原酸标准溶液,得到血浆专属性系列溶液,肝肾组织专属性溶液同血浆,经0.22 μm微孔滤膜过滤,取20 μL续滤液注入色谱仪并记录色谱图。
测定图谱如图1~图3所示。绿原酸保留时间在6.972 min,峰形正态分布,与其他峰分离良好,无内源性物质干扰,该方法专属性良好。
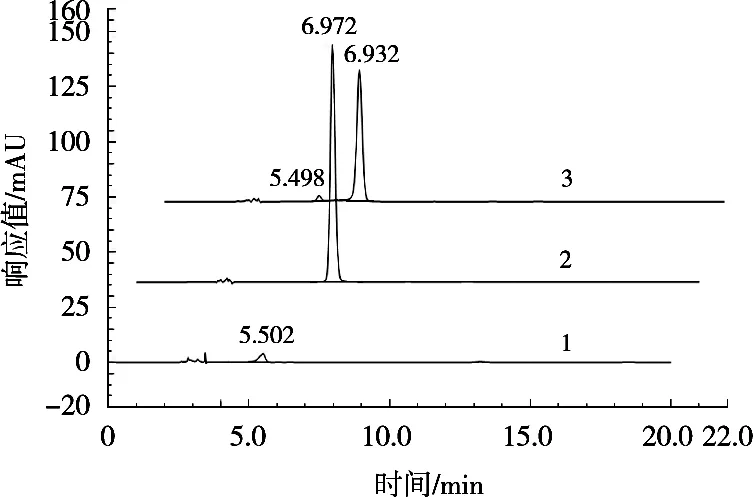
图1 血液专属性HPLC图

图2 肝脏专属性HPLC图

图3 肾脏专属性HPLC图
2.3.2 线性关系考察
将标准品储备液稀释成6个不同质量浓度(在3~28 μg/mL范围内),分别为3,6,10,15,21和28 μg/mL,经0.22 μm微孔滤膜过滤,取20 μL续滤液注入液相色谱仪,记录色谱图。以峰面积(y)为纵坐标,标准品绿原酸的浓度(x)为横坐标绘制标准曲线。线性关系如图4所示。标准曲线方程为y=0.923 7x-1.012 9,相关系数R2=0.999 4,表面血浆样品绿原酸与主峰面积在3~28 μg/mL范围内线性关系良好。以信噪比rSN≥3和rSN≥10分别计算最低检测限和定量限,最低检测限和定量限分别为0.056 7 μg/mL和0.248 8 μg/mL,测定图谱如图5和图6所示。

图4 绿原酸标准曲线

图5 检测限

图6 定量限
2.3.3 精密度试验
取2.2.4制备的血浆质控样品、肝脏质控样品、肾脏质控样品,进行日内和日间分析。日内分析是指在同一天5个不同时间重复测定同一样品,日间分析是在连续的5 d内重复测定同一样品。平行测定3组,连续测定5 d,并记录色谱图,计算相对标准偏差SRSD值,判断精密度是否良好。
测量结果如表1,表2和表3所示。3种质量浓度样品的日内精密度和日间精密度SRSD均小于2.5%,表明该方法准确度和精密度均良好,符合生物样品测定要求。
表1 血浆精密度试验结果(n=6,±S)

表1 血浆精密度试验结果(n=6,±S)
理论质量浓度/(μg·mL-1)日内精密度 日间精密度测得质量浓度/(μg·mL-1) SRSD/% 测得质量浓度/(μg·mL-1) SRSD/%16 15.50±0.21 1.32 15.54±0.33 2.00 20 19.51±0.18 0.83 19.39±0.21 1.00 24 22.69±0.28 1.14 22.45±0.43 1.83
表2 肝脏精密度试验结果(n=6,±S)

表2 肝脏精密度试验结果(n=6,±S)
理论质量浓度/(μg·mL-1)日内精密度 日间精密度测得质量浓度/(μg·mL-1) SRSD/% 测得质量浓度/(μg·mL-1) SRSD/%16 15.02±0.36 2.25 14.44±0.25 1.66 20 18.79±0.18 1.01 18.66±0.38 1.84 24 21.39±0.36 1.57 21.52±0.37 1.51
表3 肾脏精密度试验结果(n=6,±S)

表3 肾脏精密度试验结果(n=6,±S)
理论质量浓度/(μg·mL-1)日内精密度 日间精密度测得质量浓度/(μg·mL-1) SRSD/% 测得质量浓度/(μg·mL-1) SRSD/%16 14.46±0.36 2.22 14.45±0.27 1.91 20 19.38±0.25 1.29 18.72±0.24 1.21 24 21.58±0.28 1.16 21.41±0.39 1.61
2.3.4 重复性试验
取2.2.4制备的血浆质控样品、肝脏质控样品、肾脏质控样品,各6份,测定,分别记录血浆质控样品、肝脏质控样品、肾脏质控样品的峰面积值,并计算相对标准偏差SRSD,测定结果如表4所示。3种质量浓度样品的重复性SRSD均小于2.5%,表明该方法重复性良好,符合生物样品测定要求。
表4 重复性试验结果(n=6,±S)

表4 重复性试验结果(n=6,±S)
理论质量浓度/(μg·mL-1)血浆 肝脏 肾脏测得质量浓度/(μg·mL-1) SRSD/% 测得质量浓度/(μg·mL-1) SRSD/% 测得质量浓度/(μg·mL-1) SRSD/%16 15.55±0.25 0.98 14.97±0.41 1.69 14.52±0.32 1.69 20 19.61±0.27 1.11 18.69±0.31 1.28 19.55±0.33 1.57 24 22.53±0.49 1.40 21.39±0.36 1.08 21.60±0.32 1.12
2.3.5 稳定性试验
分别取2.2.4制备的血浆质控样品、肝脏质控样品、肾脏质控样品,各2份。一份置于室温(25 ℃)保存,于0,1,2,3和6 h测定,记录色谱图;另一份于-20 ℃保存,于0,1,2,3和6 h测定,记录色谱图。计算血浆质控样品、肝脏质控样品、肾脏质控样品的SRSD,判断稳定性是否良好。
测定结果如表5,表6和表7所示。样品在室温(25 ℃)及冻融条件下稳定性良好,各组织不同水平浓度在室温(25 ℃)及冷冻保存后测得的SRSD分别在0.50%~2.65%和0.75%~1.74%范围内,说明该生物样品的稳定性符合生物样品分析要求,样品在室温(25℃)和冷冻(-20 ℃)下均可放置6 h。
表5 血浆稳定性试验结果(n=6,±S)
理论质量浓度/(μg·mL-1)室温 (25 ℃) 冷冻 (-20 ℃)测得质量浓度/(μg·mL-1) SRSD/% 测得质量浓度/(μg·mL-1) SRSD/%16 14.80±0.52 2.65 14.03±0.28 1.74 20 18.12±0.29 1.48 17.88±0.28 1.28 24 22.30±0.47 1.64 21.90±0.41 1.31
表6 肝脏稳定性试验结果(n=6,±S)
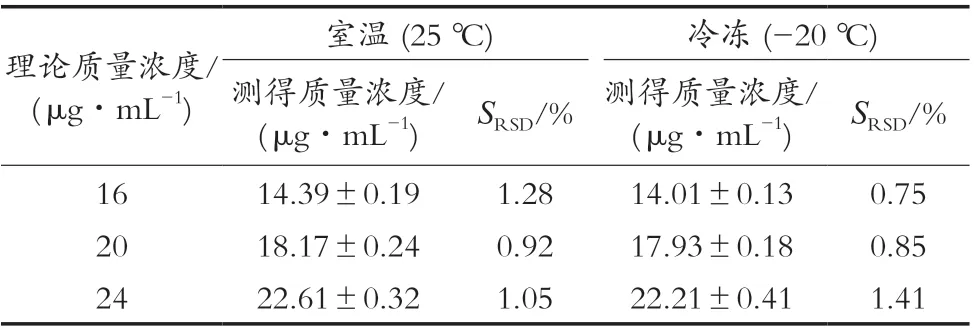
表6 肝脏稳定性试验结果(n=6,±S)
理论质量浓度/(μg·mL-1)室温 (25 ℃) 冷冻 (-20 ℃)测得质量浓度/(μg·mL-1) SRSD/% 测得质量浓度/(μg·mL-1) SRSD/%16 14.39±0.19 1.28 14.01±0.13 0.75 20 18.17±0.24 0.92 17.93±0.18 0.85 24 22.61±0.32 1.05 22.21±0.41 1.41
表7 肾脏稳定性试验结果(n=6,±S)

表7 肾脏稳定性试验结果(n=6,±S)
理论质量浓度/(μg·mL-1)室温 (25 ℃) 冷冻 (-20 ℃)测得质量浓度/(μg·mL-1) SRSD/% 测得质量浓度/(μg·mL-1) SRSD/%16 13.80±0.52 2.22 13.71±0.23 1.05 20 18.34±0.12 0.50 17.86±0.33 1.29 24 22.05±0.33 1.14 21.74±0.32 0.92
2.3.6 提取回收率试验
提取回收率反映生物样品中目标化合物的提取效率,是评价生物样品分析方法的重要指标之一[27]。取2.2.4制备的血浆质控样品、肝脏质控样品、肾脏质控样品,每个浓度平行测定3次,记录色谱图,峰面积带入回归方程得到溶液浓度,测得浓度与理论标准浓度的比值即为相对回收率。
测定结果如表8所示。血浆、肝脏、肾脏的平均提取回收率为92.42%,91.95%和89.86%,证明该方法提取回收率良好,符合生物样品分析方法的要求。
表8 回收率试验结果(n=6,±S)

表8 回收率试验结果(n=6,±S)
度/(μg·mL-1) 质控样品 测得质量浓度/(μg·mL-1)样品质量浓平均提取回收率/% SRSD/%16 血浆 14.76±0.25 92.25 2.04肝脏 14.41±0.12 90.08 1.00肾脏 13.73±0.32 85.79 2.83 20 血浆 18.21±0.27 91.05 1.81肝脏 18.18±0.18 90.92 1.19肾脏 18.28±0.05 91.42 0.33 24 血浆 22.55±0.13 93.96 0.73肝脏 22.77±0.10 94.86 0.52肾脏 22.05±0.24 91.86 1.35
2.4 药代动力学研究
取66只雌雄各半的小鼠,随机分为两大组,各大组再分为3小组,每小组11只。给药前禁食12 h,金银花提取物用适量水溶解,经灌胃给药,给药剂量按绿原酸计为100 mg/kg和20 mg/kg高、低2种浓度,给药容量为0.1 mL/kg,给药后于0,5,10,15,20,30,60,90,120,150和180 min进行取样,于1.2.3的样品方法处理,经0.22 μm微孔滤膜过滤,取20 μL续滤液注入色谱仪并记录色谱图,药动学参数用DAS 2.0软件进行计算和处理。
用建立的分析方法进行绿原酸的药代动力学研究。根据各时间点测定血液、肝脏、肾脏的药物浓度绘制“药物浓度-时间”曲线,如图7~图9所示,数据通过DAS 2.0药动学程序进行拟合。

图7 小鼠2种剂量灌胃后血液中绿原酸浓度-时间曲线

图8 小鼠2种剂量灌胃后肝脏中绿原酸浓度-时间曲线
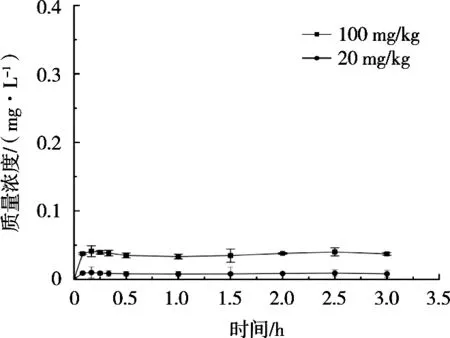
图9 小鼠2种剂量灌胃后肾脏中绿原酸浓度-时间曲线
绿原酸在血浆和肝脏中有吸收,在肾脏中几乎无吸收。根据非房室模型统计矩参数的方法,计算主要动力学参数,如表9和表10所示。
表9 2种剂量灌胃后,绿原酸在小鼠体内动力学参数(血浆)(n=3,±S)
统计矩参数 剂量20 mg/kg 100 mg/kg AUC(0-t)/(mg·L-1·h-1) 0.994±0.063 5.672±0.055 AUC(0-∞)/(mg·L-1·h-1) 1.007±0.063 5.759±0.515 MRT(0-t)/h 0.568±0.046 0.676±0.029 MRT(0-∞)/h 0.593±0.045 0.722±0.025 t1/2z/h 0.490±0.016 0.490±0.032 Tmax/h 0.159±0.017 0.167±0.037 VZ/(L·kg-1) 14.134±1.372 12.269±0.898 CLZ/(L·h-1·kg-1) 19.934±1.290 17.366±0.155 Cmax/(mg·L-1) 2.155±0.010 9.451±0.228
表10 2种剂量灌胃后,绿原酸在小鼠体内动力学参数(肝脏)(n=3,±S)

表10 2种剂量灌胃后,绿原酸在小鼠体内动力学参数(肝脏)(n=3,±S)
统计矩参数 剂量20 mg/kg 100 mg/kg AUC(0-t)/(mg·L-1·h-1) 0.652±0.028 3.847±0.035 AUC(0-∞)/(mg·L-1·h-1) 0.654±0.028 3.868±0.033 MRT(0-t)/h 0.390±0.033 0.582±0.005 MRT(0-∞)/h 0.407±0.034 0.592±0.009 t1/2z/h 0.423±0.011 0.390±0.014 Tmax/h 0.139±0.040 0.164±0.023 VZ/(L·kg-1) 18.703±1.033 14.549±0.637 CLZ/(L·h-1·kg-1) 30.608±1.341 25.855±0.218 Cmax/(mg·L-1) 1.568±0.411 7.386±0.019
由药代动力学参数可知:绿原酸在血浆中的达峰时间为0.163 h,清除半衰期约0.490 h;在肝脏中的达峰时间为0.151 h,清除半衰期为0.401 h;在血液、肝脏中的药时曲线下面积(AUC)均与给药剂量呈正比,符合线性一级消除过程。
3 讨论与结论
金银花具有清热解毒、疏风散热等功效,是一种常用的中草药,其主要活性成分是绿原酸。金银花在饲料中可作为增强动物自身免疫力的饲料添加剂,起到缓解动物肠道氧化应激和抗炎的作用。市售与金银花相关的药品数量繁多,为进一步研究金银花提取物在动物体内的吸收分布,此次试验建立了测定金银花提取物中绿原酸在经灌胃后在小鼠体内含量,以及分布和药代动力学方法。血浆、肝肾组织样品经甲醇提取后,采用高效液相色谱法测定。结果表明,日内与日间精密度均小于15%,血浆、肝脏和肾脏的平均回收率为92.42%,91.95%和89.86%,高、中、低3种浓度的水平回收率在0.33%~2.83%范围内,符合药代动力学研究要求。该方法操作简单,专属性强,灵敏度高,对精密度、重复性、回收率等均做了详细研究,证明该方法稳定,可靠。试验结果可为金银花的药物开发及在药物的临床应用上提供一定参考。
