白蛋白结合型紫杉醇联合卡铂治疗晚期三阴性乳腺癌的疗效评估
2023-03-28侯晓杰
何 波,侯晓杰,慕 媛
三阴性乳腺癌(triple-negative breast cancer, TNBC)是指雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)及人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)表达均为阴性的一类乳腺癌,采用针对这些受体的靶向治疗及内分泌治疗均无效[1]。TNBC占所有乳腺癌患者的15%左右,具有发病年龄小、复发风险高、转移率高及预后差等特点[2]。由于在治疗上也缺乏有效的作用靶点,当前仍以全身化疗为主[3]。TNBC患者首选的化疗方案往往以单药序贯化疗为主,而对于部分肿瘤负荷高且症状明显的患者,往往需要联合化疗来改善患者的预后。
铂类药物抗肿瘤机制主要是与肿瘤DNA结合而诱导双链内外发生交联,并最终导致肿瘤细胞DNA解离,进而发育停止[4]。研究显示无论单药或者联合化疗均显示出了良好的效果,且在一定程度上优于吉西他滨或多西他赛[5,6]。另外一种在晚期TNBC治疗中具有影响力的是白蛋白结合型紫杉醇(albumin binding paclitaxel, nab-paclitaxel),后者以人血白蛋白为载体,依靠白蛋白与血管内皮细胞膜的结合将紫杉醇以胞呑的形式送入细胞内,达到抑制细胞有丝分裂的效果[7],且相对于普通紫杉醇而言更容易亲和人体,效果更好不良反应更小[8,9]。本研究旨在探讨nab-paclitaxel联合卡铂在一线治疗晚期TNBC的近期及远期效果。
1 对象与方法
1.1 对象 选择2018-03-01至2020-12-31解放军总医院第三医学中心肿瘤科收治的120例晚期转移性TNBC为研究对象。纳入标准:(1)经影像学及病理学检查明确诊断为TNBC;(2)初次就诊,既往未接受其他治疗;(3)预期生存周期>3个月;(4)临床资料完善且愿意配合进行随访调查。排除标准:(1)合并其他原发性恶性肿瘤的患者;(2)合并严重心脑肝等重要脏器功能障碍的患者;(3)对本研究所使用药物存在严重副作用及过敏的患者。按照随机数字表法将120例患者分为对照组及观察组,每组60例,两组患者在年龄、转移灶、美国东部肿瘤协作组(eastern cooperative oncology group, ECOG)评分上均无统计学差异(P>0.05,表1),具有可比性。所有患者均对本研究知情同意并签署相关知情同意书。本研究获得医院伦理委员会的同意。
1.2 方法 患者均在住院期间予以常规护理及静脉营养补充,保持水电酸碱平衡。对照组予以nab-paclitaxel联合吉西他滨方案:注射用白蛋白结合型紫杉醇(石药集团欧意药业有限公司,国药准字:H20183044,规格:100 mg),按照3周疗法,260 mg/m2,配置100 ml生理盐水,30 min内注射完,存在输液反应的患者可降低输液速度,第1天给药,每3周为1个治疗周期。吉西他滨(江苏豪森药业集团有限公司,国药准字:H20030104),1000 mg/m2,配置100 ml生理盐水,30 min内注射完,存在输液反应的患者可降低输液速度,第1、8天给药,后1周休息,每3周为1个治疗周期。
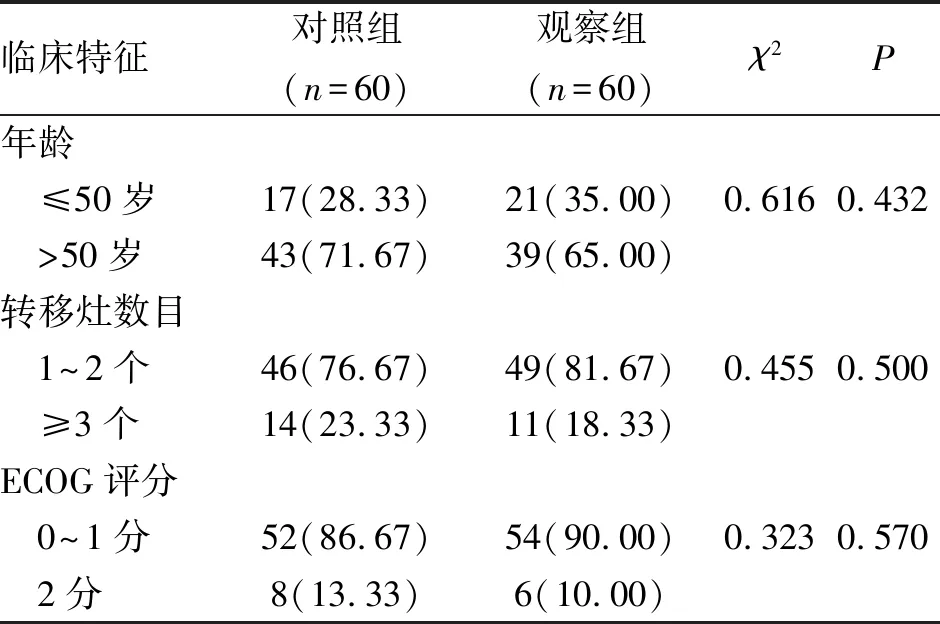
表1 两组三阴性乳腺癌患者的基线资料 (n;%)
观察组予以nab-paclitaxel联合卡铂方案:注射用白蛋白结合型紫杉醇,药品信息及用法同对照组。卡铂注射液(齐鲁制药有限公司,国药准字H20020181,10 ml:100 mg),0.3 g/m2配置,第2天给药,每3周为1个治疗周期,至少治疗2个周期。在注射化疗药物前后均予以水化、止吐、抑酸等对症支持治疗。每次化疗后予以健康宣教。
对所有患者进行2个阶段的随访,近期随访:患者在化疗结束后每个月来我院进行随访1次影像学及血清学检查,连续随访6个月,随访终点为患者出现疾病进展或死亡,统计每个时间段患者的治疗效果及相关肿瘤指标水平。远期随访:患者在化疗结束后至随访结束(2022-05-31),期间是否出现疾病进展(progressive disease, PD)及出现PD的时间,是否出现全因性死亡及出现全因性死亡的时间。
1.3 观察指标
1.3.1 治疗效果 以患者化疗前测量的肿瘤大小为基线数据,所有患者均在化疗完成后随访影像学及血清学检查,按照实体瘤RECIST1.1的标准[10]评价分为以下4级:(1)完全缓解(complete response, CR),所有目标病灶(原发灶及转移灶)完全消失;(2)部分缓解(partial response, PR),所有可测量的目标病灶直径总和降低≥基线水平30%;(3)疾病稳定(stable disease, SD),标准介于PR和PD之间;(4)PD,所有可测量的目标病灶直径总和增加≥基线水平20%+所有可测量的目标病灶直径增加≥5 mm,或出现新病灶。客观缓解率(%)=(CR+PR)/总例数×100%,疾病控制率(%)=(CR+PR+SD)/总例数×100%。
1.3.2 肿瘤标志物 收集所有患者化疗前、化疗后及随访期间空腹状态下静脉血5 ml,3000 r/min离心10 min,取上清保存至-80 ℃冰箱,待需要时取出进行检测,其中一部分采用酶联免疫吸附法检测中期因子(midkine, MK)(pg/ml)和血小板第4因子(platelet factor 4, PF4)(ng/ml)水平,另一部分采用电化学发光全自动免疫分析仪(Roche Elecsys 2010)检测血清中癌胚抗原(carcinoembryonic antigen, CEA)、糖链抗原125(carbohydrate antigen 125, CA125)及糖链抗原15-3(carbohydrate antigen 15-3, CA15-3)。其中Roche ECL 2010检测下的正常参考范围为:CEA<10 ng/ml,CA125<35 U/ml,CA15-3<28 U/ml。
1.3.3 不良事件 按照美国国立癌症研究所常见术语标准不良事件(national cancer institute-common terminology criteria adverse events, NCI-CTCAE)version 3.0[11]评估患者在化疗期间所出现的不良反应,按照症状的程度不同分为0~4级,0级表示无症状,4级表示症状很严重,记录患者住院期间所发生的皮疹、恶心、呕吐、白细胞减少、血小板检查、肝肾功能异常、外周神经毒性等。
1.3.4 生存时间 根据患者是否出现PD或全因性死亡以及相应的时间,绘制无进展生存(progressive free survival, PFS)曲线及总生存(overall survival, OS)曲线,并计算中位无进展生存时间(median progressive free survival, mPFS)及中位总生存时间(median overall survival, mOS)。
2 结 果
2.1 近期治疗效果对比 在化疗完成后的1~6个月,两组患者出现PD的例数均逐渐增加,对照组出现40例PD,观察组出现31例PD,两组患者出现CR、PR、SD及PD的例数及ORR、DCR变化曲线如表2及图1所示,两组患者在不同时间点的CR、PR及SD例数差异均无统计学意义。
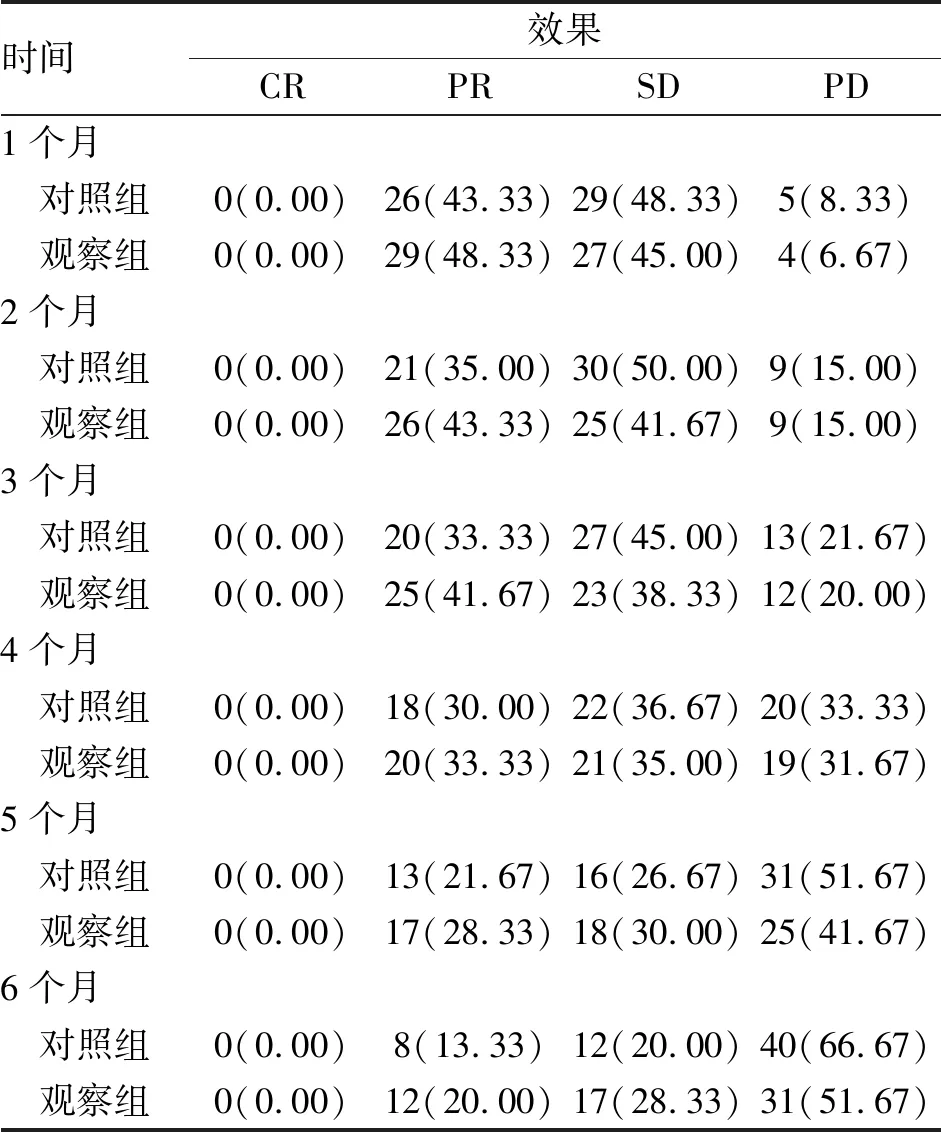
表2 两组三阴性乳腺癌患者化疗后不同时间点治疗效果的比较 (n;%)
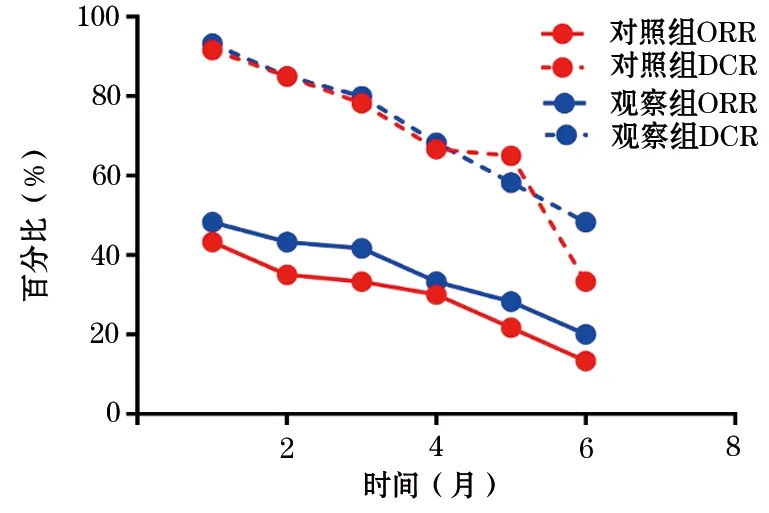
图1 两组三阴性乳腺癌患者治疗近期ORR、DCR变化曲线
2.2 血清学标记物变化 两组患者化疗前血清学指标(CEA、CA125、CA15-3、MK、PF4)对比差异无统计学意义。化疗后,两组血清学指标均显著下降(P<0.05),其中观察组CA125、CA15-3、MK及PF4均低于对照组(P<0.05)。在后续随访的6个月,两组患者的上述指标均逐渐上升,观察组患者的CA125、CA15-3、MK及PF4均明显低于对照组(P<0.05),CEA也低于对照组,但差异无统计学意义(表3)。

表3 两组三阴性乳腺癌患者血清学标记物的变化
2.3 近期及远期生存曲线对比 在近期随访的时间内,对照组出现40例PD,其中15例死亡,观察组出现31例PD,其中8例死亡;对照组mPFS为3.44个月(95%CI:2.98~5.43个月),观察组mPFS为4.20个月(95%CI:3.56~5.89个月),两组对比差异有统计学意义(P<0.05);对照组mOS为6.00个月(95%CI:4.78~6.00个月),观察组mOS为6.00个月(95%CI:4.93~6.00个月)。在远期随访的时间内,所有患者均出现PD,其中对照组54例死亡,观察组49例死亡;对照组mPFS为5.75个月(95%CI:3.56~10.32个月),观察组mPFS为6.77个月(95%CI:4.65~11.20个月),两组对比差异有统计学意义(P<0.05);对照组mOS为8.78个月(95%CI:5.88~13.23个月),观察组mOS为10.77个月(95%CI:6.03~14.44个月),两组对比差异有统计学意义(P<0.05,图2)。
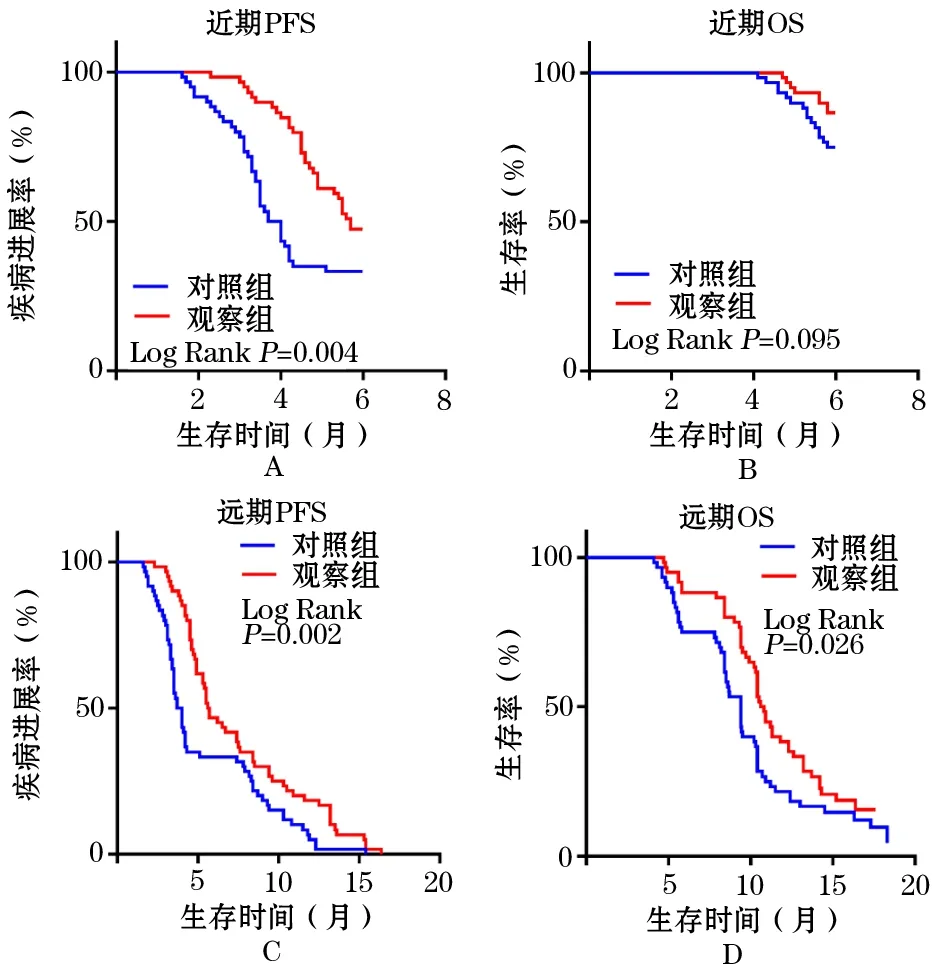
图2 两组三阴性乳腺癌患者的近期、远期生存曲线
2.4 不良反应 在患者住院期间,两组患者皮疹、恶心、呕吐、贫血、白细胞减少、血小板减少、肝肾功能异常、外周神经毒性等不良反应的发生率及严重程度比较均无统计学意义(表4)。

表4 两组患者不良反应发生情况 (n;%)
3 讨 论
TNBC是一种特殊的乳腺癌类型,在基因的表达上,TNBC存在ER、PR及her2的三阴性,使得其在治疗手段上相对有限。TNBC具有早发、早复发及早转移的特点,预后较差,复发转移的患者中位时间约为10个月[12]。由于目前对TNBC的发病机制尚未完全明确,因此在治疗上也没有更多选择方案,当下仍以全身性化疗为基本治疗原则,TNBC的治疗一直是临床工作者的一个难题。因此,在现有的化疗药物上选出最适合TNBC患者的搭配方案对于延长患者的生存时间具有重要的意义。
紫杉醇是一种复杂的次生代谢产物,通过与肿瘤微管蛋白结合而阻断细胞的有丝分裂,达到抑制肿瘤细胞的作用。nab-paclitaxel作为一种新型的紫杉醇类药物,以人血白蛋白为载体,采用纳米技术支撑了大小约130 nm的冻干剂,不仅提高了药物的使用效率,也省去了处理上的不便。同时,依靠肿瘤组织中普遍高表达的半胱氨酸酸性分泌蛋白(SPARC)的白蛋白高亲和性,进一步提升了局部的紫杉醇浓度,对肿瘤的杀伤效果更强,也降低了对正常细胞的毒性[13]。
nab-paclitaxel自2005年批准用于治疗复发性乳腺癌,关于以nab-paclitaxel为一线、二线治疗方案的研究均被国内外报道。梁旭等[14]报道了23例TNBC患者在接受nab-paclitaxel治疗后,mPFS为4.1个月;也有研究显示,nab-paclitaxel联合卡铂的方案mOS长于吉西他滨联合卡铂的方案(16.8个月vs.12.6个月)[15]。对于二线及以上方案治疗晚期TNBC,nab-paclitaxel仍有一定的效果,但相对比与一线即采用nab-paclitaxel单药及联合用药的治疗方案,时效性有限[16]。因此,当前仍建议nab-paclitaxel用于晚期TNBC的一线化疗方案。
铂类一直是肿瘤化疗的常用药物,其主要机制是诱发肿瘤DNA双链断裂而导致肿瘤细胞凋亡,随着研究的深入,人们发现TNBC患者中普遍存在的BRCA突变是导致TNBC细胞对紫杉烷类药物耐药的原因之一,而BRCA的突变也造成了乳腺癌细胞对铂类或丝裂霉素所造成的损伤的修复能力减弱[17],因此nab-paclitaxel与铂类的组合可能会发挥良好的治疗效果。而吉西他滨则是一种影响核酸合成的抗代谢类抗肿瘤药物,对晚期乳腺癌及复发性乳腺癌均具有良好的效果和敏感性,是当前国内多个指南推荐的用于晚期乳腺癌治疗的单药或联合化疗方案[18,19]。因此本研究选用nab-paclitaxel联合吉西他滨作为对照组治疗方案。
本研究从治疗近期效果上看,观察组的ORR值要高于对照组,说明nab-paclitaxel联合卡铂的短期抑制肿瘤生长的效果要优于nab-paclitaxel联合吉西他滨。不仅如此,在血清学数据上,观察组患者的CA125、CA15-3、MK及PF4均显著低于同时期的对照组,MK属于血管生长调控因子[20],PF4属于血小板衍生因子[21],二者与肿瘤生长过程中新生血管生成的调控密切相关,尽管随着时间的推移,二者在患者中呈逐步上升趋势,但观察组患者的MK及PF4水平显著低于对照组,表明nab-paclitaxel联合卡铂的肿瘤抑制效果要优于nab-paclitaxel联合吉西他滨。从患者的生存结局及达到结局的时间上看,观察组在近期的PFS、远期PFS及远期OS上均显著优于对照组。而在治疗的不良反应上,由于是联合化疗,加之患者为已发生转移的TNBC患者,因此大部分患者均出现了轻度的0~2级的骨髓抑制、恶心呕吐等症状,也有部分患者出现了皮疹及肝肾功能异常,与化疗药物本身对人体的损伤有关,由于nab-paclitaxel的缓冲作用,3~4级不良反应发生率较低,且在治疗过程中得到了良好的控制。同时,由于本研究纳入了部分多发转移的患者,包括脑转移,可能会缩短整体患者的生存时间,实际过程中也有部分患者治疗无效后放弃治疗,因此本研究所纳入患者的整体生存期较短。
综上所述,本研究通过对nab-paclitaxel联合卡铂及吉西他滨的对比观察,得出了nab-paclitaxel联合卡铂的近期、远期治疗效果均优于nab-paclitaxel联合吉西他滨,而两种方案的不良反应发生率未见明显差异。同时本研究也注意到存在样本量不足的缺陷,可能会对本研究的结论造成一定的影响,有待后续研究的进一步开展。
