高同型半胱氨酸血症与胱硫醚-β-合酶敲除小鼠紫癜性肾炎加重的相关性
2023-03-28陈雷刚杨晓静高晓莉冯冬梅郭宝珠
陈雷刚,杨晓静,赵 鸿,高晓莉,冯冬梅,郭宝珠
紫癜性肾炎 (Henoch-Schonlein purpura nephritis,HSPN) 是自身免疫性疾病过敏性紫癜(Henoch-Schonlein purpura,HSP)最常见的合并症,也是目前儿童继发性肾小球疾病最常见的病因[1,2]。多数HSPN 患儿预后良好,但也有少数HSPN 患儿病情迁延、甚至发展为慢性肾功能不全, 严重影响患儿的身心健康。目前,HSPN 的发病机制尚未完全阐明, 临床上也缺乏有效的HSPN 防治手段。 近些年,多项研究证实高同型半胱氨酸血症 (hyperhomocysteinemia,HHcy)与多种肾脏疾病有关[3,4]。 同型半胱氨酸(homocysteinemia,Hcy)在蛋氨酸代谢循环中产生,具有激活炎症反应、 细胞凋亡、 内质网应激 (endoplasmic reticulum stress,ESR)等生物学作用。中国吴凯等[5]研究证实,高蛋氨酸饮食诱导的HHcy 引起胱硫醚-β-合酶(cystathionine-β-synthase,CBS)杂合敲除(knockout,KO)小鼠发生肾损伤且这一作用与激活肾脏内ESR 有关。 HSPN 相关的临床研究证实,HSPN 患儿血清Hcy水平升高[6],但HHcy 在HSPN 发病中的作用及机制尚不清楚。 因此,笔者以CBS-KO 小鼠为实验对象,分析HHcy 在HSPN 发病中的作用及机制,旨在为今后阐明HSPN 的发病机制、发现HSPN 的防治靶点提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
CBS-野生型(wild type,WT)C57BL/6J 雄性小鼠40 只,鼠龄8~10 周,体质量18~20g;CBS-KO 雄性小鼠(C57BL/6J 背景)40 只,鼠龄8 ~10 周,体质量18 ~20 g。 均购置于上海南方模式生物研究中心,动物使用许可证号SYXK(沪)2018-0002。
1.1.2 主要试剂与仪器
印度墨水、麦醇溶蛋白、ERS 激动剂毒胡萝卜素、ERS 拮抗剂4-苯基丁酸 (4-phenylbutyric acid,4-PBA)(Sigma, 美国); 考马斯亮蓝、 苏木精-伊红(hematoxylin eosin,HE) 染 色 试 剂 盒、TdT 介 导 的dUTP 缺口末端标记 (TdT-mediated dUTP nick-end labeling,TUNEL)试剂盒(上海碧云天公司,中国);CAAT 区/增强子结合蛋白 (CAAT/enhancer binding protein,C/EBP)同源蛋白(C/EBP-homologous protein,CHOP)、含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)-12、caspase-3一抗(CST,美国)。
小动物全自动生化分析仪(浙江杭州德格医疗设备公司,中国);正置显微镜(尼康公司,日本);透射电子显微镜(日立公司, 日本); 凝胶电泳及成像系统(Bio-rad,美国)。
1.2 方法
1.2.1 动物分组与干预
CBS-WT 小鼠随机分为常规饮食CBS-WT 组、高蛋氨酸饮食CBS-WT 组、 常规饮食CBS-WT +HSPN 组、 高蛋氨酸饮食CBS-WT+HSPN 组;CBSKO 小鼠随机分为常规饮食CBS-KO 组、高蛋氨酸饮食CBS-KO 组、常规饮食CBS-KO + HSPN 组、高蛋氨酸饮食CBS-KO+HSPN 组、 高蛋氨酸饮食CBSKO+HSPN+溶剂对照组、 高蛋氨酸饮食CBS-KO+HSPN + ERS 拮抗剂组、 高蛋氨酸饮食CBS-KO +HSPN+ERS 激动剂组。
采用印度墨水尾静脉注射联合麦醇溶蛋白灌胃的方式建立HSPN 模型。尾静脉注射印度墨水0.4 mg/10 g,1 次/周,连续3 周;而后给予质量浓度1 mg/mL麦醇溶蛋白(溶于6 mmol/L 盐酸)每只0.5 mL 灌胃,1次/隔天,连续11 周,其中在最后3 d 给予质量浓度1 mg/mL 麦醇溶蛋白尾静脉注射,每只0.2 mL,1 次/天,连续3 d。 造模过程中,自由摄水,常规饮食给予常规饲料喂养,高蛋氨酸饮食给予含有2%蛋氨酸的饲料喂养。高蛋氨酸饮食CBS-KO+HSPN+溶剂对照组、高蛋氨酸饮食CBS-KO+HSPN+ERS 拮抗剂组、高蛋氨酸饮食CBS-KO+HSPN+ERS 激动剂组在造模过程中分别给予0.9%氯化钠溶液(生理盐水)腹腔注射,1 次/天,400 mg/kg 4-PBA 腹腔注射,2 次/周,1 mg/kg 毒胡萝卜素腹腔注射,1 次/天。
1.2.2 标本收集与保存
造模结束后,在代谢笼内收集24 h 尿液,于-20 ℃条件下保存;禁食12 h 后摘除眼球取血约1 mL,静置凝血后离心分离血清,于-20 ℃条件下保存;另取肾脏皮质标本并分为2 份,1 份用4%多聚甲醛溶液固定并石蜡包埋、室温保存,1 份用液氮冷冻保存。
1.2.3 肾脏病理改变的检查
取石蜡包埋的肾脏标本,制作病理切片,采用HE染色试剂盒进行染色, 按照试剂盒说明书进行操作,染色完成后在光学显微镜下观察肾脏的病理改变。
1.2.4 血清指标的检测
取血清标本, 采用全自动生化分析仪检测Hcy、血清肌酐(serum creatinine,SCr)、尿素氮(urea nitrogen,BUN)的含量。
1.2.5 24 h 尿蛋白含量的检测
取24 h 尿液标本,称量体积,采用考马斯亮蓝法检测蛋白浓度, 按照蛋白浓度× 体积计算24 h 尿蛋白含量。
1.2.6 肾脏内细胞凋亡的检测
取石蜡包埋的肾脏标本, 制作病理切片, 采用TUNEL 试剂盒进行染色, 按照试剂盒说明书进行操作, 染色完成后在光学显微镜下随机观察5 个肾小球,对凋亡细胞进行计数并计算细胞凋亡率。
1.2.7 ERS 途径凋亡蛋白表达的检测
取液氮冷冻的肾脏标本,加入裂解液后匀浆提取组织蛋白,测定蛋白浓度并取30 μg 蛋白进行Western blot 实验。 首先在聚丙烯酰胺凝胶中电泳分离不同分子量的蛋白,而后电转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜。 室温下用5%脱脂牛奶封闭PVDF 膜1 h,4 ℃条件下用1 ∶1 000 稀释的CHOP、caspase-12、caspase-3 一 抗 或1 ∶4 000 稀 释 的βactin 一抗孵育PVDF 膜过夜,次日室温下用1 ∶5 000稀释的二抗孵育PVDF 膜1 h, 最后在凝胶成像系统内显影的蛋白条带,用ImageJ 软件扫描蛋白条带的光密值,以β-actin 为内参,计算CHOP、caspase-12、caspase-3 的表达水平。
1.3 统计学方法
采用SPSS 21.0 软件录入数据。 实验数据均为计量资料,经正态性检验后符合正态分布,以均数± 标准差表示,多组间比较采用方差分析,有统计学差异后进一步采用LSD-t 检验进行两两比较。 P<0.05 为差异有统计学意义。
2 结果
2.1 4 组CBS-WT 小鼠与4 组CBS-KO 小鼠血清Hcy 含量的比较
4 组CBS-WT 小鼠中, 高蛋氨酸饮食CBS-WT组、高蛋氨酸饮食CBS-WT+HSPN 组血清Hcy 含量高 于 常 规 饮 食CBS-WT 组 (t = 5.878、6.977,P <0.05)、 常规饮食CBS-WT + HSPN 组 (t = 6.848、6.502,P<0.05)。
4 组CBS-KO 小鼠中, 高蛋氨酸饮食CBS-KO组、高蛋氨酸饮食CBS-KO+HSPN 组血清Hcy 含量高于常规饮食CBS-KO 组 (t = 14.596、13.105,P <0.05)、 常规饮食CBS-KO + HSPN 组 (t = 14.056、12.691,P<0.05)。
CBS-WT 小鼠与CBS-KO 小鼠比较, 高蛋氨酸饮食CBS-KO 组小鼠的血清Hcy 含量高于高蛋氨酸饮食CBS-WT 组(t = 10.595,P < 0.05),高蛋氨酸饮食CBS-KO+HSPN 组小鼠的血清Hcy 含量高于高蛋氨酸饮食CBS-WT+HSPN 组(t=9.008,P<0.05)。见图1。
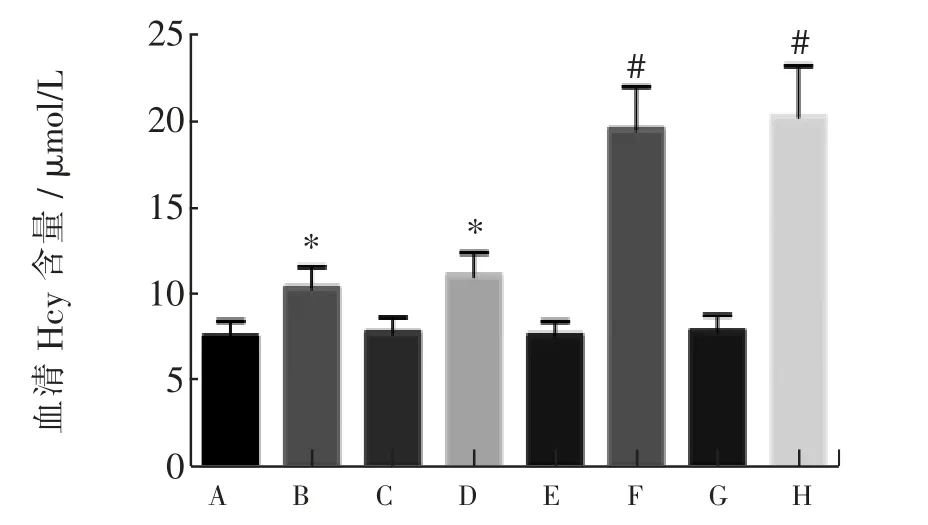
图1 4 组CBS-WT 小鼠及4 组CBS-KO 小鼠血清Hcy 含量比较的柱状图Fig.1 Histograms of serum Hcy content comparison in 4 groups of CBS-WT mice and 4 groups of CBS-KO mice
2.2 4 组CBS-WT 小鼠肾脏病理改变及肾功能指标的比较
常规饮食CBS-WT 组、 高蛋氨酸饮食CBS-WT组小鼠肾小球结构清晰、基底膜形态正常,未出现病理改变;常规饮食CBS-WT+HSPN 组、高蛋氨酸饮食CBS-WT+HSPN 组小鼠均出现肾小球肿胀、基底膜增厚的病理改变, 且两组间病理改变的程度相当。见图2。
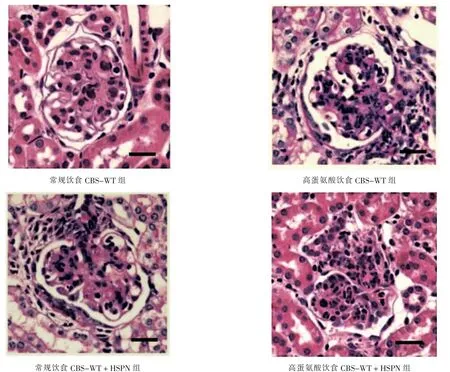
图2 4 组CBS-WT 小鼠肾脏病理改变的比较(HE 染色,×400)Fig.2 Comparison of kidney pathological change images in 4 groups of CBS-WT mice(HE staining, ×400)
与常规饮食CBS-WT 组比较, 高蛋氨酸饮食CBS-WT 组小鼠SCr、BUN、24 h 尿蛋白差异无统计学意义(t=0.772、0.660、0.230,P>0.05), 常规饮食CBS-WT+HSPN 组小鼠SCr、BUN、24 h 尿蛋白明显增加(t=3.726、5.208、8.608,P<0.05); 与常规饮食CBS-WT+HSPN 组比较, 高蛋氨酸饮食CBS-WT+HSPN 组小鼠SCr、BUN、24 h 尿蛋白差异无统计学意义(t=0.621、0.738、0.637,P>0.05)。 表1。
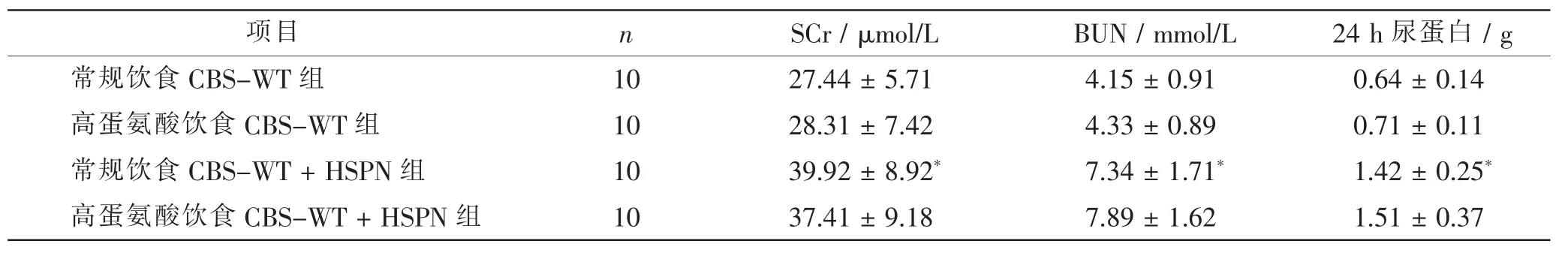
表1 4 组CBS-WT 小鼠肾功能指标的比较Tab.1 Comparison of kidney function indexes in 4 groups of CBS-WT mice
2.3 4 组CBS-KO 小鼠肾脏病理改变及肾功能指标的比较
常规饮食CBS-KO 组小鼠肾小球结构清晰、基底膜形态正常,未出现病理改变;高蛋氨酸饮食CBSKO 组、常规饮食CBS-KO+HSPN 组、高蛋氨酸饮食CBS-KO+HSPN 组小鼠均出现肾小球肿胀、 基底膜增厚的病理改变, 且高蛋氨酸饮食CBS-KO+HSPN组病理改变较高蛋氨酸饮食CBS-KO 组、 常规饮食CBS-KO+HSPN 组加重。 见图3。
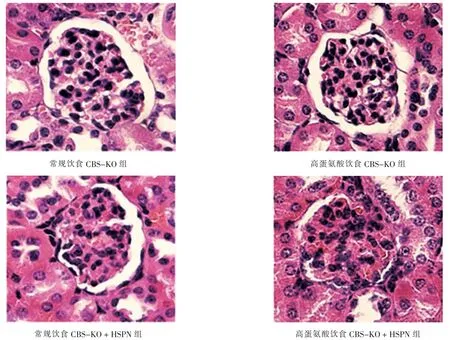
图3 4 组CBS-KO 小鼠肾脏病理改变的比较(HE 染色,×400)Fig.3 Comparison of kidney pathological change images in 4 groups of CBS-KO mice(HE staining, ×400)
与常规饮食CBS-KO 组比较, 高蛋氨酸饮食CBS-KO 组、常规饮食CBS-KO+HSPN 组小鼠SCr、BUN、24 h 尿蛋白明显增加 (t=2.912、6.071、8.581、3.484、4.741、7.135,P<0.05);与常规饮食CBS-KO+HSPN 组比较, 高蛋氨酸饮食CBS-KO+HSPN 组小鼠SCr、BUN、24 h 尿蛋白明显增加(t=4.687、3.408、 6.843,P<0.05)。 见表2。
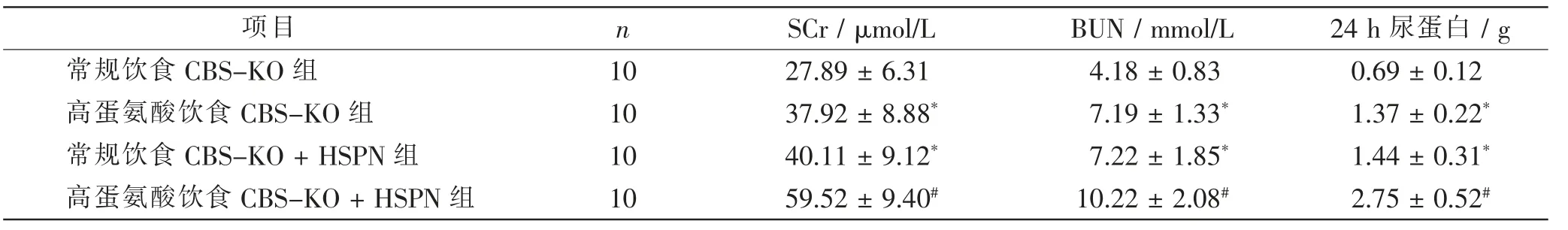
表2 4 组CBS-KO 小鼠肾功能指标的比较Tab.2 Comparison of kidney function indexes in 4 groups of CBS-KO mice
2.4 4 组CBS-KO 小鼠肾小球内细胞凋亡率的比较
与常规饮食CBS-KO 组比较, 高蛋氨酸饮食CBS-KO 组、 常规饮食CBS-KO+HSPN 组小鼠肾小球内细胞凋亡率明显增加(7.69%±1.42%、8.11%±1.63 % vs 1.85 % ± 0.32 %)(t = 12.687、11.917,P <0.05);与常规饮食CBS-KO+HSPN 组比较,高蛋氨酸饮食CBS-KO + HSPN 组小鼠肾小球内细胞凋亡率明显增加 (20.19%±5.58%vs 8.11%±1.63 (t=6.582,P<0.05)。 见图4。
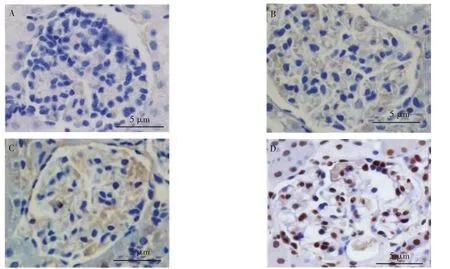
图4 4 组CBS-KO 小鼠肾小球内细胞凋亡率的TUNEL 染色Fig.4 Images of TUNEL staining of glomerular apoptosis rate in 4 groups of CBS-KO mice
2.5 4 组CBS-KO 小鼠肾脏内ESR 途径蛋白基因表达的比较
与常规饮食CBS-KO 组比较, 高蛋氨酸饮食CBS-KO 组、 常规饮食CBS-KO+HSPN 组小鼠肾脏内CHOP、caspase-12、caspase-3 的表达水平明显增加 (t = 7.423、6.230、9.325、7.957、7.018、10.704,P <0.05);与常规饮食CBS-KO+HSPN 组比较,高蛋氨酸饮食CBS-KO + HSPN 组小鼠肾脏内CHOP、caspase-12、caspase-3 的表达水平明显增加 (t=9.527、7.070、7.011,P<0.05)。 见表3、图5。

图5 4 组CBS-KO 小鼠肾脏内CHOP、caspase-12、caspase-3表达的电泳图Fig.5 Electrophoresis of CHOP, caspase-12 and caspase-3 expression of kidney in 4 groups of CBS-KO mice
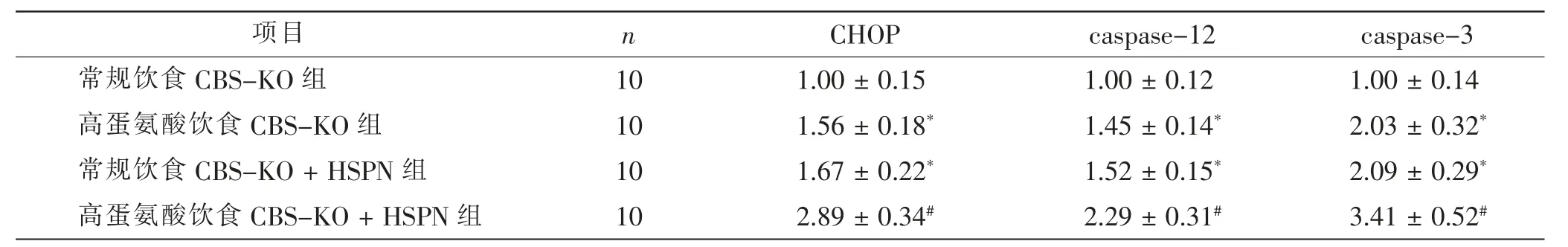
表3 4 组CBS-KO 小鼠肾脏内CHOP、caspase-12、caspase-3 表达水平的比较Tab.3 Comparison of CHOP,caspase-12 and caspase-3 expression levels of kidney in 4 groups of CBS-KO mice
2.6 ERS 拮抗剂及激动剂对高蛋氨酸饮食CBSKO 小鼠肾脏内ESR 途径凋亡蛋白表达影响
与高蛋氨酸饮食CBS-KO+HSPN+ 溶剂对照组比较, 高蛋氨酸饮食CBS-KO+HSPN+ERS 拮抗剂组肾脏内CHOP、caspase-12、caspase-3 的表达水平明显降低(t=12.414、14.110、7.481,P<0.05),高蛋氨酸饮食CBS-KO + HSPN + ERS 激动剂组肾脏内CHOP、caspase-12、caspase-3 的表达水平明显增加(t=11.353、12.091、11.884,P<0.05)。 见表4、图6。

图6 ERS 拮抗剂及激动剂对高蛋氨酸饮食CBS-KO 小鼠肾脏内CHOP、caspase-12、caspase-3 表达影响的电泳图Fig.6 Electrophoresis of the effects of ERS antagonists and agonists on the expression of CHOP,caspase-12 and caspase-3 of kidney in high methionine diet CBS-KO mice
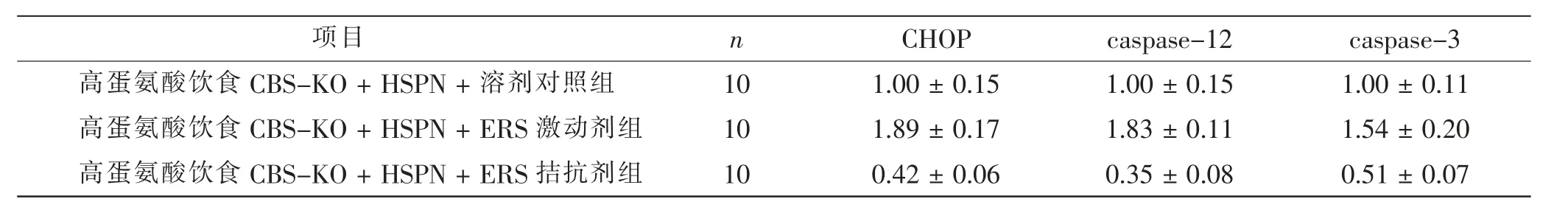
表4 ERS 拮抗剂及激动剂对高蛋氨酸饮食CBS-KO 小鼠肾脏内CHOP、caspase-12、caspase-3 表达的影响Tab.4 Comparison of ERS antagonists and agonists effects on expression of CHOP, caspase-12 and caspase-3 of kidney in high methionine diet CBS-KO mice
2.7 ERS 拮抗剂及激动剂对高蛋氨酸饮食CBSKO 小鼠肾脏病理改变及肾功能指标的影响
与高蛋氨酸饮食CBS-KO+HSPN+ 溶剂对照组比较, 高蛋氨酸饮食CBS-KO+HSPN+ERS 拮抗剂组肾脏病理改变减轻,SCr、BUN、24 h 尿蛋白明显降低(t=2.298、4.970、3.900,P<0.05); 高蛋氨酸饮食CBS-KO + HSPN + ERS 激动剂组肾脏病理改变加重,SCr、BUN、24 h 尿蛋白明显增加(t=4.258、3.163、5.186,P<0.05)。 见表5、图7。
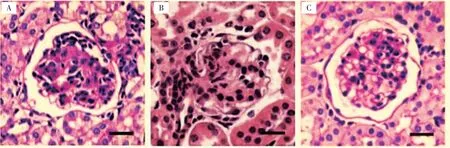
图7 ERS 拮抗剂及激动剂对高蛋氨酸饮食CBS-KO 小鼠肾脏病理改变的病理图Fig.7 Pathological kidney change images of ERS antagonists and agonists in high methionine diet CBS-KO mice
表5 ERS 拮抗剂及激动剂对高蛋氨酸饮食CBS-KO 小鼠肾功能指标的影响比较Tab.5 Comparison of ERS antagonists and agonists effects on kidney function indexes in high methionine diet CBS-KO mice
2.8 ERS 拮抗剂及激动剂对高蛋氨酸饮食CBSKO 小鼠肾小球细胞凋亡的影响
与高蛋氨酸饮食CBS-KO+HSPN+ 溶剂对照组比较, 高蛋氨酸饮食CBS-KO+HSPN+ERS 拮抗剂组肾小球细胞凋亡率明显降低 (8.38%±1.58%vs 18.83%±4.38%)(t=4.145,P<0.05), 高蛋氨酸饮食CBS-KO+HSPN+ERS 激动剂组肾小球细胞凋亡率明显增加(29.30%±6.68%vs 18.83%±4.38%)(t=7.097,P<0.05)。 见图8。
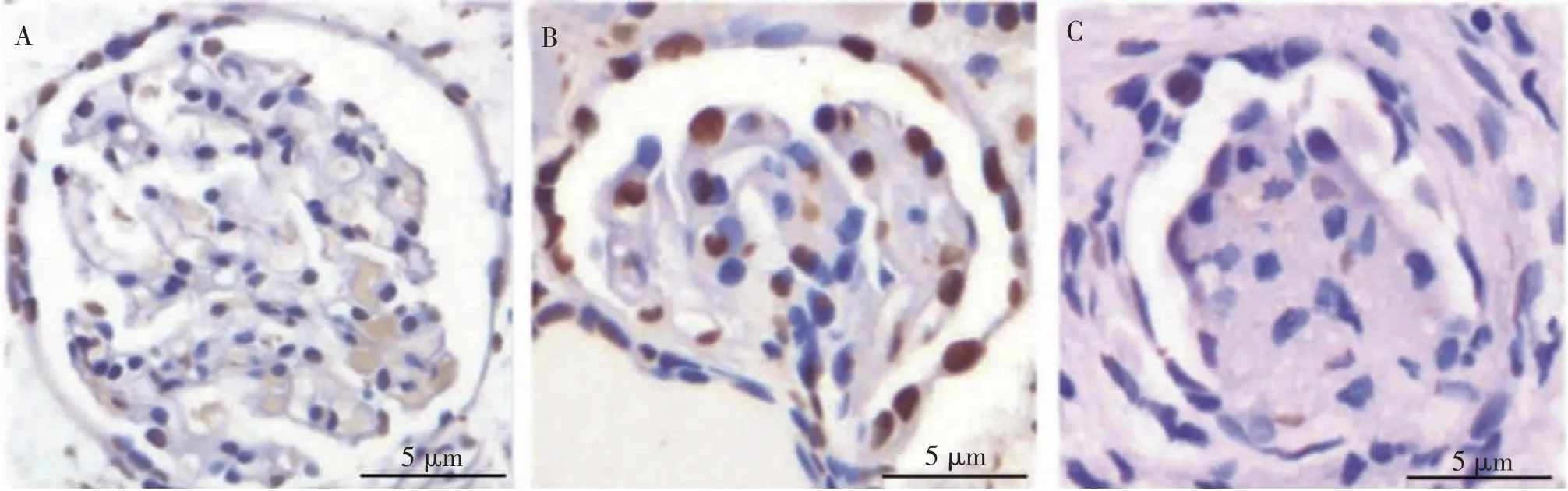
图8 ERS 拮抗剂及激动剂对高蛋氨酸饮食CBS-KO 小鼠肾小球细胞凋亡病理图Fig.8 Pathological images of ERS antagonists and agonists effects on apoptosis of glomerular cells in high methionine diet CBS-KO mice
3 讨论
Hcy 是蛋氨酸代谢的中间产物,异常升高的Hcy通过激活炎症反应、 细胞凋亡、ERS 等参与心脑血管疾病发病过程中内皮损伤[7,8]、肾脏疾病发病过程中肾小球损伤[3,9,10]。 HSPN 是HSP 发病过程中免疫复合物在肾脏内沉积引起的并发症,发病机制复杂,有研究证实HSPN 患儿血清中Hcy 含量明显升高[6],提示HHcy 可能参与HSPN 的发病。基于此,笔者研究将通过动物实验分析HHcy 在HSPN 发病中的作用,进而为发现HSPN 的防治靶点提供实验依据。
CBS 是蛋氨酸代谢的限速酶, 敲除CBS 后蛋氨酸代谢发生障碍、给予高蛋氨酸饮食可引起HHcy[11]。笔者研究给予CBS-WT 小鼠和CBS-KO 小鼠高蛋氨酸饮食后均出现血清Hcy 升高, 且CBS-KO 小鼠接受高蛋氨酸饮食后Hcy 的升高较CBS-WT 小鼠更为显著。 CBS-WT 小鼠接受高蛋氨酸饮食后Hcy 轻度升高,但肾功能指标正常、肾脏内未出现病理改变,可能原因是轻度的血清Hcy 升高不会造成肾损害,与既往吴凯等[5]及Pushpakumar S 等[12]在CBS-WT 小鼠高蛋氨酸饮食后的实验结果吻合。CBS-WT 小鼠进行HPSN 造模后出现了肾小球肿胀、基底膜增厚等典型的病理改变;HSPN 造模过程中给予高蛋氨酸饮食,血清Hcy 含量轻度升高,但肾脏病理改变并未加重,表明高蛋氨酸饮食引起CBS-WT 小鼠血清Hcy 轻度升高并不会加重HSPN 的病理改变。在CBS-KO 小鼠中, 高蛋氨酸饮食后Hcy 显著升高且肾功能发生损害、 肾脏出现病理改变;HSPN 造模过程中给予高蛋氨酸饮食,血清Hcy 含量显著升高且肾功能损害、肾脏病理改变加重, 表明在CBS-KO 小鼠中HHcy 使HSPN 加重。 因此,笔者将继续在CBS-KO 小鼠中研究HHcy 加重HSPN 的原因分析。
HHcy 引起组织损伤的原因与激活炎症反应、细胞凋亡、ERS 有关,其中ERS 是一种病理刺激下未折叠或错误折叠蛋白在内质网聚集引发的未折叠蛋白反应,通过下游CHOP/caspase-12 途径能够引起细胞凋亡[13~15]。 吴凯等[5]研究证实,HHcy 引起小鼠肾损伤的作用与激活ERS 介导的细胞凋亡有关。 笔者研究在CBS-KO 小鼠接受高蛋氨酸饮食出现HHcy 后观察到肾小球内细胞凋亡率增加, 且ERS 凋亡途径中CHOP、caspase-12、caspase-3 表达也明显增加, 与吴凯的研究结果一致。在CBS-KO 小鼠进行HSPN 造模后, 肾小球内细胞凋亡率及ERS 途径凋亡蛋白的表达均增加, 表明ERS 途径介导的细胞凋亡与HSPN发病有关;在CBS-KO 小鼠HSPN 造模过程中给予高蛋氨酸饮食、 引起HHcy 后, 肾小球细胞凋亡率及ERS 途径凋亡蛋白的表达均较接受常规饮食的HSPN CBS-KO 小鼠增加, 表明HHcy 可能通过激活ERS 介导的细胞凋亡引起或加重HSPN。
最后,为了明确ERS 在HHcy 引起或加重HSPN中的作用, 笔者研究使用ERS 激动剂和拮抗剂进行了实验。在CBS-KO 小鼠HSPN 造模过程中同时给予高蛋氨酸饮食及ERS 激动剂或拮抗剂, 在HHcy 起到加重HSPN 肾功能损害、肾脏病理改变及肾小球细胞凋亡的作用中,ERS 激动剂能够使这一作用加剧,ERS 拮抗剂能够使这一作用减弱, 表明HHcy 加重HSPN 的作用与激活ERS 介导的细胞凋亡有关。
综上所述,HHcy 引起CBS-KO 的HSPN 小鼠肾脏病理改变、 肾功能损害及肾小球细胞凋亡加剧,激活ERS 是与HHcy 加重HSPN 相关的分子机制。 未来,HHcy 有望成为研究HSPN 发病机制及防治表达的新发现, 纠正HHcy 可能起到防治HSPN 的作用,但这仍需未来更多的研究来证实。
