培补清利方对多囊卵巢综合征伴胰岛素抵抗大鼠肠道菌群作用的观察
2023-03-26周娟,王杨,严骅
周 娟,王 杨,严 骅
上海中医药大学附属曙光医院生殖医学中心(上海 200120)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)起病于青春期,对5%~15%育龄期女性产生影响[1]。在 PCOS病理过程中,胰岛素抵抗(insulin resistance,IR)的易感性显著增加[2]。肠道菌群是指居住在胃肠道的复杂细菌群落,其与人类宿主共同进化形成一种共生关系且相互作用,在不同程度上影响人体的健康[3]。现代医学研究[4]表明,肠道中的许多微生物参与了人体内营养物质的消化与吸收,若肠道内的菌群结构失衡,则会出现腹泻、腹痛、肠鸣、便秘等胃肠道功能紊乱症状,这与中医所说的“脾虚证”症状相似。同时肠道菌群平衡与中医“正气”密切相关。肠道中微生态保持平衡,则“正气存内,邪不可干”;若正气不足,则肠道微生态与免疫功能容易失衡[5]。
近年来,以肠道菌群为靶点寻找治疗代谢性疾病的中药复方已成为新的热点研究话题。本实验采用来曲唑联合高脂饲料建立多囊卵巢综合征伴胰岛素抵抗(polycystic ovary syndrome and insulin resistance,PCOSIR)大鼠模型,观察经培补清利方干预后肠道菌群变化等相关指标,进而以肠道菌群为靶点寻找改善PCOS-IR各项指标的中药复方,旨在从肠道菌群调节的角度为PCOS-IR的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级SD大鼠26只,雌性,3周龄,体质量60~70 g,购于上海维通利华实验动物有限责任公司。动物生产许可证号:SCXK(沪)2017-0011。实验大鼠饲养于上海中医药大学实验动物中心SPF级动物室,分笼饲养,22 ℃恒温条件,相对湿度(55±5)%,光照周期12 h光照、12 h黑暗。动物使用许可证号:SCXK201036。本实验经上海中医药大学实验动物伦理委员会批准(伦理批准号:PZSFUTCM9060901)。
1.1.2 药物与试剂 培补清利方(黄芪20 g、熟地黄12 g、蒲黄10 g、丹参15 g、黄连9 g、香附12 g、半夏9 g、茯苓12 g、陈皮9 g、甘草6 g)购于上海中医药大学附属曙光医院。根据人与实验动物用药剂量换算[6],浓缩至生药量为2.1 g/mL培补清利方中药药液,保存待用。
来曲唑,江苏恒瑞医药股份有限公司(批号:15011956);羧甲基纤维素钠(CMC),河南润发生物科技有限公司(批号:GB276031);罗氏血糖仪及血糖试纸,美国Roche公司(批号:20182400044);革兰氏染色液,杭州西素生物科技有限公司(批号:20214206);大鼠胰岛素ELISA试剂盒,上海司鼎生物科技有限公司(批号:20210034);粪便基因组DNA提取试剂盒,美国MP Biomedicals公司(批号:116560200)。
高脂饲料供能比:蛋白20%,碳水化合物20%,脂肪45%,其他15%;由深圳睿迪生物科技公司提供(D12451)。
普通饲料供能比:蛋白20%,碳水化合物70%,脂肪10%;由上海中医药大学实验动物中心提供。
1.1.3 仪器 电子天平,赛多利斯科学仪器有限公司(型号:YG21032);光学显微镜,南京光电股份有限公司(型号:DM6000);全自动生化分析仪,上海济生医疗器械有限公司(型号:IN-53090);PCR 仪,美国Bio-Rad 公司(型号:YMA-2000);高速离心机,美国Thermo Fisher公司(型号:SIGMA3-18K);基因测序仪(MiSeq),美国Illumina公司。
1.2 分组与造模 参考文献[7]方法,将大鼠随机分为对照组(8只)和模型组(18只)。模型组予高脂饲料喂养3周,对照组予普通饲料喂养3周。第6周龄时,模型组大鼠持续予高脂喂养,并每日按照1 mg/kg标准灌胃来曲唑-CMC混悬液。对照组每日予CMC 1 mg·kg-1·d-1,并以普通饲料喂养。两组均连续灌胃13周。以模型组大鼠体质量高于对照组大鼠体质量平均值20%以上、稳态模型胰岛素抵抗指数(HOMA-IR)低于对照组大鼠HOMA-IR平均值基准线20%以上、大鼠的动情周期处于持续的无排卵状态为造模成功。造模结束后,将造模成功的15只大鼠按照体质量采用完全随机法分为模型组(7只)和治疗组(8只)。
1.3 干预 对照组:上午予以1 mg/kg的蒸馏水灌胃,下午予以0.025 mL·g-1·d-1的蒸馏水灌胃。模型组:上午予以1 mg/kg标准来曲唑-CMC混悬液灌胃,下午予以0.025 mL·g-1·d-1的蒸馏水灌胃。治疗组:上午予以1 mg/kg标准来曲唑-CMC混悬液灌胃,下午予以0.025 mL·g-1·d-1的培补清利方浓缩药液灌胃。每3 d称量1次体质量,根据体质量变化进行药物剂量调整。总疗程为42 d。
1.4 检测指标与方法
1.4.1 大鼠体质量 每周称量大鼠体质量,绘制体质量曲线图,对比大鼠体质量的变化情况。
1.4.2 卵巢组织学形态 干预结束后,禁食12 h,取大鼠双侧卵巢组织,称取卵巢质量,测量卵巢直径。将卵巢放入4%多聚甲醛固定待HE染色制片,镜下观察卵巢形态学变化,并统计黄体和囊性卵泡数量。
1.4.3 口服葡萄糖耐量试验(OGTT) 干预结束后,在空腹状态下行大鼠OGTT,分别在0 min(空腹血糖,FBG)、30 min(餐后30 min血糖,PBG 30′)、60 min(餐后60 min血糖,PBG 60′)、90 min(餐后90 min血糖,PBG 90′)、120 min(餐后120 min血糖,PBG 120′)时测定血糖值。
1.4.4 血清空腹胰岛素水平及胰岛素抵抗指数 干预结束后,禁食12 h,采集大鼠腹主动脉血,静置离心,于-20 ℃保存。采用酶联免疫吸附试验(ELISA)试剂盒检测大鼠血清空腹胰岛素(FINS)水平,观察各组大鼠血清FINS变化。具体按说明书操作。计算胰岛素抵抗指数。HOMA-IR=(FBG×FINS)/22.5。
1.4.5 肠道菌群检测 干预结束后,待取材的前1日清晨采集大鼠粪便,放至无菌EP管内并置于-80 ℃低温冰箱保存,便于后期16S rRNA检测(图1)。通过PICRUSt2软件预测分析肠道微生物的代谢功能,并利用京都基因和基因组百科全书(KEGG)数据库对肠道微生物的功能进行分析。

图1 16S rRNA分析步骤
1.5 统计学方法 实验数据采用SPSS 21.0 统计软件进行分析。所有计量资料用±s表示,组间差异比较采用单因素方差分析;两两比较,方差齐时采用LSD检验,方差不齐时采用秩和检验。血糖OGTT试验采用重复测量资料方差分析。使用QIIME软件进行微生物相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 对大鼠体质量的影响 与对照组比较,模型组大鼠与治疗组大鼠体质量差异有统计学意义(P<0.05)。与模型组比较,治疗组大鼠体质量差异无统计学意义(P>0.05)。见图2。

图2 大鼠体质量折线图
2.2 对大鼠卵巢组织形态学的影响 镜下可见对照组大鼠卵巢内部构造清晰、结构完整,大部分卵泡的卵泡壁上包裹着多层结构完好的颗粒细胞。模型组大鼠卵巢呈病理性变化,出现多个囊性扩张卵泡,大小不等。与模型组相比,治疗组大鼠卵巢组织内囊性卵泡数目减少(P<0.05),黄体数量出现增加趋向但差异不显著(P>0.05)。各组大鼠卵巢质量差异有统计学意义(P<0.05)。与对照组比较,模型组大鼠卵巢直径增加(P<0.05)。见图3、图4。

图3 卵巢组织形态学分析(HE染色,×10)

图4 各组卵巢囊性卵泡、黄体、卵巢质量及直径比较
2.3 对大鼠血糖OGTT的影响 各组FBG差异无统计学意义(P>0.05)。PBG 30′时,与对照组比较,模型组、治疗组大鼠血糖降低(P<0.05)。PBG 90′时,与对照组比较,模型组、治疗组血糖升高(P<0.05)。PBG 120′时,治疗组大鼠血糖值与对照组接近,低于模型组(P<0.05)。见表1。
表1 各组大鼠OGTT结果比较(n=6,±s,mmol·L-1)
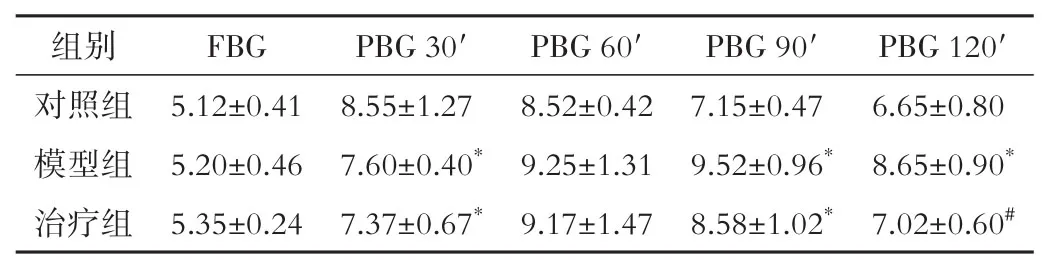
表1 各组大鼠OGTT结果比较(n=6,±s,mmol·L-1)
注:OGTT为口服葡萄糖耐量试验,FBG为空腹血糖,PBG为餐后血糖。与对照组比较,*P<0.05;与模型组比较,#P<0.05。
PBG 120′6.65±0.80 8.65±0.90*7.02±0.60#组别对照组模型组治疗组FBG 5.12±0.41 5.20±0.46 5.35±0.24 PBG 30′8.55±1.27 7.60±0.40*7.37±0.67*PBG 60′8.52±0.42 9.25±1.31 9.17±1.47 PBG 90′7.15±0.47 9.52±0.96*8.58±1.02*
2.4 对大鼠血清FINS、HOMA-IR的影响 与对照组比较,模型组FINS、HOMA-IR水平增加(P<0.05)。与模型组比较,治疗组大鼠 FINS、HOMA-IR水平下降(P<0.05)。见图5。
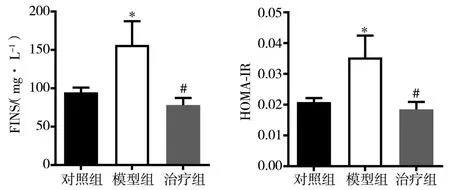
图5 各组大鼠FINS、HOMA⁃IR 比较
2.5 对肠道菌群多样性指数的影响 对肠道细菌群落进行整体分析的结果显示,3组大鼠肠道微生物区系差异显著。通过在OTUs=0.03情况下得到chao指数、shannon指数来评估各组大鼠肠道微生物区系的丰富度、多样性。发现与对照组相比,模型组与治疗组(PCOS-IR大鼠)chao指数、shannon指数均下降(P<0.05),肠道微生物多样性明显减少。与模型组相比,经中药干预后的大鼠chao指数上升(P<0.05),肠道微生物丰度增加。见图6。

图6 肠道菌群多样性指数分析
2.6 对肠道菌群门水平的影响 各组大鼠肠道中的厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)相对丰度所占比例最高。与对照组相比,模型组大鼠肠道中厚壁菌门/拟杆菌门(Firmicutes/Bacteroidetes,F/B)比值发生改变,F/B比值升高(P<0.05),而经过干预后的大鼠逆转了这一改变,F/B比值下降(P<0.05)。见图7、图8。
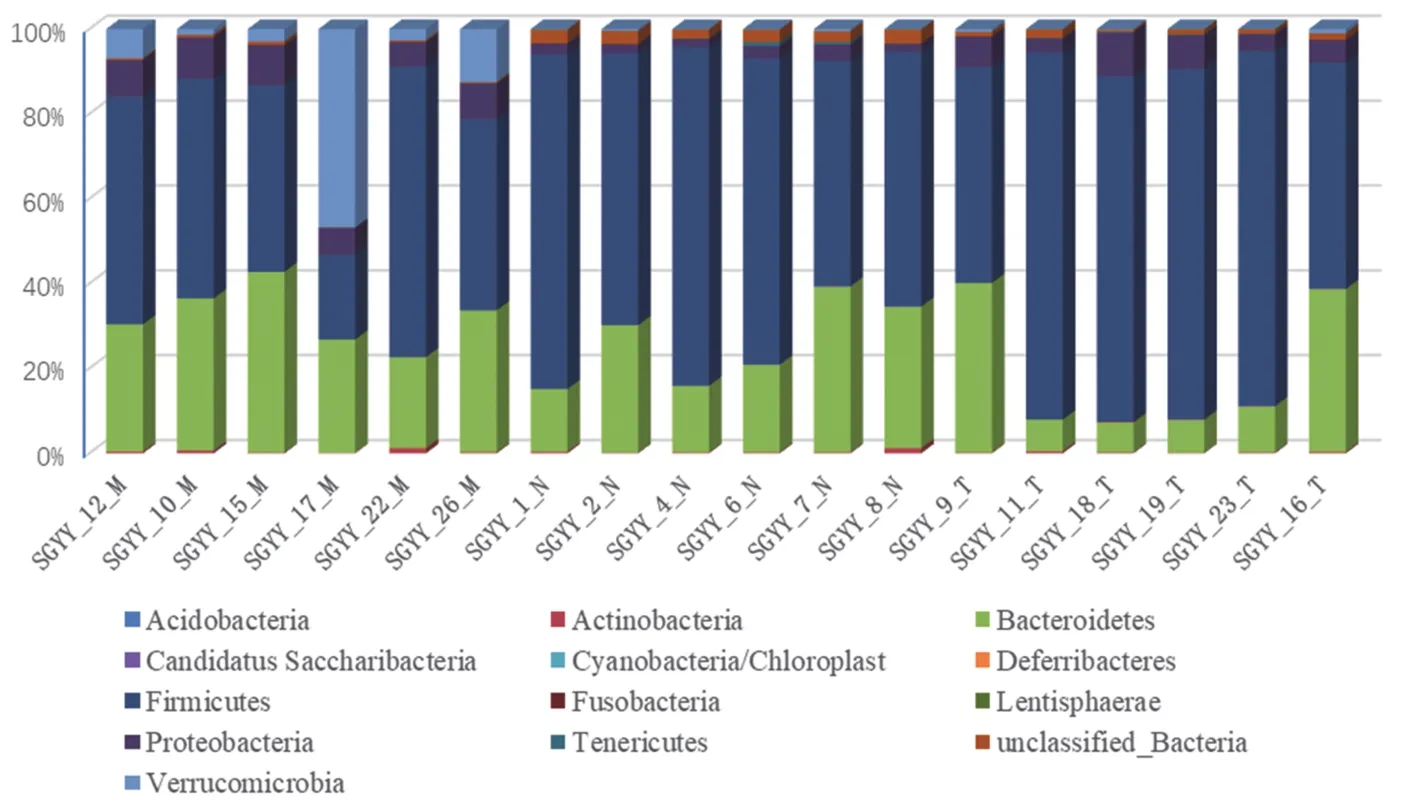
图7 门(phylum)水平的物种分类分析

图8 各组大鼠F/B比值比较
2.7 对肠道菌群属水平的影响 与对照组相比,模型组大鼠肠道中拟杆菌属(Bacteroides)、梭状芽孢杆菌属XⅧ(Clostridium XⅧ)、副拟杆菌(Parabacteroides)、霍尔德曼氏菌属(Holdemania)、嗜胆菌属(Bilophila)、螺杆菌(Helicobacter)等菌属的相对丰度显著增加(P<0.05),而普雷沃氏菌属(Paraprevotella)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)、乳酸菌属(Lactobacillus)等的相对丰度显著降低(P<0.05);而与模型组相比,治疗组大鼠肠道中的Roseburia、Ruminococcus等的相对丰度增加(P<0.05),而Bacteroides、Clostridium XⅧ、毛螺旋菌属(Lachnospira)、丁酸球菌属(Butyricicoccus)、考拉杆菌属(Phascolarctobacterium)、脱硫弧菌属(Desulfovibrio)等的相对丰度降低(P<0.05)。见图9。

图9 肠道菌群属(Genus)水平的差异分析
2.8 PICRUSt2预测结果 通过对比富集显著的前50条KEGG通路发现,对照组与模型组之间共有18条通路存在富集差异(P<0.05),提示PCOS-IR大鼠肠道微生物异常与氨基糖代谢、柠檬酸循环、脂质代谢以及戊糖磷酸途径等相关。治疗组与模型组之间共有17条通路存在富集差异(P<0.05),经培补清利方干预后,大鼠的脂肪酸生物合成、柠檬酸循环、糖酵解等基因丰度下调。见图10。

图10 肠道微生物基因预测功能结果
3 讨论
中医治疗PCOS-IR以补肾、健脾、清肝为主,佐以燥湿除痰、活血化瘀调经等,具有多靶点、多环节、多途径、副作用小等优势[7]。培补清利方为《叶氏女科》中的苍附导痰方化裁加减,其中的黄芪补气养血;熟地黄入肝肾二经,既善补血滋阴,又能补精益髓;黄连清热燥湿;蒲黄、丹参意在活血,使祛瘀活血而不伤正;陈皮、半夏健脾助运、燥湿化痰,调后天以资先天;香附疏通经络、化解六郁,与补肾之品相配伍,使得补而不滞;甘草调和诸药。诸药合用,意在补肾健脾、化痰燥湿的同时活血通经。本研究中治疗组大鼠卵巢组织明显改善,囊性卵泡数目明显减少,且卵巢质量明显减轻,提示培补清利方可修复PCOS-IR大鼠卵巢组织的病理改变,主要表现在卵巢组织结构、形态、质量的改善。在PBG 120′后治疗组大鼠血糖值与对照组接近,提示培补清利方可以使PCOS-IR大鼠的糖代谢异常表现得以改善。经培补清利方干预后的大鼠HOMA-IR、FINS水平下降,表明培补清利方能改善IR及PCOS相关表型。
近年来,肠道菌群作为一种新的生物学标志物在宿主新陈代谢中发挥至关重要的作用。肠道细菌如乳酸菌、罗伊氏乳杆菌通常被称为有益菌,它们在防止致病性有害菌(肠球菌、螺门杆菌、变形杆菌)通过肠黏膜物理屏障进入全身循环进而危害机体中起着重要作用[8-10]。在PCOS疾病发生发展中以牺牲有益菌为代价而使有害菌的数量选择性增加[11]。缺乏适当的菌群营养会使肠道相关菌群种类发生变化,导致内环境稳态的改变[12],进而对宿主产生有害影响。众所周知,PCOS-IR与肠道菌群关系密切,PCOS-IR患者体内肠道微生物的结构明显不同于正常女性[13-15]。有研究[16]表明,F/B比值与肥胖及炎症因子呈正相关,F/B比值下降可能利于炎症的改善。物种丰度和多样性的变化可能导致PCOS肠道功能发生改变[17]。本研究发现,与对照组相比,模型组(PCOS-IR)大鼠肠道微生物区系差异显著,在门水平上厚壁菌门、拟杆菌门数量发生改变,F/B比值升高。通过对肠道微生物群落的丰度和多样性分析,发现经来曲唑诱导的PCOS-IR大鼠肠道微生物群落的总体丰度和多样性明显减少,而通过补充培补清利方可以改善这些变化,使肠道微生物丰度增加,F/B比值下降。本研究发现,PCOS-IR大鼠Bacteroides、Clostridium XⅧ、Bilophila等一些易引起炎症、机会性感染的条件致病菌[18]的产量显著增加,Roseburia、Lactobacillus、Butyricicoccus等一些增加黏蛋白、使肠上皮细胞免受炎症损伤的保护性细菌[19]产量减少。上述提示肠道微生物失调与PCOS-IR关系密切,在PCOS-IR疾病发生过程中条件致病菌的数量增加,保护性细菌减少。随着中药复方培补清利方的干预,PCOS-IR大鼠的肠道微生物中Roseburia、Lactobacillus的相对丰度显著增加,而Bacteroides、Lachnospira、Desulfovibrio的相对丰度显著降低,故培补清利方可促成保护性细菌产量增加,削弱机会致病菌的产量,进而维持PCOS-IR大鼠肠道内菌群平衡。
肠道菌群从宿主发酵难消化的膳食成分中获取营养,通过降解食物、分泌物质等产生如短链脂肪酸、色氨酸、胆汁酸等代谢产物,这些代谢产物通过不同途径参与宿主体内细胞的基因表达、增殖、凋亡,在宿主新陈代谢过程中发挥至关重要的作用[20-21]。PCOS-IR与宿主体内肠道微生物的变化及代谢途径的改变密切相关[22]。为了进一步探索培补清利方对PCOS-IR大鼠肠道菌群及代谢的影响,我们利用PICRUSt2预测肠道微生物群落功能。通过对比发现,PCOS-IR大鼠肠道微生物异常与氨基糖代谢、柠檬酸循环、脂质代谢以及戊糖磷酸途径等相关。经培补清利方干预后,大鼠的脂肪酸生物合成、柠檬酸循环、糖酵解基因丰度下调。上述提示培补清利方可减少机会致病菌的数量,增加有益菌,改善异常的菌群结构,改善IR及PCOS表型,其机制可能与介导糖酵解途径及三羧酸循环、降低脂质脂肪酸生物合成相关。
