化滞柔肝颗粒减轻非酒精性脂肪性肝炎相关肝纤维化的机制研究
2023-03-26余思雨朱明哲黄志艳张贵民
余思雨,操 颖,朱明哲,黄志艳,季 光,张贵民,张 莉
1.上海中医药大学附属龙华医院脾胃病研究所(上海 200032);2.上海中医药大学公共健康学院(上海201203);3.中药制药共性技术国家重点实验室(山东 临沂 276006)
肝纤维化是因肝脏受到损伤而产生的一种创伤愈合反应,病理改变以肝星状细胞(HSC)过度活化和细胞外基质进行性积聚及纤维性瘢痕形成为特征[1-2],为临床常见的慢性肝病。既往肝纤维化最主要的病因是病毒感染和饮酒,但随着抗病毒药物的临床普及,近年来与代谢相关的非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)成为了肝纤维化的重要风险因素。肝纤维化是非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)的重要病理表现,NASH合并肝纤维化提示NAFLD肝脏病理进展,若不及时干预,则有可能发展为肝硬化甚至是肝细胞癌。
TP53是抑癌基因,可通过启动肿瘤细胞周期阻滞、凋亡、衰老,进而发挥抗肿瘤作用[3]。TP53基因突变后,其编码的p53蛋白半衰期会延长,稳定性亦会增加,进而在核内不断积累,失去对细胞的监视作用[4]。研究[5-6]表明,p53可影响肾纤维化、心肌纤维化进程,并参与NASH的发生、发展。线粒体p53可与溶质载体家族25成员28(SLC25A28)形成复合物,导致氧化还原活性铁异常积累和电子转移链功能亢进,促进HSC的铁死亡,从而减轻小鼠肝纤维化[7]。研究[8]发现,白介素-10(IL-10)可以促进活化的HSC衰老及衰老HSC中p53的表达,进而减轻CCl4诱导的大鼠纤维化。因此,调控p53蛋白表达可能是治疗NASH相关肝纤维化的有效策略。
中药复方化滞柔肝颗粒(HZRG)由茵陈、决明子、大黄、泽泻、猪苓、山楂、苍术、白术、陈皮、瓜蒌、女贞子、墨旱莲、枸杞子、小蓟、柴胡和甘草等16味中药组成,具有清热利湿、祛浊解毒、祛瘀柔肝的功效,是治疗脂肪性肝病的常用中成药。既往研究[9]表明,HZRG可以显著降低酒精性肝炎小鼠血清转氨酶、肌酸激酶等指标的水平。临床研究[10]发现,HZRG能很好地改善NAFLD患者的临床症状、血脂水平及肝功能指标。前期研究发现,HZRG可以明显减轻饮食诱导的NASH模型小鼠的代谢性炎症,但HZRG对NASH相关肝纤维化的效应和机制尚未明确。因此,我们借助网络药理学研究方法,聚焦HZRG治疗NASH的潜在靶点p53,通过建立蛋氨酸胆碱缺乏(MCD)饮食诱导的NASH相关肝纤维化模型,探讨HZRG对p53的调控作用,以期为HZRG治疗NASH的临床应用提供依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞 人源性HSC细胞系LX2细胞购自美国模式培养物集存库(ATCC),采用含10%胎牛血清(FBS)和1%青霉素⁃链霉素的1640培养基培养。培养环境:37 ℃,95%湿度,5% CO2。细胞实验数据的获得均基于3次实验重复。
1.1.2 动物 6周龄雄性C57BL/6小鼠,SPF级,购于江苏集萃药康生物科技股份有限公司。实验动物生产许可证号:SCXK(苏)2018-0008。动物饲养于无特异性病原体环境中,温度(22±2)℃,湿度(55±15)%,交替12 h光照和黑暗循环。本实验经江苏集萃药康生物科技股份有限公司实验动物伦理委员会批准(批准号:GPTAP20200721-2)。
1.1.3 药物与试剂 HZRG购于山东新时代药业有限公司(批号:8041912029),本实验定义人鼠等效剂量为低剂量,双倍剂量为高剂量。转化生长因子-β1(TGF-β 1),美国PeproTech公司(批号:1221209);Tenovin-6,美国Selleck公司(批号:S4900)。丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)、总胆固醇(TC)、三酰甘油(TG)生化检测试剂盒,南京建成生物有限公司(批号分别为C009-2-1、C010-2-1、A020-2-2、A059-2-2、A111-1-1、A110-1-1)。抗体p53,美国Santa Cruz Biotechnology公司(批号:sc-126);α-平滑肌肌动蛋白(α-SMA),美国Cell Signaling Technology公司(批号:19245);I型胶原蛋白α1链(Col1a1),美国Cell Signaling Technology公司(批号:72026);β-肌动蛋白(β-actin),杭州华安生物技术有限公司(批号:HO0802)。兔二抗,美国Cell Signaling Technology公司(批号:7074S);鼠二抗,美国 Cell Signaling Technology公司(批号:7076S);荧光二抗兔抗、荧光二抗鼠抗,美国Invirtrogen公司(批号分别为A11012、A32723)。肿瘤坏死因子-α(TNF-α)ELISA检测试剂盒,上海酶联生物科技有限公司(批号:m1002095-2)。
1.1.4 主要仪器 Western blot快转仪,金斯瑞生物科技有限公司(型号:L00686);功能酶标仪,美国BioTek公司(型号:SynergyH4);低温高速离心机,德国Eppendorf公司(型号:5804R);切片机、脱水机、包埋机,德国Leica公司(型号分别为RM2235、RM2235、EG1150H+C);高速低温组织研磨仪,武汉塞维尔生物科技有限公司(型号:KZ-Ⅲ-FP);高内涵影像采集系统,美国美谷分子仪器有限公司(型号:ImageXpress & MetaXpress);正置和倒置显微镜,日本Olympas株式会社(型号:50I+FⅡGGP);全自动生化分析仪,日本Toshiba株式会社(型号:TBA-40FR)。RT-qPCR仪,美国ABI公司(型号:7500 StepOne PLUS)。
1.2 网络药理学分析 借助中药系统药理学数据库与分析平台(TCMSP)、中医药综合数据库(TCMID)、化合物靶点预测数据库(Swiss Target Prediction)等及相关文献查找HZRG的化学成分和作用靶点。利用人类基因综合数据库(GeneCards)、药物银行(DrugBank)等对NASH疾病靶点进行筛选,选择Venny 2.1.0平台获取两者的交集靶点。二者靶点取交集后利用Cytoscape软件构建成分-靶点网络,String数据库构建蛋白质相互作用(PPI)网络,拓扑分析获取关键靶点和成分。
1.3 HZRG对NASH相关肝纤维化小鼠的干预作用
1.3.1 造模、分组与干预 参考文献[11]造模方法构建NASH相关肝纤维化小鼠模型。小鼠适应性饲养7 d后,随机分为对照组、模型组、HZRG高剂量组、HZRG低剂量组,每组8只。对照组给予正常饮食,模型组、HZRG高剂量组、HZRG低剂量组给予MCD饮食(A02082002B)。在饮食的基础上,HZRG低、高剂量组同时灌胃给予3 g·kg-1·d-1、6 g·kg-1·d-1的HZRG药液[药物溶解于0.5%羧甲基纤维素钠溶液(CMC-Na)中],对照组、模型组小鼠均灌胃给予等量的0.5% CMC-Na溶液,1次/d(0.1 mL·10 g-1),各组均连续干预4周。
1.3.2 血清生化指标检测 末次给药后,心脏采集全血并分离血清,-80 ℃保存。采用生化分析仪检测各组小鼠血清ALT、AST、LDH、ALP水平,ELISA试剂盒检测血清TNF-α水平。
1.3.3 肝组织病理 采血后,收集各组小鼠的肝脏,称重、拍照后将肝脏中叶分为3份,其中1份用10%福尔马林中性液固定,切片行HE染色、天狼猩红染色和Masson染色、免疫组化;2份液氮速冻后-80 ℃保存备用,用于组织蛋白、RNA的提取及肝组织TC、TG的测定。
小鼠肝脏组织固定1周,脱水后石蜡包埋,病理切片机切取5 μm厚度的石蜡切片,HE染色观察肝组织病理变化,并由2位病理专家独立阅片和评价肝组织脂肪变、炎症和气球样变情况,根据参考文献[12]中的有关标准行NAFLD活动度评分(NAS,包括肝脂肪变评分、小叶内炎症评分、肝细胞气球样变评分3个部分);天狼猩红和Masson染色观察肝脏胶原沉积情况;免疫组化观察肝组织中α-SMA和Col1a1的表达,并用ImageJ软件分析阳性表达面积。
1.3.4 试剂盒检测肝组织TC、TG水平 取适量肝组织,乙醇匀浆后取上清液,试剂盒检测肝组织TC、TG水平。
1.3.5 Western blot法检测肝组织相关蛋白表达 取适量肝组织在RIPA裂解液中匀浆,低温离心(12 000 g,离心半径为90 mm,4 ℃,15 min)后收集上清液。蛋白质定量(BCA)法测定蛋白浓度。用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转聚偏二氟乙烯(PVDF)膜,室温封闭30 min,一抗4 ℃孵育过夜,二抗在室温下孵育60 min。膜表面滴加增强型化学发光试剂(ECL),置于化学发光成像系统显色。采用ImageJ软件分析蛋白条带灰度值,计算相关蛋白相对于内参蛋白(β-actin)的表达量。
1.3.6 RT-qPCR法检测肝组织相关基因表达 取约20 mg肝组织置于研钵内,加入1 mL TRIzol提取总RNA,加入逆转录试剂进行逆转录制备cDNA。以β⁃actin为内参,进行荧光定量PCR扩增以检测各组肝脏组织或LX2细胞中相关基因的表达水平。反应条件:95 ℃预变性15 min,95 ℃变性5 s,60 ℃退火30 s;40个循环。扩增引物由上海闪晶生物科技有限公司合成。
小鼠p53基因引物序列如下:F-GGCAGACTTTTCGCCACAG,R-GATGATGGTAAGGATAGGTCGG。各组均设2个复孔。用2-∆∆CT法表示目的基因的相对表达水平。
1.4 p53蛋白对LX2细胞活化的影响 将LX2细胞以4×105/孔种植于6孔板,24 h后贴壁注入新的含TGF-β1(0、5、10、20 μg·L-1)或Tenovin-6(4.5 g·L-1)的培养基,培养24 h后进行蛋白、RNA提取及免疫荧光等实验。
1.4.1 Western blot法检测TGF-β1诱导的LX2细胞α-SMA、Col1a1、p53蛋白表达 收集细胞在RIPA裂解液中裂解,检测方法见“1.3.5”。
1.4.2 免疫荧光检测p53蛋白在活化的LX2细胞中的表达 4%多聚甲醛固定LX2细胞15 min,磷酸盐缓冲液(PBS)洗3遍后0.5%免疫染色通透液(Triton-X)透化处理15 min,10%牛血清白蛋白(BSA)封闭2 h后滴加一抗,4 ℃过夜;PBS洗3遍后荧光二抗孵育1 h,4′,6-二脒基-2-苯基吲哚(DAPI)细胞核染色后高内涵拍照。
1.4.3 qRT-PCR法检测p53 mRNA在活化的LX2细胞中的表达 收集细胞置于研钵内,检测方法见“1.3.6”。
1.4.4 p53蛋白对LX2细胞活化的抑制作用 采用p53激动剂Tenovin-6上调LX2细胞中p53蛋白的表达,Western blot法、免疫荧光检测激动剂Tenovin-6干预后LX2细胞α-SMA、Col1a1、p53表达,检测方法见“1.3.5”和“1.4.2”。
1.5 统计学方法 实验数据采用SPSS 24.0软件进行统计分析。计量资料以±s表示,符合正态分布的数据使用单因素方差分析(ANOVA),两两比较采用t检验;不符合正态分布的数据采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 网络药理学分析情况 预测得到的核心化合物为大黄素、白术内酯Ⅰ、黄樟醇、威德乐内酯、芦丁、异橙黄酮和川陈皮素,这些化合物靶向p53蛋白及肝脏纤维化通路分子,如基质金属蛋白酶9(MMP9)、丝裂原激活蛋白激酶8(MAPK8)、白介素-6(IL-6)、趋化因子 8(CXCL8)、TGF-β1、过氧化酶活化增生受体γ(PPAR-γ)等。见图1。

图1 HZRG治疗NASH的网络药理学分析
2.2 对小鼠血清生化指标的影响 与对照组比较,模型组小鼠血清ALT、AST、LDH、ALP水平升高(P<0.05),HZRG低、高剂量组小鼠血清ALT、AST、LDH、ALP水平升高(P<0.05),而TNF-α水平降低(P<0.05)。与模型组比较,HZRG低、高剂量组小鼠血清ALT、AST、LDH、TNF-α水平降低(P<0.05),HZRG低剂量组小鼠血清ALP水平降低(P<0.05);与HZRG低剂量组比较,HZRG高剂量组小鼠血清ALT、AST、LDH、TNF-α水平进一步降低,但差异无统计学意义(P>0.05)。见表1。
表1 各组血清生化指标水平比较(n=8,±s)
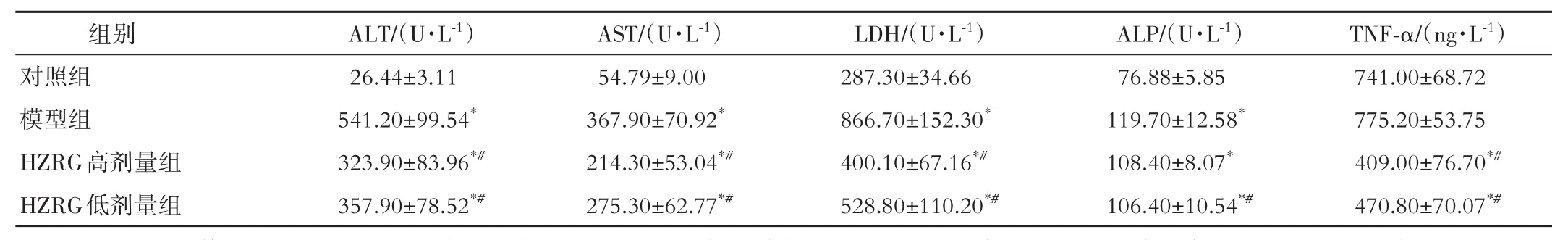
表1 各组血清生化指标水平比较(n=8,±s)
注:HZRG为化滞柔肝颗粒。ALT为丙氨酸转氨酶,AST为天冬氨酸转氨酶,LDH为乳酸脱氢酶,ALP为碱性磷酸酶,TNF⁃α为肿瘤坏死因子⁃α。与对照组比较,*P<0.05;与模型组比较,#P<0.05。
TNF-α/(ng·L-1)741.00±68.72 775.20±53.75 409.00±76.70*#470.80±70.07*#组别对照组模型组HZRG高剂量组HZRG低剂量组ALT/(U·L-1)26.44±3.11 541.20±99.54*323.90±83.96*#357.90±78.52*#AST/(U·L-1)54.79±9.00 367.90±70.92*214.30±53.04*#275.30±62.77*#LDH/(U·L-1)287.30±34.66 866.70±152.30*400.10±67.16*#528.80±110.20*#ALP/(U·L-1)76.88±5.85 119.70±12.58*108.40±8.07*106.40±10.54*#
2.3 对小鼠肝组织病理和TC、TG水平的影响 肝组织HE染色显示,对照组小鼠肝组织细胞结构与边界清晰,组织结构正常,未见明显脂质累积。模型组小鼠肝组织中肝索结构紊乱,中央静脉周围肝细胞出现明显的混合性脂肪变,间质内可见大量的淋巴细胞浸润,另可见少许浆细胞和粒细胞,NAS评分高于对照组(P<0.05)。与模型组比较,HZRG低、高剂量组小鼠肝细胞内脂滴减少,肝脏脂肪变和炎细胞浸润程度明显减轻,NAS评分降低(P<0.05)。见图2A、图2B。
与对照组比较,模型组小鼠肝组织TG水平升高(P<0.05);与模型组比较,HZRG低、高剂量组小鼠肝组织TG水平降低(P<0.05)。各组肝组织TC水平比较,差异无统计学意义(P>0.05)。见图2C。

图2 各组肝组织病理及TC、TG水平比较(n=8,±s)
2.4 对小鼠肝组织α-SMA、Col1a1蛋白表达的影响Masson染色、天狼猩红染色及免疫组化结果显示,与对照组比较,模型组小鼠肝脏胶原纤维沉积,α-SMA、Col1a1阳性表达面积增加(P<0.05);与模型组比较,HZRG低、高剂量组小鼠肝组织中α-SMA、Col1a1阳性表达面积减少(P<0.05)。见图3、图4。
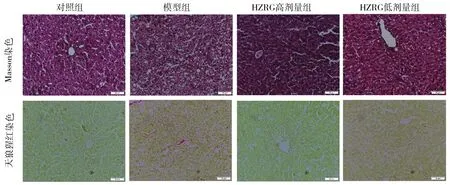
图3 肝组织病理(Masson染色、天狼猩红染色,×200)
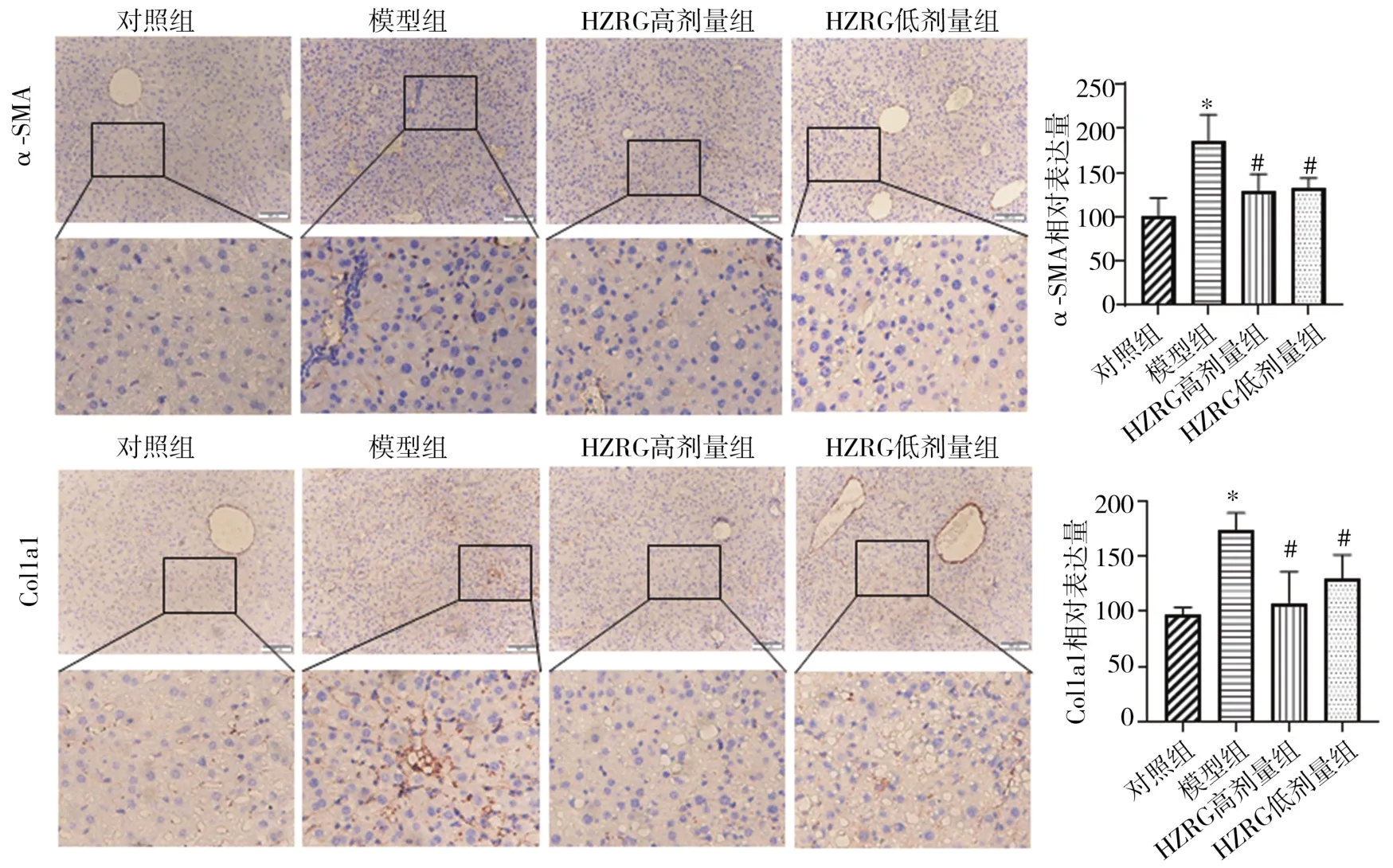
图4 各组肝组织α-SMA、Col1a1蛋白表达(免疫组化,×200)(n=8,±s)
与对照组比较,模型组小鼠肝组织α-SMA蛋白水平升高(P<0.05);与模型组比较,HZRG高剂量组小鼠肝组织α-SMA蛋白水平降低(P<0.05),HZRG低、高剂量组小鼠肝组织Col1a1蛋白水平降低(P<0.05)。见图5。
2.5 对小鼠肝组织p53蛋白与p53 mRNA表达的影响与对照组比较,模型组小鼠肝组织p53蛋白水平降低(P<0.05);与模型组比较,HZRG高剂量组小鼠p53蛋白水平升高(P<0.05)。见图6。各组小鼠肝组织p53 mRNA表达水平比较,差异无统计学意义(P>0.05)。见图7。
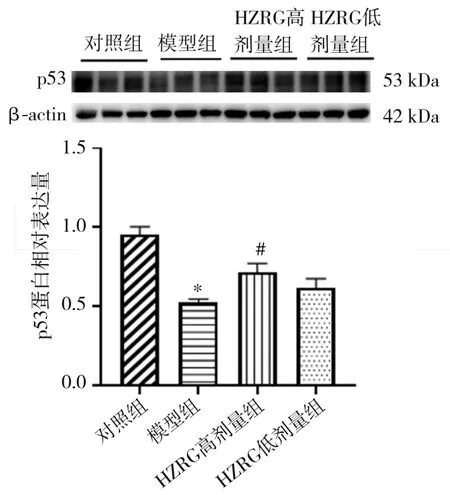
图6 各组肝组织p53蛋白表达(n=8,±s)
图7 各组肝组织p53 mRNA相对表达量(n=8,±s)
2.6 p53蛋白与p53 mRNA在活化LX2细胞中的表达情况 HSC是肝纤维化的核心效应细胞,而α-SMA与Col1a1是其活化的标志物,TGF-β1可诱导肝星状细胞系LX2细胞活化。结果显示,在20 μg·L-1浓度的TGF-β1刺激下,LX2细胞中α-SMA、Col1a1表达升高,在5、10、20 μg·L-1浓度的TGF-β1刺激下,p53蛋白表达降低(P<0.05),但p53 mRNA表达水平无明显变化(P>0.05)。见图8~图10。
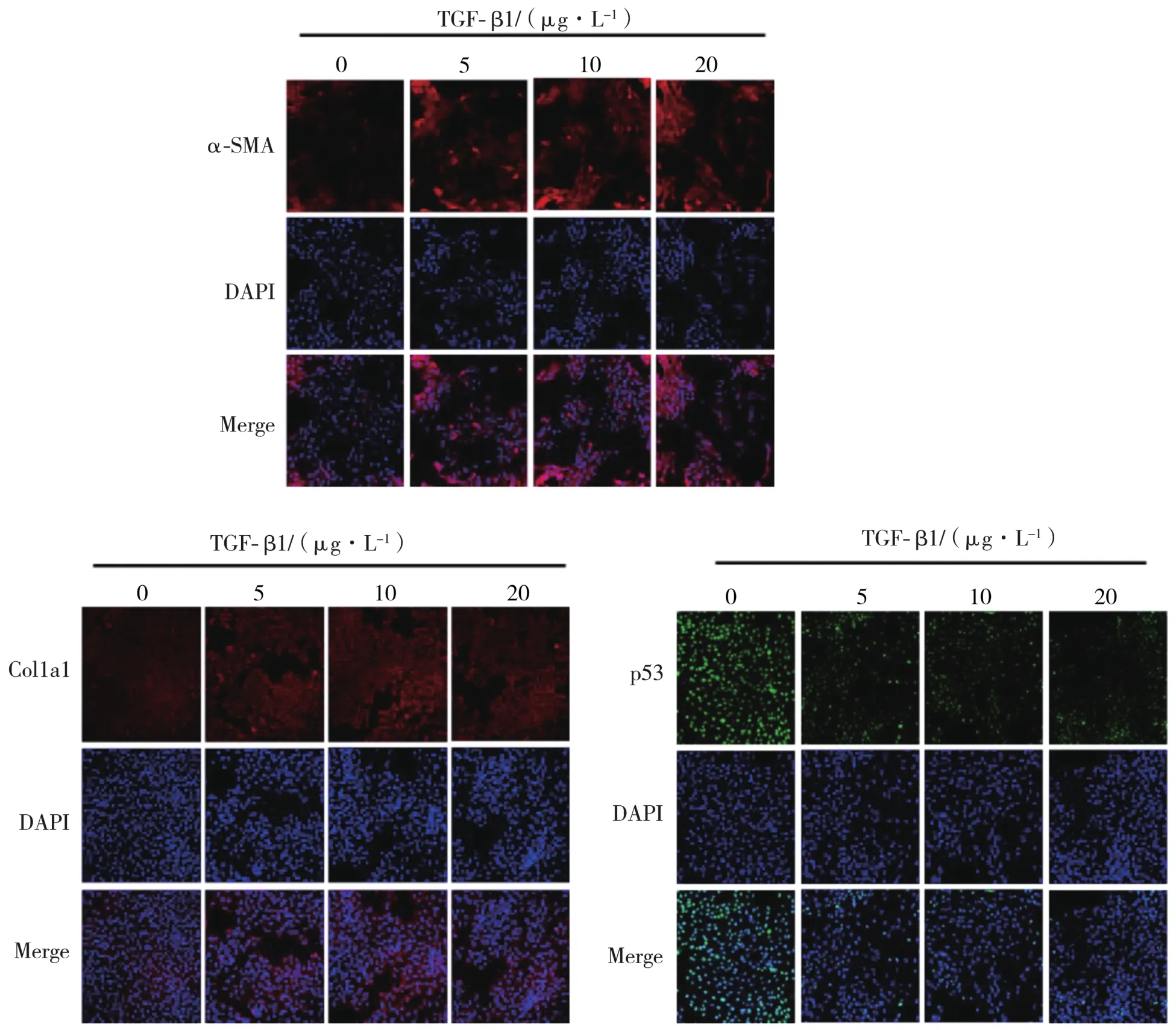
图8 活化LX2细胞中活性标志物及p53蛋白表达(免疫荧光检测,×200)
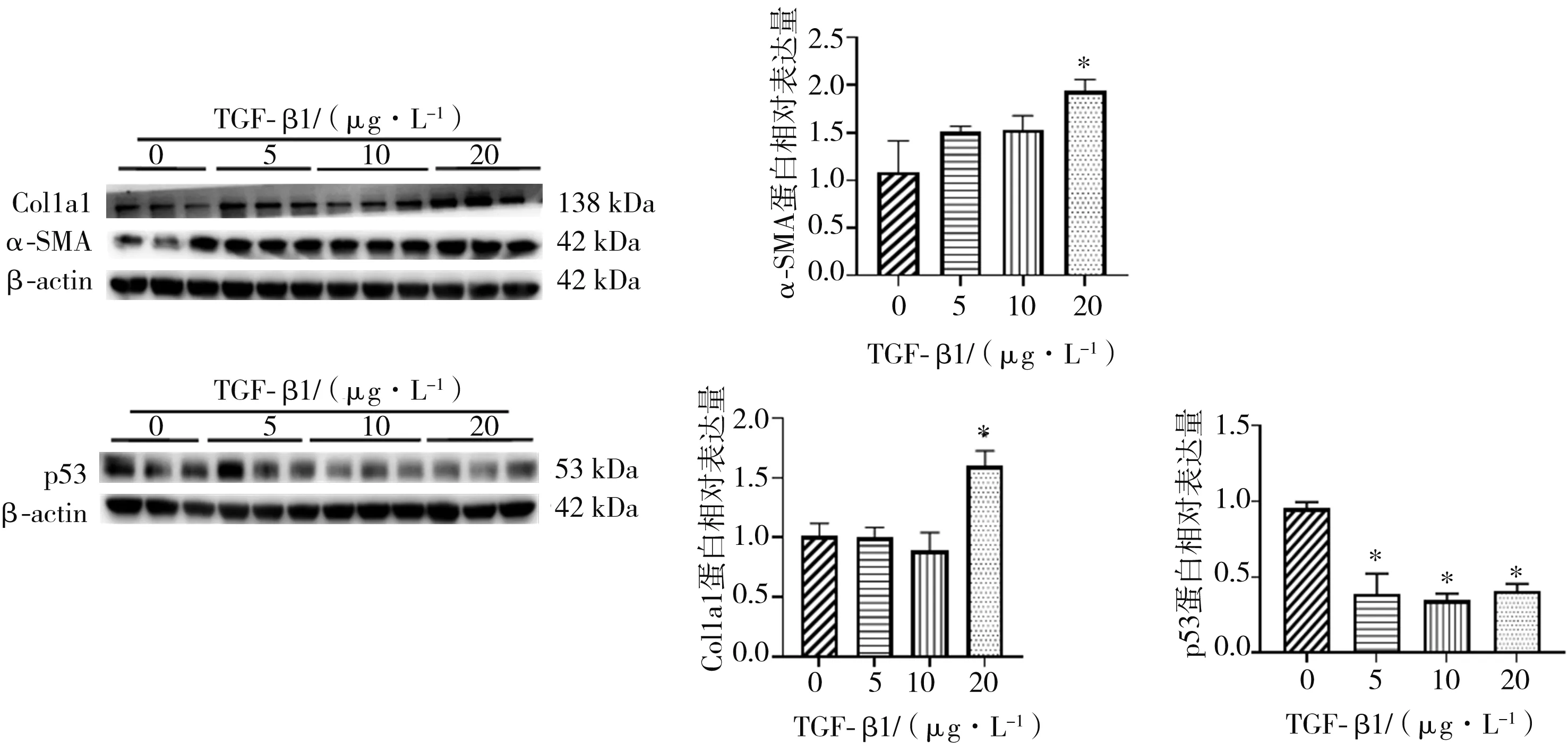
图9 活化LX2细胞中活性标志物及p53蛋白表达(n=3,±s)
图10 活化LX2细胞中p53 mRNA相对表达量(n=3,±s)
2.7 p53对LX2细胞的抑制作用 采用p53激动剂Tenovin-6上调LX2细胞中p53蛋白的表达,发现Tenovin-6干预LX2细胞可降低HSC活化标志物α-SMA、Col1a1的荧光或蛋白表达,提示p53激活可抑制HSC活化。见图11。

图11 Tenovin-6对活化的LX2细胞中活性标志物及p53蛋白表达的影响(×200)
3 讨论
肝纤维化治疗的近期目标为抑制疾病进展,远期目标则在于逆转肝纤维化、改善肝功能、阻止肝硬化发生及延长患者的生存期,治疗方法主要有消除病因、戒酒、减肥等[13],但目前尚缺乏直接治疗的有效药物。中医药治疗慢性肝病疗效确切,尤其是在肝纤维化防治领域,常从“湿热疫毒”“血瘀阻络”“气阴两虚”论治,具有明显优势[14]。中药复方HZRG是临床治疗湿热蕴结型脂肪肝的常用中成药,疗效确切,也是治疗NASH相关肝纤维化的潜在有效药物[15]。该方由茵陈、决明子、大黄、泽泻、猪苓、山楂、苍术、白术、陈皮、瓜蒌、女贞子、墨旱莲、枸杞子、小蓟、柴胡和甘草组成,有清热利湿、祛浊解毒、祛瘀柔肝之效。其中茵陈可以通过降低纤维化相关细胞因子的表达改善肝纤维化[16-17];决明子提取物可以减少脂质积累、减轻肝脏炎症,从而对高脂饮食诱导的NAFLD模型小鼠起到肝保护作用[18];大黄煎剂可以通过激活AMP活化蛋白激酶活性来改善肝脏脂肪变[19];柴胡可以抑制HSC增殖,并通过下调肝组织中基质金属蛋白酶抑制剂-1(TIMP-1)的表达来促进细胞外基质降解,从而发挥抗肝纤维化作用[20];泽泻甲醇提取物可明显改善NAFLD大鼠的肝脏损伤、转氨酶异常和肝肿大,减轻肝脏脂肪变性、炎症和胶原沉积等形态学改变[21]。
肿瘤抑制基因TP53位于人类第17号染色体上,由11个外显子和10个内含子构成,其因编码一种相对分子量为53×103的磷酸核蛋白而得名,是最常见的突变基因[22-23]。1979年,Lane等[24]用免疫学方法发现,猴空泡病毒40(SV40)感染后的NIH3T3细胞的细胞核中存在能产生SV40大T抗原作用的磷酸化蛋白,即p53蛋白。该蛋白可以启动细胞周期阻滞,导致细胞凋亡、细胞衰老,参与DNA损伤修复和分化及三羧酸循环、氧化磷酸化等生物通路,与细胞内稳态关系密切[3]。生理状态下,p53蛋白不稳定,半衰期短,维持在较低水平[25];但应激源刺激会使其稳定性增强,并转录调控下游靶基因,形成复杂的功能网络[26]。因此,p53可能参与肝纤维化的发生、发展过程。
本研究首先通过网络药理学聚焦发现,p53是治疗NASH相关肝纤维化的潜在靶点。通过组织病理染色观察发现,HZRG可以降低肝脏脂质累积,改善肝脏形态变化。Masson染色、天狼猩红染色及免疫组化显示,肝组织内有大量胶原沉积,HSC活化标志物α-SMA及Col1a1的表达水平升高,细胞中p53的表达水平降低。HZRG可以降低肝组织α-SMA和Col1a1蛋白表达,升高肝组织p53蛋白表达,并在一定程度上减轻肝纤维化。因此,p53的上调或能阻止肝纤维化的形成和发展。HSC是肝纤维化的核心效应细胞,我们用TGF-β1诱导LX2细胞活化,结果显示,活化的LX2细胞中α-SMA、Col1a1蛋白表达水平上调,p53表达水平降低;使用p53激动剂Tenovin-6后,细胞中p53表达的上调在一定程度上逆转了LX2细胞的活化。上述提示HZRG对p53蛋白的调控可能是其对抗肝纤维化的效应机制。
纤维化是肝肿瘤形成的重要风险因素,HZRG对于抑癌基因的上调,在一定程度上也可降低肝癌的风险。然而,p53在肝脏广泛表达,细胞间的交互作用是纤维化病理机制复杂的重要原因[27-28]。本研究重点探讨了p53对HSC活化的影响,尚不能排除肝脏其他细胞的作用,因此p53在肝纤维化的发生、发展过程中的作用还需进一步研究探讨。
