123热水浸提—膜分离联用提取板栗寡糖及其抗氧化活性研究
2023-03-25孟迪史天星薛金燕梁力曼牛奎
*孟迪 史天星 薛金燕 梁力曼 牛奎
(河北科技师范学院化学工程学院 河北 066004)
寡糖(低聚糖)因其具有抗氧化[1]、抗龋齿[2]、优化肠道菌群[3]、增强免疫力[4]等多种潜在生理功能,已逐渐在营养保健食品的研发与生产中成为一类重要的功能性食品基料。由于天然存在的活性物质往往具有更低的毒性、更高的稳定性和更好的生物相容性,当前,从自然界动植物和微生物中分离筛选功能性寡糖一直是天然产物领域研究的热点之一。
板栗(Castanea mollissima)是我国的生态经济型树种之一,其种仁是制作食疗药膳的上等原料,可有效预防和治疗高血压、冠心病、动脉硬化等心血管疾病[5-6]。目前,栗仁中营养活性成分的相关研究聚焦于板栗淀粉、蛋白质及膳食纤维等,而针对其中寡糖成分的提取分离以及活性功能研究迄今尚未见报道。本文采用热水浸提—膜分离联用法分离栗仁可溶性总糖中的寡糖组分,经阴离子柱层析纯化得到中性寡糖。利用凝胶渗透色谱测试其分子量,分别借助紫外光谱和扫描电镜研究其理化性质,并对其抗氧化活性进行了评价,为板栗寡糖的开发利用提供科学依据。
1.材料与方法
(1)材料与仪器
①原料与试剂
板栗采自青龙满族自治县,剥除外壳和内皮后将栗仁置于60℃烘箱干燥过夜,再经粉碎机粉碎后过60目筛,板栗粉于-40℃低温储存备用。
2,2-联苯基-1-苦基肼基(DPPH,96%)、水杨酸(AR)购自上海麦克林生化科技有限公司;牛血清蛋白(98%)、考马斯亮蓝(AR)、咔唑(AR)、D-葡萄糖醛酸(98%)及其它试剂购自上海阿拉丁生化科技股份有限公司。
②仪器
高压平板膜设备(FlowMem-0005-PN40,厦门福美科技有限公司);冷冻干燥机(ALPHA 2-4 LD plus,德国Marin Christ公司);激光光散射仪(DAWN HELEOS Ⅱ,美国Wyatt technology公司);紫外可见分光光度计(UV-5500,上海元析仪器有限公司);场发射扫描电子显微镜(SU8010,日本Hitachi公司)。
(2)试验方法
①板栗寡糖的提取纯化
将50g板栗粉在80℃下热水浸提2h,料液比为1:15。6000rpm下离心5min,滤渣重复浸提,合并两次浸提液作为膜分离起始物料。浸提液首先进行微滤(0.1μm膜,压力10bar),所得渗透液继续进行超滤(3000Da膜,压力10bar),最后将渗透液进行纳滤(300Da膜,压力12bar)。取最终截留液减压浓缩,冷冻干燥后得到粗寡糖COC。
称取100mg COC溶于20mL超纯水,超声溶解至溶液澄清,溶液过0.45μm滤膜后于DEAE Sepharose FF琼脂糖凝胶柱上样洗脱。分别用超纯水,0.1M、0.5M和1.0M NaCl溶液依次进行梯度洗脱,5mL/管收集洗脱液。以苯酚-硫酸法跟踪检测并绘制洗脱曲线。合并中性寡糖溶液,减压浓缩后以MW300透析袋透析,冷冻干燥后得到中性寡糖NOC。
②理化性质的测定
A.化学组成分析
分别采用苯酚硫酸法、考马斯亮蓝法和咔唑硫酸法测定样品的糖含量、蛋白质含量和糖醛酸含量。
B.分子量测定
利用凝胶色谱-示差-多角度激光光散射(GPCRI-MALS)测定样品分子量。取1mg样品加1mL 0.1M NaNO3溶解,14000rpm离心10min,取100μm上清液上样。分析柱:Ohpak SB-805 HQ,Ohpak SB-804 HQ,Ohpak SB-803 HQ;柱温45℃,流动相0.1M NaNO3,流速0.4mL/min。
C.形貌观察
将样品粉末均匀涂覆在贴有双面碳导电胶带的进样台上,真空喷金处理,加速电压5.0kV下观察寡糖微观形貌。
③抗氧化活性测定
配制2mg/mL、4mg/mL、6mg/mL、8mg/mL、10mg/mL的样品溶液,吸取50μL样品溶液与150μL浓度为200μmol/L的DPPH乙醇溶液振荡混匀,避光反应30min后利用酶标仪测试517nm处吸光度值,记为Ai。用乙醇分别代替样品溶液和DPPH溶液,重复操作,测试517nm处吸光度值,分别记为A0和Aj。以相同浓度Vc溶液作为对照组,根据公式(1)计算DPPH自由基清除率。
2.结果与讨论
(1)板栗寡糖的提取纯化
实验以50g板栗粉为初始原料,经热水提取和膜分离处理得到1.55g粗寡糖COC,得率为3.1%。图1为COC在DEAE Sepharose FF层析柱上的洗脱曲线,COC先后以超纯水和NaCl溶液洗脱都有明显的洗脱峰,说明样品COC中同时含有中、酸性糖组分。收集合并第10~25管中性洗脱液,经透析、冷冻干燥后得到样品NOC。表1中样品的糖含量、蛋白质含量和糖醛酸含量表明柱层析不仅可以除去粗寡糖中的糖醛酸,还能进一步吸除蛋白和提升糖纯度。样品NOC的糖纯度高于95%,且几乎不含蛋白质和糖醛酸,为该寡糖后续理化性质的测定和结构表征奠定了基础。
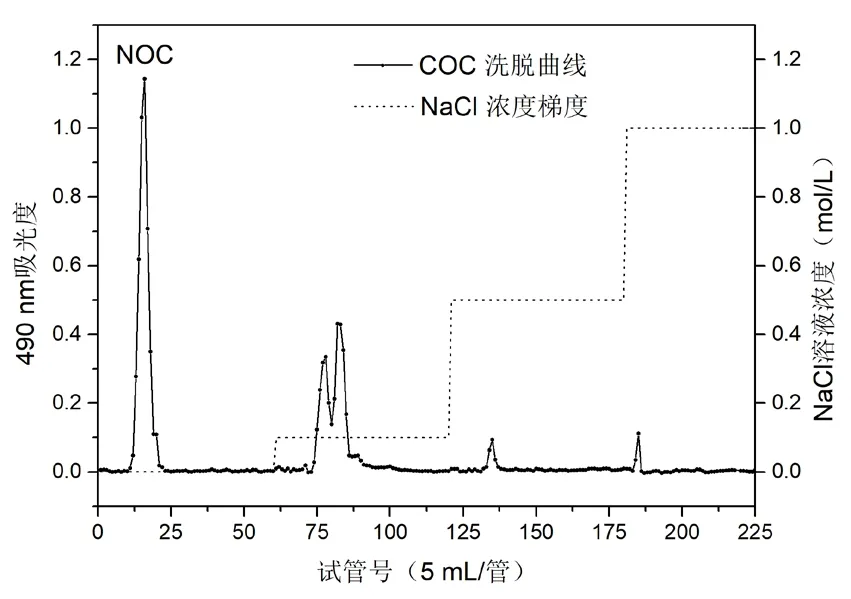
图1 样品COC在DEAE Sepharose FF阴离子交换柱上的洗脱曲线
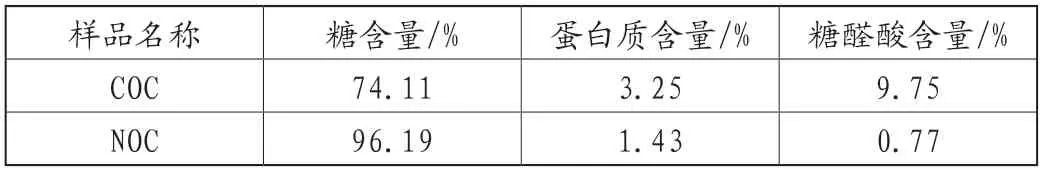
表1 所提取板栗寡糖的糖含量、蛋白质含量及糖醛酸含量
(2)板栗寡糖的理化性质测定
借助GPC-RI-MALS测试样品NOC的分子量,其分析如图1所示。本实验采用光散射技术和凝胶渗透色谱分离技术相结合的分子量测定方式,得到样品的绝对分子量。表2给出了利用软件ASTRA 6.1处理色谱数据得到的分子量信息,样品NOC的分子量多分散系数低至1.054,分子量分布非常窄。由重均分子量Mw为670Da分析可知该寡糖是一种四糖结构。
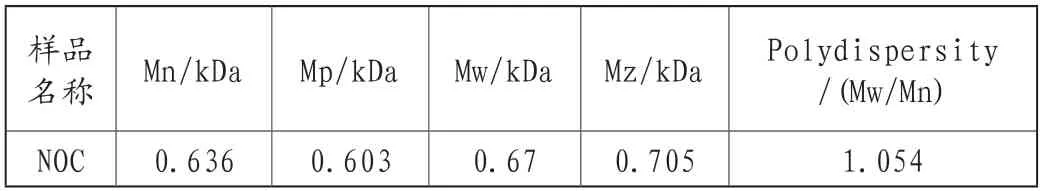
表2 NOC的分子量分析结果
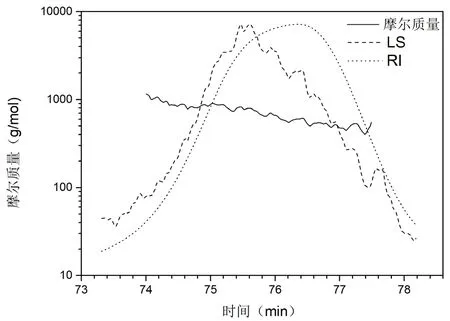
图2 GPC-RI-MALS测试样品NOC的分子量分析图
样品COC和NOC在扫描电镜下放大100倍观察到的微观形貌如图3所示。COC呈大小形状不一、分散性较好、表面光滑且有孔洞结构的薄片状形貌,而中性寡糖NOC则呈现树枝状或纤维状的聚集形态。
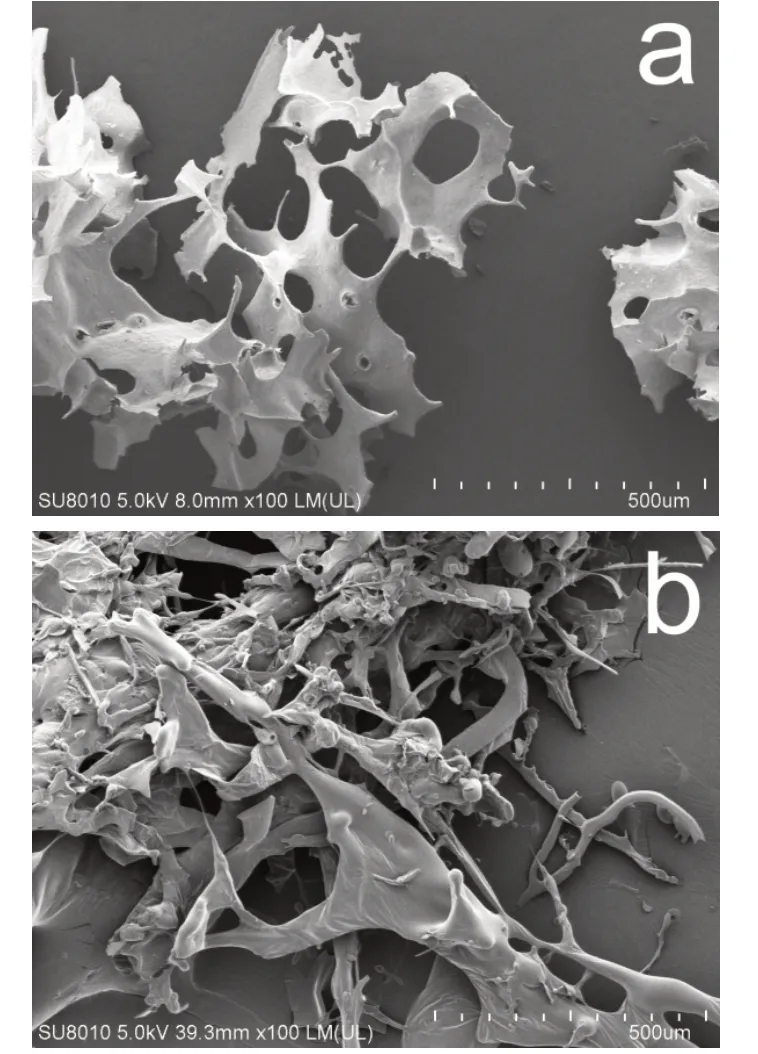
图3 粗寡糖COC(a)与中性寡糖NOC(b)的扫描电镜图片
(3)抗氧化活性研究
实验采用DPPH法,以Vc为对照组对提取得到的寡糖NOC进行抗氧化能力测定,结果见图4。由图可知,NOC溶液的DPPH自由基清除能力具有明显的浓度效应,在浓度为2mg/mL时对DPPH自由基的清除率为(31.47±0.47)%,浓度升高至10mg/mL时清除率升至(68.03±1.55)%,半数清除浓度EC50为5.01mg/mL。尽管与对照组Vc相比,寡糖NOC的抗氧化能力有一定差距,但相对其它已报道的寡糖展现了较高的DPPH自由基清除能力[7-8],在低聚糖类物质中显示出较好的抗氧化活性。
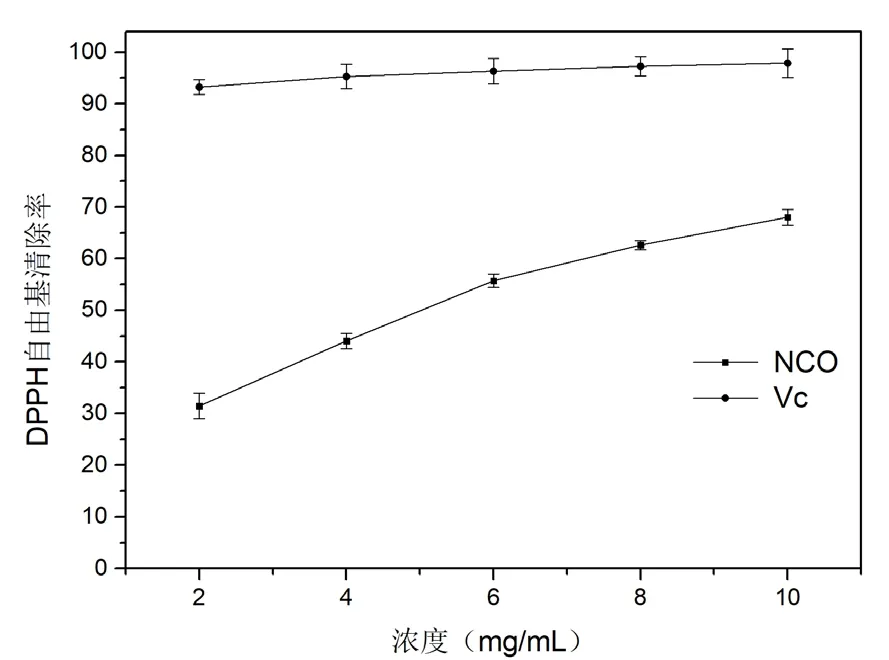
图4 不同浓度寡糖NOC以及对照组Vc对DPPH自由基的清除率
3.结论
本文采用热水浸提—膜分离联用的方法分离栗仁寡糖,经阴离子柱层析纯化得到中性寡糖。理化性质测试表明该寡糖中几乎不含蛋白质和糖醛酸,糖纯度高于95%,其颗粒微观形貌呈现纤维状聚集形态,是一种重均分子量为670Da的四元寡糖。寡糖NOC有着较强的DPPH自由基清除能力,EC50为5.01mg/mL,展现出较好的抗氧化活性。本研究首次从板栗种仁中提取纯化得到了板栗寡糖,这对深入发掘板栗中营养功能成分以及板栗的高值化利用具有重要意义。
