神经炎症介导的帕金森病运动防治研究进展
2023-03-22刘静司景梅
刘静 司景梅
(吕梁学院体育系,山西 吕梁 033000)
帕金森病(PD)是一种与年龄相关、起病隐匿且缓慢进展的神经退行性疾病,临床表现为静止性震颤、运动启动困难、肌肉僵直和姿势步态平衡障碍,神经病理上主要以黑质致密部(SNpc)多巴胺(DA)能神经元进行性丧失,神经胶质增生,残存的DA神经元内出现以ɑ-突触核蛋白为主要成分的嗜酸性包涵体路易小体沉积为特征〔1,2〕。PD的病因目前尚不完全清楚,尽管多年来人们提出了多种可能的致病机制,包括在酶促DA降解过程中氧自由基的过度释放、线粒体功能障碍、营养支持丧失、激酶活性异常、钙稳态紊乱、蛋白质稳态失衡、谷氨酸兴奋性毒作用、自噬缺陷和神经炎症等,但PD的发病机制在很大程度上仍是不确定的〔3〕。新的证据表明,持续性神经炎症反应、T细胞浸润和胶质细胞活化是人类PD患者和PD动物模型的共同病理特征,在DA神经元变性和纹状体中等多棘神经元形态结构重塑及与PD相关的行为/运动功能障碍中起重要作用〔4,5〕。运动是预防神经炎症相关疾病的一种有效干预措施〔6〕。Real等〔7〕和Svensson等〔8〕研究表明,运动干预可使PD模型动物黑质-纹状体脑区促炎性细胞因子及激活的星形胶质细胞和小胶质细胞的水平显著降低,并改善与PD相关的行为/运动功能障碍症状。本文就神经炎症在PD进展中的作用及运动介导的抗炎因子激活在PD运动防治中的作用进行综述。
1 小胶质细胞介导的PD神经炎症
小胶质细胞是参与中枢神经系统(CNS)炎症反应的主要细胞类型之一〔9〕。有关神经炎症参与PD发病机制的证据最早发表在1988年,McGeer等〔10〕对PD患者死后脑组织进行尸检发现SNpc中存在反应性小胶质细胞。正电子发射断层扫描(PET)研究也表明,在PD脑的不同区域有明显的小胶质细胞活化〔11〕。此外,在不同类型PD动物模型的SNpc和纹状体中,发现明显的小胶质细胞异常活化〔12,13〕。进一步生化分析显示,PD患者中脑内肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β和干扰素(IFN)-γ等促炎介质水平较高。这些证据有力地提示免疫成分参与PD的发病。
生理条件下,神经细胞产生多种免疫调节因子如C-X3-C趋化因子配体(CX3CL)1、分化簇(CD)200、CD22、CD47、CD95和神经细胞黏附分子(NCAM)来维持小胶质细胞的静息状态〔14〕,并且,这些免疫调节因子的受体几乎完全由中枢神经系统中的小胶质细胞表达,表明神经元-小胶质细胞相互作用在调节神经炎症中的关键作用。如CX3CL1-CX3CR1信号负调控小胶质细胞的激活,并保护DA神经元免受神经毒素诱导的变性〔15〕。体内CX3CL1或CX3CR1的缺乏会导致全身性脂多糖(LPS)处理诱导的神经毒性增加,并在PD动物模型的SNpc中增加DA神经元的细胞死亡〔16〕。同样,CD200-CD200R信号功能障碍也会增加小胶质细胞的激活,并加剧PD模型大鼠SNpc DA能神经元的变性〔17〕。
PD脑中小胶质细胞的长期过度激活显著上调包括TNF-α,IL-1β,IL-6和IFN-γ等一大批促炎性细胞因子的表达,加速SNpc DA神经元变性〔18〕。随着疾病的发展,α-突触核蛋白、三磷酸腺苷(ATP)和基质金属蛋白酶(MMP)-3等分子从变性的DA神经元中释放出来,将进一步增强小胶质细胞的激活,放大脑内的神经炎性反应,导致神经退变过程的恶化,形成神经退变的恶性循环。活化的小胶质细胞聚集在PD脑许多区域α-突触核蛋白阳性聚集物周围,从而被过量产生的、突变的或错误折叠的α-突触核蛋白激活,导致促炎性细胞因子产生和释放增加〔19,20〕。因此,过多或错误折叠的α-突触核蛋白诱导的神经毒性可能部分由小胶质细胞介导的炎症反应引起。
ATP,一种嘌呤能神经递质,也能够稳定地调节小胶质细胞的各种功能〔21〕。小胶质细胞向受损和炎性区域的迁移受受损神经元和邻近星形胶质细胞释放的ATP的控制〔22〕。此外,ATP与嘌呤受体亚型2Y(P2Y)受体结合,P2Y受体主要由脑中的小胶质细胞表达,并诱导高水平的IL-1β,TNF-α和一氧化氮(NO)的产生〔23〕。神经元退变产生的另一种蛋白是MMP-3,它在调节小胶质细胞的激活状态中也发挥重要作用。MMP-3在小胶质细胞-神经元共培养物中的过表达诱导小胶质细胞的显著活化并增加氧化应激反应。相反,注射N-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)的MMP-3-/-小鼠显示出黑质纹状体DA神经元变性,小胶质细胞活化和超氧化物生成减弱〔24〕。这些结果均表明,小胶质细胞是PD发病机制中神经炎症的主要参与者(图1),PD病理状态下蛋白质聚集、基因突变、环境因素和细胞因子浸润等条件下小胶质细胞活化。小胶质细胞激及由小胶质细胞活化而激活的星形胶质细胞导致促炎因子NO和超氧自由基增加,导致神经病变性。退伤性多巴胺神经元释放的ATP、α-synaptophsin活性氧簇、NO、细胞碎片等可进一步激活胶质细胞活化和炎症反应。
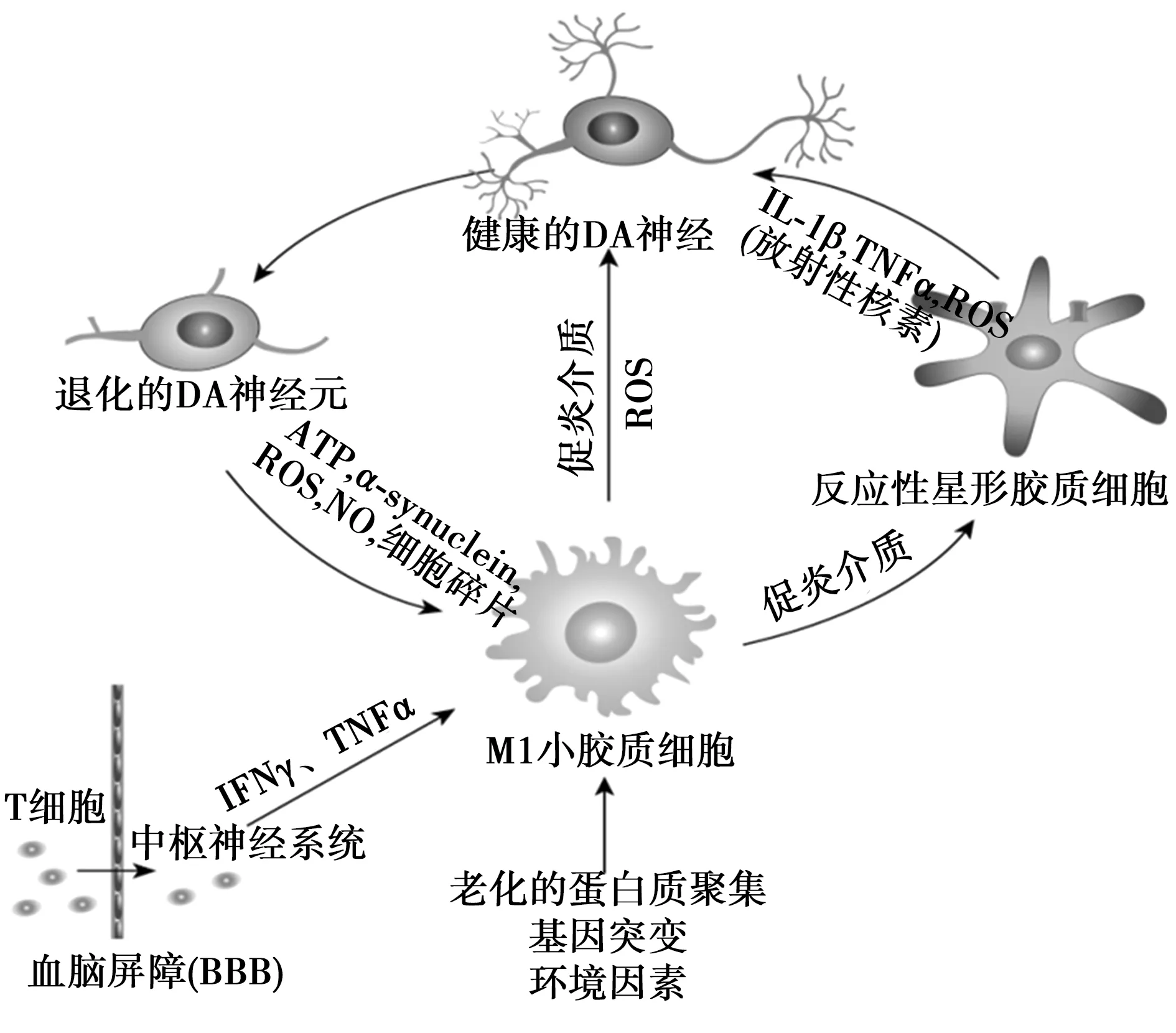
图1 炎症机制参与PD的发病机制
2 星形胶质细胞介导的PD神经炎症
大量研究表明,星形胶质细胞在PD的神经炎症过程中也起着重要作用。与小胶质细胞一样,星形胶质细胞在体外和体内都通过产生促炎细胞因子来响应炎症刺激,如LPS、IL-1β和TNF-α〔25〕。以胶质纤维酸性蛋白(GFAP)表达水平升高、胞体肥大和突起增粗为特征的反应性星形胶质增生在多种PD动物模型中均有报道。重要的是,PD患者的受累脑区也存在星形胶质细胞增生,这表明星形胶质细胞可能参与了PD的免疫过程〔26〕。研究发现,星形胶质细胞在刺激后的反应相对慢于小胶质细胞的激活。小胶质细胞可能在LPS和α-突触核蛋白聚集等免疫刺激后启动炎症反应。随后,星形胶质细胞被从活化的小胶质细胞释放的各种促炎分子激活,并被星形胶质细胞进一步放大。小胶质细胞和星形胶质细胞的协同活化引起的不受控制的神经炎症最终导致神经退行性变过程中SNpc DA神经元的死亡增加〔27〕。体外原代培养星形胶质细胞经α-突触核蛋白处理后,TNF-α和IL-6表达水平显著升高〔28〕。突变型α-突触核蛋白在星形胶质细胞中的特异性过表达导致小鼠广泛的星形胶质细胞增生、小胶质细胞活化和DA神经元和运动神经元的变性〔29〕。
3 PD相关基因与神经炎症
越来越多证据表明,一些PD相关基因参与了中枢神经系统小胶质细胞和星形胶质细胞的免疫应答调控,其中一种就是α-突触核蛋白基因,其错义突变会导致家族性PD〔30〕。神经元胞质和神经突中ɑ-突触核蛋白的异常聚集是PD的病理特征之一〔31〕。野生型或致病性的α-突触核蛋白在体外诱导明显的小胶质细胞活化〔32〕。此外,α-突触核蛋白的低聚物可通过激活Toll样受体(TLR)2介导的信号传导引发小胶质细胞激活〔33〕。在α-突触核蛋白转基因小鼠中,脑干和SNpc中的小胶质细胞显著激活,TLR显著上调〔34〕。
近年来,富亮氨酸重复序列激酶LRRK2基因的常见变异已被确认为家族性和散发性PD的危险因素〔35〕。如LPS之类的炎性刺激可以极大地增强原代培养的小胶质细胞中LRRK2的表达水平〔36〕,而敲除LRRK2则可降低LPS诱导的TNF-α和诱导型NO合酶(iNOS)的产生,并降低小胶质细胞中核因子(NF)-κB转录活性的激活〔37〕。此外,从LPS激发的过表达LRRK2 突变体R1441G的转基因小鼠中分离出的小胶质细胞中,促炎细胞因子的表达水平高于LPS处理的WT小鼠的小胶质细胞〔38〕。这些结果提示,LRRK2可调控小胶质细胞的激活,从而可能通过神经炎症途径参与PD的进展。值得注意的是,LRRK2已被证明在外周炎症中发挥关键作用。LRRK2在外周血单核细胞和免疫系统巨噬细胞中相对丰富,LRRK2的表达水平在急性单核白血病细胞系(THP)-1单核巨噬细胞分化过程中显著升高〔39〕。LRRK2缺失导致小鼠对实验性结肠炎的易感性增强,提示LRRK2在外周炎症中的重要作用及其与PD的潜在关联〔40〕。
Parkin是另一个与PD相关的基因,编码E3-泛素连接酶。 Parkin突变是PD隐性遗传的最常见原因〔41〕。与同窝对照相比,系统LPS处理可在Parkin基因敲除小鼠的SNpc中引起更明显的DA神经元变性〔42〕。Parkin基因敲除的老年小鼠纹状体星形胶质增生增高,中脑小胶质细胞活化异常〔43〕。将Parkin基因敲除小鼠的小胶质细胞与野生型神经元共培养,会增加神经元对鱼藤酮毒性的脆弱性〔44〕,这表明无Parkin的小胶质细胞会产生并释放对神经元细胞有害的可溶性因子。事实上,这些小胶质细胞在LPS刺激后表达更高水平的促炎细胞因子,如TNF-α,IL-6 和iNOS〔45〕,这暗示Parkin在PD相关炎症的调节中发挥重要作用。
磷酸酶和张力蛋白诱导的假定激酶(PINK)1基因的错义突变会导致早发性,隐性遗传形式的PD〔46〕。在病理条件下,PINK1直接磷酸化Parkin以增强其活性并引起线粒体损伤〔47〕。PINK1也参与炎症性细胞因子的产生。在基础条件下和系统LPS处理后,PINK1基因缺失的小鼠产生更高水平的促炎细胞因子,包括IL-1β,IL-12和TNF-α。PINK1可能通过与IL-1受体相关激酶(IRAK)1和Toll样蛋白相互作用蛋白(Tollip)相互作用来调节IL-1β介导的NF-κB活性〔48〕。
研究表明,PD相关基因之一PD蛋白7(DJ-1)主要在人脑的星形胶质细胞和小胶质细胞中表达,PD患者反应性星形胶质细胞中DJ-1的表达水平明显上调〔49〕。DJ-1基因敲除小鼠的星形胶质细胞在LPS处理后产生更高水平的环氧合酶(COX)2和IL-6。DJ-1缺失的星形胶质细胞在LPS处理后出现严重的凋亡,这表明DJ-1的缺失可能通过星形胶质细胞介导的神经炎症反应参与PD发病〔50〕。同样,DJ-1敲出的小胶质细胞也表现出对LPS的高反应性〔51〕。综上所述,PD相关基因的突变、下调或过表达很可能会影响LPS处理后神经胶质细胞中促炎性细胞因子的表达。
4 外周免疫细胞介导的PD神经炎症
在生理条件下,外周免疫细胞如T淋巴细胞和B淋巴细胞在中枢神经系统中几乎检测不到。在感染或组织损伤后,血液单核细胞和组织巨噬细胞迅速被激活并分泌一系列炎性细胞因子,如IL-1β,TNF-α和IL-6及趋化因子。这些细胞因子和趋化因子可进入大脑并刺激小胶质细胞引发神经炎症反应〔52〕,由于存在BBB,中枢神经系统被认为具有免疫豁免权。众所周知,神经血管单位是由内皮细胞与中枢神经系统的周围成分(包括周细胞、星形胶质细胞和基底膜)紧密连接而成的。BBB限制病原体和外周免疫细胞进入脑实质。BBB破坏导致外周免疫细胞向中枢神经系统的浸润增加,这已被确定为包括PD在内神经退行性疾病的主要促成因素之一〔53〕。PD脑SNpc中内皮细胞的形态发生了巨大变化,表明BBB在PD的病理过程中可能存在功能障碍〔54〕。一些研究表明,通过在小鼠体内注射血管内皮生长因子(VEGF),血脑屏障破坏和DA神经元丢失之间存在很强的相关性,VEGF是血脑屏障损伤的一种有效诱导因子〔55〕。此外,在PD患者和MPTP诱导的小鼠PD模型中,VEGF表达水平都急剧增加〔56〕。在腺相关病毒(AAV)介导的过表达α-突触核蛋白的小鼠的SNpc中,激活的小胶质细胞和浸润的B和T淋巴细胞的数量显著增加。此外,在MPTP处理的小鼠中,硝基化的α-突触核蛋白可以通过BBB进入颈部淋巴结,引起T淋巴细胞的激活,并增加Ⅱ类主要组织相容性复合体的表达,将硝基化的α-突触核蛋白免疫小鼠的T细胞移植到脑内,明显加剧了神经炎性反应和DA神经元的变性。相反,缺乏T和B淋巴细胞的小鼠对MPTP毒素引起的神经毒性更具抵抗力。此外,MPTP诱导的神经毒性在CD4-/-小鼠的SNpc中显著减弱。溃疡性结肠炎引起的外周炎症增加了脂多糖诱导的DA神经元变性、小胶质细胞激活、促炎细胞因子的产生和BBB的通透性〔57〕。这些数据表明,外周免疫系统介导的神经炎症与PD进展密切相关。
5 运动与PD神经炎症
为了应对与运动有关的刺激和轻度损伤,机体通过产生与抗炎症有关的因子来激活内源性保护和恢复系统,对中枢神经系统内、外细胞因子水平产生显著影响,从而在维持和改善脑健康中起着重要作用。Real等〔58〕研究表明,跑台运动干预 (4 w,3 d/w,40 min/d,10 m/min)可使6-羟基多巴胺(OHDA)诱导的PD模型大鼠黑质、纹状体CD-11c/b和GFAP表达水平显著降低,并使运动功能障碍显著改善(阿扑吗啡诱导的旋转圈数显著减少)。Koo等〔59〕研究表明,跑台运动干预 (8 w,5 d/w,60 min/d,10 m/min)可显著降低MPTP诱导的PD模型小鼠神经炎症,并使运动功能障碍显著改善。具体表现为反应小胶质细胞激活程度的标记物(Iba)-1及促炎细胞因子NF-κB、TNF-α和IL-1β的表达水平显著降低,从转棒上掉落的延迟时间显著增加。Jang等〔60〕研究表明,8 w跑台训练可使MPTP模型小鼠DA能神经元丢失显著减少,促炎性细胞因子TNF-α和IL-1β表达水平显著降低;Wu等〔61〕研究表明,4 w跑台训练完全阻止脂多糖(炎症反应)诱导的黑质DA能神经元丢失及运动功能障碍,促炎性细胞因子如TNF-α、IL-1β和IL-6表达水平显著降低,黑质、纹状体脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)及受体酪氨酸激酶(TrK)B表达水平可显著增高。Sung 等〔62〕对MPTP诱导的PD模型小鼠进行研究表明,跑台运动干预(4 w,5 d/w,30 min/d,12 m/min)可显著抑制模型小鼠黑质纹状体区小胶质细胞的激活(CD11b表达水平显著降低,CD200和CD200R表达水平显著升高),降低脑部炎症iNOS、磷酸化的有丝分裂原活化蛋白激酶(p-MAPKs)、磷酸化的细胞外调节蛋白激酶(p-ERK)和磷酸化的应激活化蛋白激酶(p-JNK)表达水平显著降低,减轻DA神经元丢失,改善PD相关行为功能障碍(平衡和协调运动能力显著提高)。Zoladz 等〔63〕研究表明,8 w中等强度运动显著提高PD患者血清脑源性神经营养因子水平,降低血清血管细胞黏附分子和血清TNF-α。这些研究结果均表明,在PD相关神经退行性变和运动功能障碍中运动可能通过促进抗炎分子的表达并降低促炎细胞因子的水平到保护和改善作用。
综上,神经炎症参与PD的发生与进展,PD神经炎症反应既涉及神经胶质细胞活化又涉及外周免疫细胞浸润。神经炎症在PD中的确切作用机制需要进一步阐释。运动作为一种非药理学方法,可能通过增加抗炎分子并降低促炎分子的表达水平,在PD相关神经退行性变和运动功能障碍中起到保护和改善的作用,是防治PD相关疾病的有效干预措施。
