性格迥异的有机氧化剂
——环状过氧化物
2023-03-21史雷杨惜晖
史雷,杨惜晖
哈尔滨工业大学(深圳)理学院,广东 深圳 518055
1 序言
地球,浩瀚宇宙中无数天体中的一颗行星,在太阳系中安静地见证时间的流逝。在地球漫长的演化过程中,从真核生物的出现到高等生物的繁衍和进化,氧化反应的重要性不言而喻。氧气——大自然支配氧化反应最常利用的氧化剂,以单线态或三线态的形式在酶的催化作用下将有机物氧化分解并释放能量,维持有机生命体的代谢及高效运转,这种过程也被称为“有氧呼吸”。在感叹高等生命体无比精妙的循环体系之余,为了加深对这颗46亿岁星球进化过程及生存法则的了解,有机化学工作者从模拟自然界精妙可控的氧化策略出发,在大自然的引导下追求和探索高选择性、高效的氧化反应。过氧化氢(H2O2,俗称双氧水)被认为是最耳熟能详的无机过氧化物,为保证运输及使用的安全性,主要以30%或更低浓度的水溶液形式存在。然而,一方面,低浓度水溶液的储存形式极大程度降低了过氧化氢的氧化能力及反应活性;另一方面,许多高活性有机化合物(如有机金属试剂、草酰氯、重氮化合物等)对水较为敏感,容易与溶剂中的水发生反应(导致化合物水解、引发火灾和爆炸等灾难性后果),大大限制了双氧水的使用范围。因此,探索和开发更稳定、更安全、反应活性更高、底物适用范围更广的氧化剂成为有机化学工作者一直以来追求的目标和研究的动力。
2 有机过氧化物简介
有机过氧化物,通常指过氧化氢中的一个或两个氢原子被有机基团取代的有机化合物,主要分为链状过氧化物(Acyclic peroxide)、氢过氧化物(Hydroperoxide)和环状过氧化物(Cyclic peroxide)。一方面,取代基的改变可以定向调控有机过氧化物的反应活性和稳定性;另一方面,有机过氧化物的过氧键平均键能约为142 kJ·mol-1,是已知键能最低的共价键之一,其化学性质和其他有机化合物有很大的差别[1]。因此,有机过氧化物在药物化学、生物化学、食品化学、高分子材料以及化工生产等领域都具有较为广泛的应用[2]。
自1858年Brodie首次用苯甲酰氯和过氧化钡制备过氧化苯甲酰以来[3],有机过氧化物的热稳定性及其引起的热安全性问题一直受到人们的关注。针对这一系列问题,有机化学工作者对多种已知有机过氧化物的物理和化学性质进行深入探索及严格评估,目前国内外生产企业已经利用日渐成熟的大规模生产技术实现了多达70余种有机过氧化物的工业化安全生产(图1上)。以应用于发泡聚苯乙烯引发、电线电缆交联、制鞋三大领域的过氧化二异丙苯(Dicumyl peroxide,DCP,俗称工业味精)为例,国内多家知名化学品生产企业已经可以实现高质量、高技术水平、大规模(年产能2-4吨)生产。值得一提的是,2020年以来新冠肺炎疫情在世界各地肆虐,全球各国对医用口罩需求量呈爆发式增长,而医用口罩生产必需材料之一的熔喷布则是以过氧化二异丙苯为主要原料合成的。在新冠肺炎疫情的严峻形势下,我国作为全球最大的医用口罩生产国和需求国,国内的过氧化二异丙苯产能将持续增长。
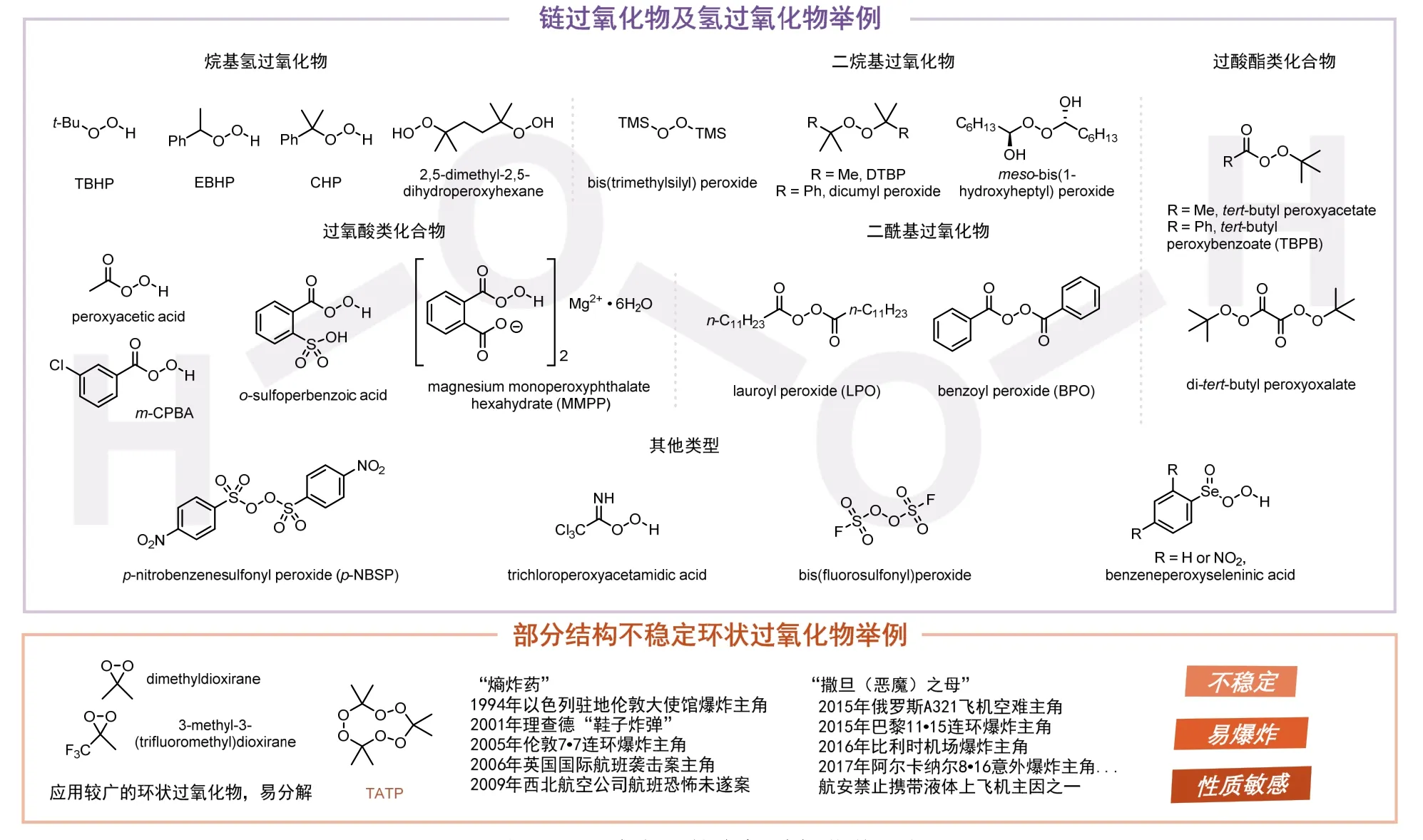
图1 已成功合成的有机过氧化物示例
随着有机化学工作者能够安全、高效、规模化地获取各类型的有机过氧化物,其作为氧化试剂和自由基引发剂在有机反应研究中得到广泛应用,仅在氧化反应研究方面就发展了若干人名反应(Baeyer-Villiger氧化、Kharasch-Sosnovsky氧化、Prilezhaev环氧化、Sharpless-Katsuki不对称环氧化、史一安不对称环氧化等)[4]。值得注意的是,用以完成这些具有标志性成果的氧化剂大多是链状过氧化物和氢过氧化物。相较之下,环状过氧化物在近些年才被慢慢关注,其独特的性质也在研究人员不断深入的探索中被发现。
3 环状过氧化物,是魔鬼也是天使
环状过氧化物通常指环内含有过氧键结构单元的一类有机过氧化物[1]。值得注意的是,当结构中存在易于离去的小分子(如氧气、二氧化碳)结构片段时,环状过氧化物极易分解并迅速释放出气体和能量,容易造成瞬时的剧烈爆炸,其中“撒旦之母”三过氧化三丙酮(Triacetone triperoxide,TATP)就是典型的例证(图1下)。
德国无机化学家Richard Wolffenstein于1895年完成TATP的首次合成,他也成为第一个因使用过氧化氢合成炸药而获得专利的研究者[5]。TATP化学性质极为敏感,稍高的温度或轻微的摩擦都会使其分解为丙酮、氧气和臭氧,并极大概率引发另一分子TATP的分解,在短时间内可释放大量气体从而形成威力巨大的无火焰爆炸(爆速5300 m·s-1,约1.83当量2,4,6-三硝基甲苯)[5]。不同于含氮爆炸物(环三亚甲基三硝胺、2,4,6-三硝基甲苯、季戊四醇四硝酸酯等),TATP中不含硝基基团和发色团,因此可以轻松避过多种爆炸物安检仪器的检测。同时,由于制备原料易得、制备方法简单,TATP成为近年来恐怖分子实施恐怖袭击的首选爆炸物,在法国巴黎、英国伦敦等多地发生的恐怖爆炸袭击事件严重影响了人民的生命财产安全以及各国的社会稳定[6]。因此,在较长一段时间内,“不稳定”“易爆炸”“物理和化学性质敏感”等消极词汇成为了环状过氧化物的标签,这类有机过氧化物的发展也遭遇了空前的阻碍。
不同于人工合成的环状过氧化物“撒旦之母”TATP,自然界创造的环状过氧化物不仅结构稳定,并且呈现出多种生物活性,其中最著名的分子当属从黄花蒿(Artemisia annua L.)中冷萃提取出的萜类化合物——青蒿素(Artemisinin,ART)[7],青蒿素及其衍生物可以高效地治疗疟疾等疾病且治愈率极高。发现青蒿素的中国科学家屠呦呦先生于2015年10月5日荣获诺贝尔生理学或医学奖。
疟疾自古以来就是一种具有全球影响力的衰弱性疾病,长期在亚洲南部、非洲和南美洲等热带国家肆虐,可引起发热、贫血、脾肿大及肾脏损害等症状,每年死于疟疾的人数超过200万,至今疟疾仍是最广泛和最具破坏性的传染病之一。在青蒿素被发现以前,氯喹是有效的抗疟药物,然而氯喹长期、大量的使用导致部分疟原虫对其产生了耐药性,氯喹的疟疾疗效也随之急剧下降,因此一种更有效的抗疟药物亟待发掘。20世纪60年代末中国政府组织了一项旨在寻找抗疟药物的研究,最终在1972年首次从菊花科植物黄花蒿中提取出具有过氧桥键的倍半萜内酯化合物——青蒿素(图2)。自发现以来,青蒿素被证实对各型红细胞内的疟原虫均有强效快速的杀灭作用,并且在被发现40多年后,它仍然是抵御疟疾的堡垒,是所有主要抗疟疗法的基础。不仅如此,在随后的临床研究中发现,青蒿素在抗肿瘤、抗糖尿病、抗真菌、免疫调节等方面也具有较好的治疗效果[8]。
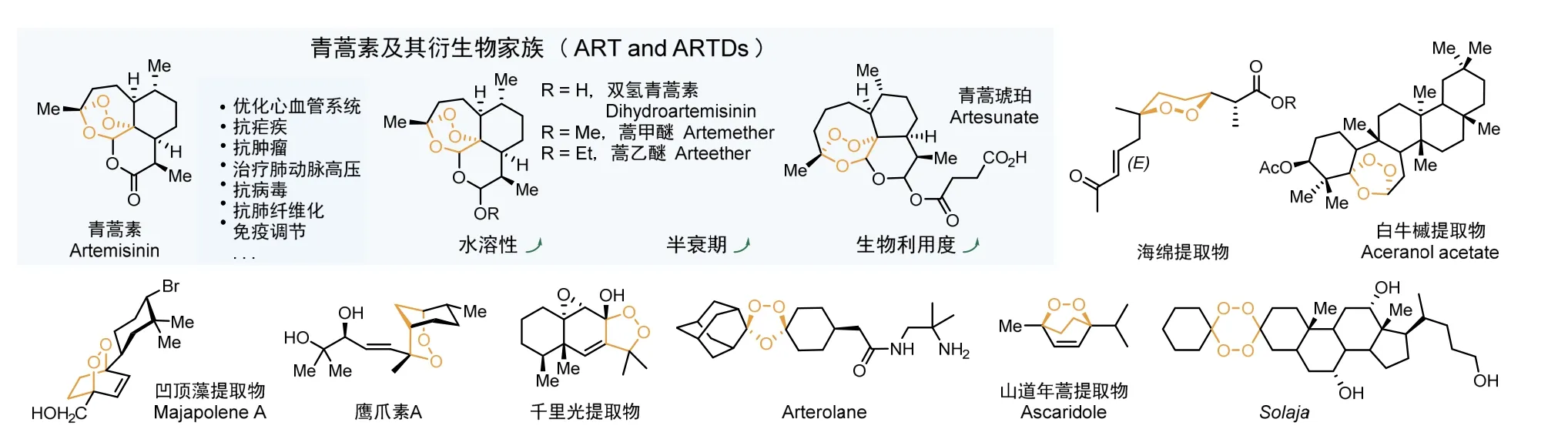
图2 具有生理活性的环状过氧化物
在对青蒿素抗疟机制进行深入研究的过程中发现,如果对过氧桥键结构进行改变,其抗疟作用几乎完全消失,这说明过氧桥键结构单元的存在对于该化合物抗疟作用的发挥至关重要[8]。青蒿素以及衍生物的体内抗疟途径并不单一,其中一种途径属于氧化性机制,主要可以分为两个步骤[9]。首先,青蒿素中的过氧基团经亚铁血红素或游离的亚铁离子(Fe2+)催化活化后还原分解,过氧桥键断裂产生氧自由基。随后,氧自由基经过分子内重排转化为碳原子中心自由基,发生烷基化作用与疟蛋白结合并使疟蛋白功能丧失,从而导致疟原虫的死亡。
近年来,研究工作者从山道年蒿[10]、凹顶藻[11]、鹰爪根[12]、白牛槭[13]等多种天然植物中也成功提取出结构稳定且具有生理活性的环状过氧化物,在抗癌、抗病毒等领域取得突出成果(图2),环状过氧化物也因此逐渐得到了科研领域和医药行业的关注。
4 环状过氧化物在化学发光领域的应用
化学发光反应是利用热化学反应生成的电子激发态产物释放出光子的反应[14]。环状过氧化物结构中的过氧键较弱,过氧键的断裂及随后的化学键重组可以为化学发光过程提供必要的能量,从而实现可见光便捷、安全、高效的产生。因此,化学发光过程常涉及到氧化反应的发生。
鲁米诺反应是化学发光的经典示例之一(图3a)[15]。碱性条件下,鲁米诺分子中的活泼氢被夺走并生成双阴离子,随后经负电荷迁移形成更为稳定的类烯醇结构。H2O2分解出的O2通过环加成与类烯醇结构分子发生反应并生成环状过氧化物活性中间体。该活性中间体不稳定,在释放氮气的同时生成三重激发态3-氨基邻苯二甲酸(T1),双羧基阴离子经系间窜越由三重激发态T1转变为单重态激发态分子S1。最终,单重激发态分子S1转变为基态分子S0,能量以光子的形式释放并在425 nm的波长区域发出蓝色可见光。1936年K. Glue等人发现,将鲁米诺试剂和H2O2或Na2O2在碱性溶液中混合后,遇到血液中的血红素(Heme)会产生较强的发光现象[16],可以做到在不影响后续血型分析的情况下对血液痕迹进行检测[17]。此外,由于鲁米诺试剂稳定易保存、检测方式简单迅速、检测灵敏度高、可检测遗留时间较长的血迹、对人体危害度小,时至今日,利用鲁米诺试剂对犯罪现场血迹残留进行检测已经成为不可或缺的勘察手段之一。
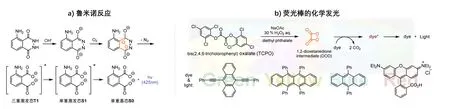
图3 环状过氧化物在化学发光领域的应用
另一个环状过氧化物参与的化学发光是荧光棒中荧光的产生(图3b)[18]。荧光棒中主要由过氧化物(如双氧水)、酯类化合物(如双(2,4,6-三氯苯基)草酸酯,TCPO)和荧光染料(如罗丹明B)三部分物质组成,通常通过内部结构中的玻璃管夹层分隔。需要使用荧光棒时,只需要多次弯折、敲打使玻璃管夹层破碎,荧光棒内的过氧化物和酯类化合物就可以充分混合并迅速发生氧化还原反应,并继而引发后续反应的发生。反应过程中,H2O2对TCPO结构中的羰基进行亲核进攻,生成高活性的环状二酰基过氧储能物二氧杂环丁二酮(1,2-dioxetanedione intermediate,DOD)。活性中间体DOD极不稳定,分解为二氧化碳并释放出光子,随后光子被荧光棒棒体内的染料分子吸收(辐射能量传递),从而发出有颜色的荧光。
类似于上述两种发光过程,环状过氧化物也可以作为萤火虫发光的能量来源(图4)[14]。萤火虫的发光细胞中含有两类物质,一类被称为荧光素,另一类被称为荧光素酶。当氧气和镁离子存在时,萤火虫荧光素可以在荧光素酶的催化下被氧气氧化为环状过氧化物中间体。随后,高活性中间体结构中的过氧键断裂,释放出二氧化碳并产生激发态的氧化荧光素,当氧化荧光素由激发态回到基态时将发出特征光。

图4 环状过氧化物参与的萤火虫发光过程
5 环状过氧化物在合成化学领域的应用
合成化学,以改变分子结构的组成和排布为手段,利用化学反应构筑具有特定结构和功能的化合物。合成化学的诞生可以追溯至1828年Wöhler首次完成尿素的人工合成[19],这一成就有力地证明有机化合物可以通过无机化合物合成。该标志性工作不仅开启了合成化学的大门,也彻底推翻了彼时作为主流的“生命力论”。时至今日,医药[20]、生物技术[21]和纳米技术[22]等领域均离不开合成化学所提供的物质基础和技术支撑。
由于过氧键键能较低,可以在加热、光照等温和的条件下发生断裂,且发生断裂后可以转化为多种官能团(如醛基、羟基、环氧基等),因此合成化学研究人员希望利用适当的策略在天然产物的合成过程中引入过氧键结构单元,从而在不影响分子内其他结构的同时高效引入所需的官能团。1928年,德国化学家O. Diels和K. Alder在研究1,3-丁二烯和顺丁烯二酸酐的相互作用时,发现共轭双烯(双烯体)可与含烯键或炔键的化合物(亲双烯体,提供不饱和键)发生反应生成六元环状化合物,因此这类反应也被称为Diels-Alder反应(简称D-A反应),此类反应具有较好的区域选择性和立体选择性,是现代有机合成反应中构建碳碳键及六元环系的重要手段之一[23]。随后的研究发现,除了碳原子体系外,含有杂原子的不饱和体系也可以作为D-A反应的亲双烯体,当以单线态氧气分子作为亲双烯体时,可以实现环状过氧化物的合成[23]。由于该合成策略避免了强氧化剂的使用,具有较好的官能团耐受度,因此利用D-A环加成反应制备环状过氧化物的策略被广泛应用于多种天然产物(如isochrysohemidin、stemolide)的高效合成当中(图5)[24]。
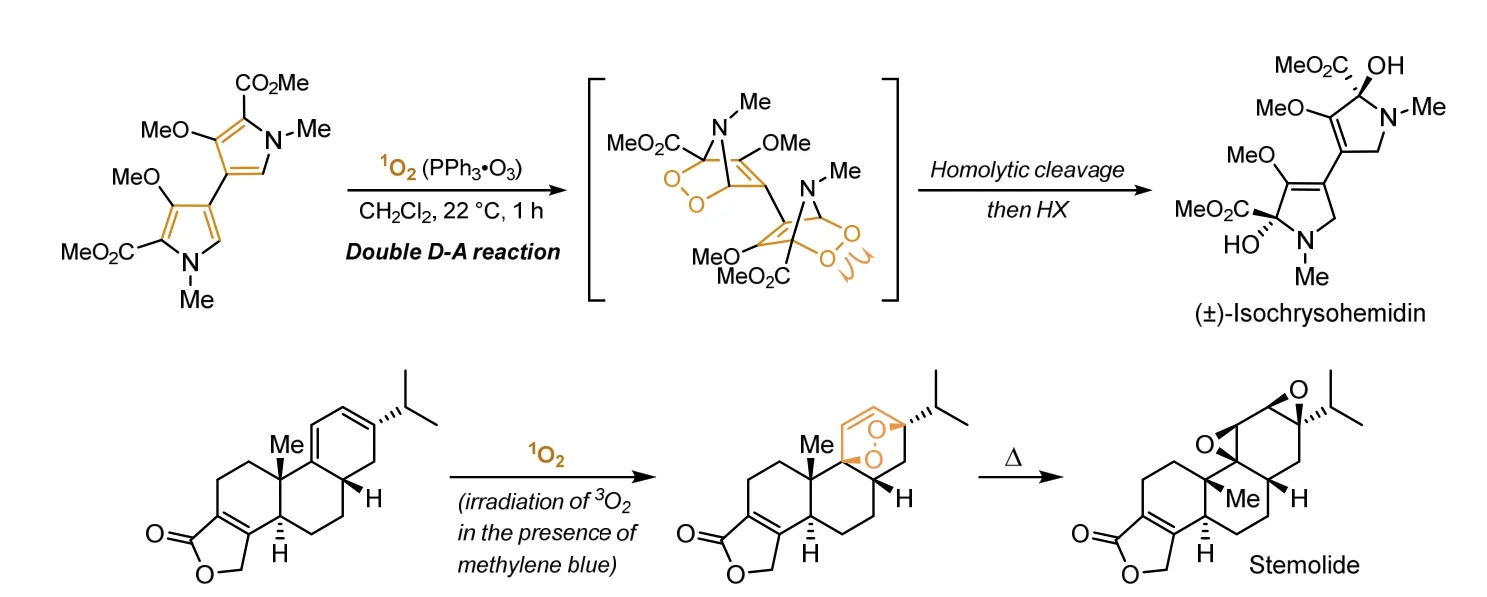
图5 环状过氧化物在天然产物合成中的应用
另一方面,依赖于合成化学以及物理化学领域的快速发展,有机研究人员通过超共轭效应(端基效应为主)的调控降低氧原子电子云密度以稳定过氧键[25],在较大程度上保留环状过氧化物高活性的前提下增加其稳定性,改进了环状过氧化物难分离、易分解等不足,在实验室条件下成功分离并提纯多种具有特殊环状结构的环状过氧化物。随后的实验研究和探索表明,相较于一些结构类似的链状过氧化物,相应的环状过氧化物中的过氧键无法自由旋转,因此具有独有的反应特性。本节中将以邻苯二甲酰环状过氧化物(PPO)和过氧化苯甲酰(BPO,胶粘剂工厂应用最广泛的引发剂)为例,对比环状过氧化物与链状过氧化物的部分区别(图6)。
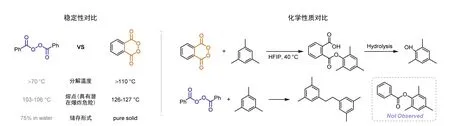
图6 链状过氧化物与环状过氧化物的性质对比
由于高纯度(98%)的BPO稳定性较差,在干燥状态下易因摩擦、冲击或加热而爆炸,因此市售的BPO通常为液型(本品75%与水25%)。然而,使用正确方法合成的高纯度PPO粉末在常温下十分稳定,对其进行研磨、撞击、刮擦等操作,均未观察到任何爆炸或分解现象[26],说明PPO在常温下具有更好的稳定性。不仅如此,在较高的温度下,PPO也表现出更好的热稳定性。在加热条件下,链状过氧化物BPO在70 °C易分解成为游离自由基,在103-106 °C就会迅速发生分解,并有发生爆炸的潜在危险[27]。而热重分析(Thermogravimetric analysis,TGA)表明环状过氧化物PPO在90 °C下仍然保持稳定,在110 °C左右才发生热分解[28](请注意:两种过氧化物在密闭容器中加热,均具有发生爆炸的潜在危险,请在正确的指导下进行安全的实验操作!)。此外,PPO和BPO的化学反应性质也截然不同。2013年Siegel课题组[29]使用环状过氧化物PPO完成了无需金属参与的芳基碳氢键选择性羟基化。反应过程中,PPO中的过氧键发生均裂形成双酰氧基自由基,随后进攻芳环生成芳基酯类化合物,最终通过碱性水解得到取代酚类化合物。然而,当在相似的反应条件下使用链状过氧化物BPO参与反应时,未观察到相应的芳基酯类化合物,只观察到了1,3,5-三甲基苯自身偶联产物的生成。
6 环状过氧化物,内向的后起之秀
部分环状过氧化物表现出的“不稳定”“易爆炸”“性质敏感”只是一层神秘的面纱,而当这一面纱被勇于探索的研究者揭开后,其迷人而独特的性质令人倾心。在人体内,环状过氧化物氧化亚铁离子,生成活性自由基中间体与疟蛋白结合,导致疟原虫的死亡;在生活中,高活性的环状过氧化物中间体的过氧键裂解,释放出能量从而引发随后的化学发光过程;在合成化学领域,相较于结构相似的链状过氧化物,部分环状过氧化物展现出更优异的耐冲击性、热稳定性以及独特的化学合成能力。静若处子,动若脱兔,环状过氧化物就像一个内向的“宝藏男孩”,相信经过不断的探索,这位“后起之秀”将会在材料、制药、生物化学等领域大放异彩。
