基于网络药理学及分子对接探讨补元汤干预慢性阻塞性肺疾病小气道功能障碍的作用机制Δ
2023-03-21陈科胜李少峰危佳敏兰智慧江西中医药大学临床医学院南昌330000江西中医药大学附属医院呼吸科南昌330000
陈科胜,李少峰,昌 毅,危佳敏,魏 焜,兰智慧(.江西中医药大学临床医学院,南昌 330000; 2.江西中医药大学附属医院呼吸科,南昌 330000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的特点为持续性气流受限,临床表现以气喘、咳嗽、胸闷和呼吸困难为主[1]。研究结果表明,COPD发展的核心机制是炎症,导致气流受限的主要因素为小气道病变[2]。小气道病变出现于COPD的早期[3]。小气道通常是指位于8级气道以下至呼吸性细支气管的内径<2 mm的气道,且无软骨支撑,因此容易发生塌陷[4]。小气道表面积相当于大气道表面积的5 000倍,小气道的气道阻力占总阻力的比例<20%,容量占肺容量的98.8%[5]。随着科学技术和临床研究的不断进步,研究结果发现,小气道功能障碍可伴随COPD全程[6]。小气道结构和功能改变对COPD的控制和进展有着持续且显著的影响[7]。因此,寻找能有效、全面治疗COPD小气道功能障碍的方法,已成为COPD治疗的迫切需要。
目前,西医主要采用支气管舒张剂、抗胆碱药及糖皮质激素等药物治疗COPD[8]。对于延缓疾病的发展、提高患者生活质量,依然没有有效的解决方法。究其原因,依靠当前的吸入装置,药物难以到达小气道位置。中医辨证治疗可减少COPD急性发作次数,缓解COPD患者气促症状,提高生活质量[9-10]。COPD在中医学中被归为“肺胀”“喘证”和“咳嗽”的范畴,表现为咳嗽、咳痰、胸闷和喘息等症[11]。国医大师洪广祥教授认为COPD发病的关键因素是宗气虚,而COPD长期反复发作,必先伤于肺,致使肺气虚损,继而损及脾,使脾气亦虚;肺脾气虚愈重,则宗气虚损愈甚;加以温肾纳气之法,实现治疗“动则喘甚”的临床疗效[12]。补元汤是洪广祥教授治疗COPD的经验方,在补中益气汤基础上加温肾药物而成,具体组方为黄芪、党参、炙甘草、当归、陈皮、白术、山萸肉、升麻、锁阳和柴胡,具有益气温阳、燥湿化痰、止咳平喘、化生宗气、滋养元气的作用[13]。临床研究结果表明,补元汤能使COPD稳定期患者小气道功能、活动耐量、急性发作频次和免疫能力得到有效改善[14]。但其具体的作用机制尚不明确。为了进一步探究补元汤治疗COPD小气道功能障碍的作用机制,本研究运用网络药理学以及分子对接方法,搜集和分析药物和疾病的相关信息,为COPD的临床用药提供理论依据。
1 资料与方法
1.1 补元汤活性成分筛选
基于中药系统药理学数据库与分析平台(TCMSP,http: //tcmspw.com/)[15],收集生黄芪、党参、柴胡、当归、升麻、陈皮、白术、山萸肉、锁阳和甘草等10味药物,以口服生物利用度(OB)≥30%和类药性(DL)≥0.18收集补元汤的活性成分,运用Cytoscape 3.9.1软件制作活性成分网络图。
1.2 补元汤活性成分靶点预测
在TCMSP获取补元汤有效成分所对应靶点的蛋白名,利用靶点的蛋白名在Uniprot数据库(http://www.Uniprot.org/)中进行基因标准化,得到靶蛋白所对应的基因名。并通过其插件CytoNCA进行有效成分及网络拓扑学参数分析,参数值越大,说明该成分为补元汤的关键有效成分。
1.3 COPD相关靶点预测
以“Chronic Obstructive pulmonary Disease”为关键词,使用Disgenet网站(http://www.disgenet. org/home)、GeneCards平台(https://www.genecards.org/)、人类孟德尔遗传综合数据库(OMIM,https://www.omim.org/),搜索COPD相关靶点及基因,将3个数据库得到的COPD靶点及基因删除重复值,最终得到COPD相关靶点。
1.4 补元汤治疗COPD靶点预测
通过Venny 2.1.0在线工具绘制补元汤有效靶点与COPD相关靶点的韦恩图并取交集,得到补元汤与COPD共同作用的靶点,即为补元汤治疗COPD的潜在靶点。
1.5 构建成分网络图
将补元汤中药物的组成、有效成分以及相关靶点导入Cytoscape 3.9.1软件中,绘制药物-成分-靶点相互关系网络图。
1.6 药物成分与疾病靶点蛋白质-蛋白质相互作用(PPI)网络构建
将补元汤和COPD的共同作用靶点导入STRING平台(https://string-db.org/),选定物种为“Homosapiens”,并设定靶点关联的置信度为0.40,构建PPI网络,并将下载的“tsv.”文件数据导入 Cytoscape 3.9.1软件实现可视化,并通过设置度值,得到核心靶点。
1.7 基因本体(GO)功能富集分析与京都基因与基因组百科全书(KEGG)通路富集分析
将补元汤与COPD的交集靶点导入Metascape平台中进行GO功能富集分析和KEGG通路富集分析,选定物种为智人“Homo Sapiens”,设置筛选条件为P<0.05,得到生物学过程富集和通路富集。挑选前20条生物过程、前18条分子功能、前9条细胞组成,以及前18条KEGG通路。
1.8 活性成分-靶点分子对接
借助PubChem平台确定成分名称、分子量和3D结构,然后在RCSB-PDB数据库中下载活性成分所对应的3D结构。然后利用AutoDock Vina软件准备分子对接所需的配体和蛋白质,对于目标蛋白,其晶体结构需预处理,包括去除水分子、加氢、修饰氨基酸、优化能量和调整力场参数,之后满足配体结构的低能量构象。最后将靶点结构与活性成分结构进行分子对接,Pymol 3D结构可视化。
2 结果
2.1 补元汤活性成分筛选
在TCMSP数据库中,通过OB、DL筛选出补元汤各药物有效活性成分153个,其中黄芪17个,党参17个,柴胡13个,陈皮5个,升麻8个,白术4个,山萸肉14个,当归2个,锁阳9个,炙甘草87个,药物共同活性成分12个,见表1。

表1 补元汤活性成分信息Tab 1 Active ingredients of Buyuan decoction
2.2 补元汤活性成分靶点预测
将TCMSP数据库中获取的补元汤相关靶点输入Uniprot数据库进行基因标准化,删除重复值后共得到作用靶点284个。将上述药物、成分及靶点导入Cytoscape 3.9.1软件进行可视化。图中用蓝色圆形表示补元汤药物,用橙色菱形、粉色菱形及绿色六边形分别表示药物有效成分、药物共同成分及预测靶点,节点之间的边表示药物-成分-靶点之间的相互作用关系。将预测靶点按度值进行分析,图形越大,说明该靶点为重要靶点,其对应的活性成分也越多,该成分越可能是核心活性成分,见图1。利用CytoNCA插件计算网络拓扑学参数得出前4位活性成分分别为槲皮素、山柰酚、豆甾醇和谷甾醇,见表2。
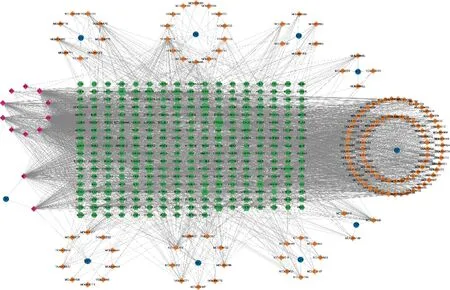
图1 补元汤治疗COPD药物-成分-靶点网络图Fig 1 Network diagram of drug-ingredient-target of Buyuan decoction in the treatment of COPD
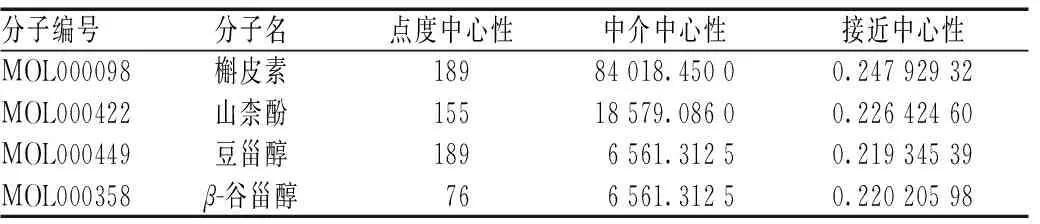
表2 补元汤治疗COPD的主要活性成分Tab 2 Main active ingredients of Buyuan decoction in the treatment of COPD
2.3 COPD相关靶点预测
以“Chronic obstructive pulmonary disease”为检索词,通过Disgenet、OMIM和GeneCard等平台搜索,最终在Disgenet中得到靶点588个,OMIM中得到靶点49个,GeneCards中得到靶点199个,对各基础工具检索的结果进行合并,对相同靶点去重后共得到疾病靶点1 038个。
2.4 补元汤治疗COPD靶点和PPI网络的构建
在Venny 2.1.0在线工具中导入补元汤的相关靶点和COPD的相关靶点取交集,共得到49个共同作用靶点,见图2。将49个共同靶点导入STRING数据库中,构建PPI网络图,并下载“tsv.”文件通过Cytoscape进行可视化,见图3。寻找靶点与靶点间直接及间接作用关系。用图形面积大小以及颜色深浅表示度值的大小,图形面积越大,颜色越深,表明自由度值越高,其参与的生物功能也越丰富。图3中有节点49个,边1 116条,其中最小自由度30,最大自由度60,平均自由度45。再利用CytoNCA插件计算网络拓扑学参数,结果表明,白细胞介素(IL)6、蛋白激酶B(Akt)1、肿瘤坏死因子(TNF)、血管内皮生长因子A(VEGFA)、基质金属蛋白酶9(MMP9)、肿瘤蛋白p53(TP53)和IL-1β等拓扑学参数值,点度中心性、中介中心性和接近中心性最高,为补元汤治疗COPD的主要靶点,见表3。
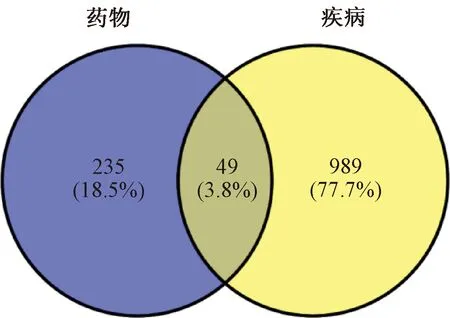
图2 补元汤活性成分靶点与COPD治疗相关靶点韦恩图Fig 2 Venn diagram of targets of active components of Buyuan decoction and COPD treatment-related targets
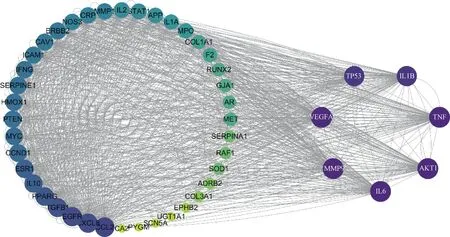
图3 补元汤治疗COPD的PPI网络图Fig 3 Network diagram of protein-protein interaction of Buyuan decoction in the treatment of COPD
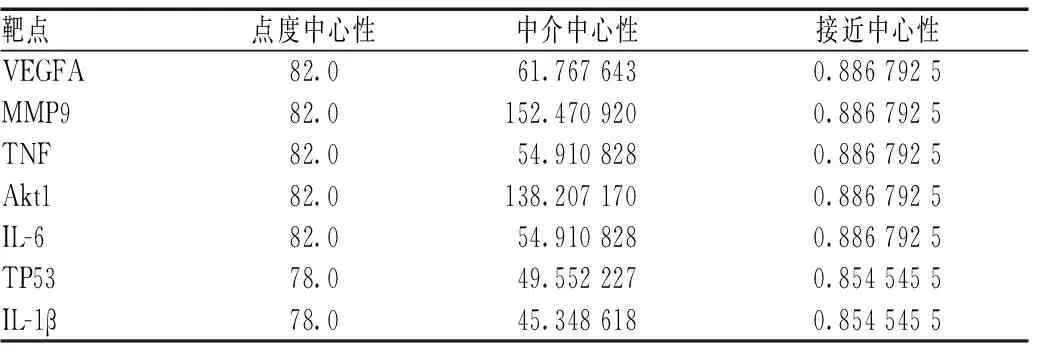
表3 补元汤治疗COPD的主要靶点(度值排序居前7位)Tab 3 Main targets of Buyuan decoction in the treatment of COPD (top 7 ranked by degree)
2.5 GO功能富集分析与KEGG通路富集分析
把补元汤作用于COPD的49个共同靶点导入Meascape数据库中,进行GO和KEGG富集分析,设置物种为智人,P<0.05,其中GO得到分子功能(MF)414个;生物进程(BP)3 879个;细胞组分(CC)297个;KEGG分析得到214条与COPD有关的通路。通过作图工具R软件绘制出补元汤治疗COPD的KEGG分析气泡图以及补元汤治疗COPD的GO分析条形图,见图4—5。从图中可以得出,补元汤治疗COPD的主要通路为晚期糖基化终末产物(AGE)-AGE受体(RAGE)和缺氧诱导因子-1(HIF-1)信号通路。其中AGE-RAGE信号通路参与的基因包括Akt1、细胞周期蛋白D1、IL-1A、一氧化碳合酶3、糜蛋白酶;HIF-1信号通路参与的基因包括表皮生长因子受体、酪氨酸激酶受体、血红素加氧酶1、IFNG、IL-6、VEGFA等。
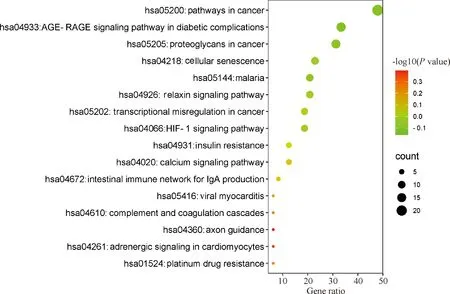
图4 补元汤作用靶点的KEGG分析图Fig 4 KEGG analysis chart of targets of Buyuan decoction
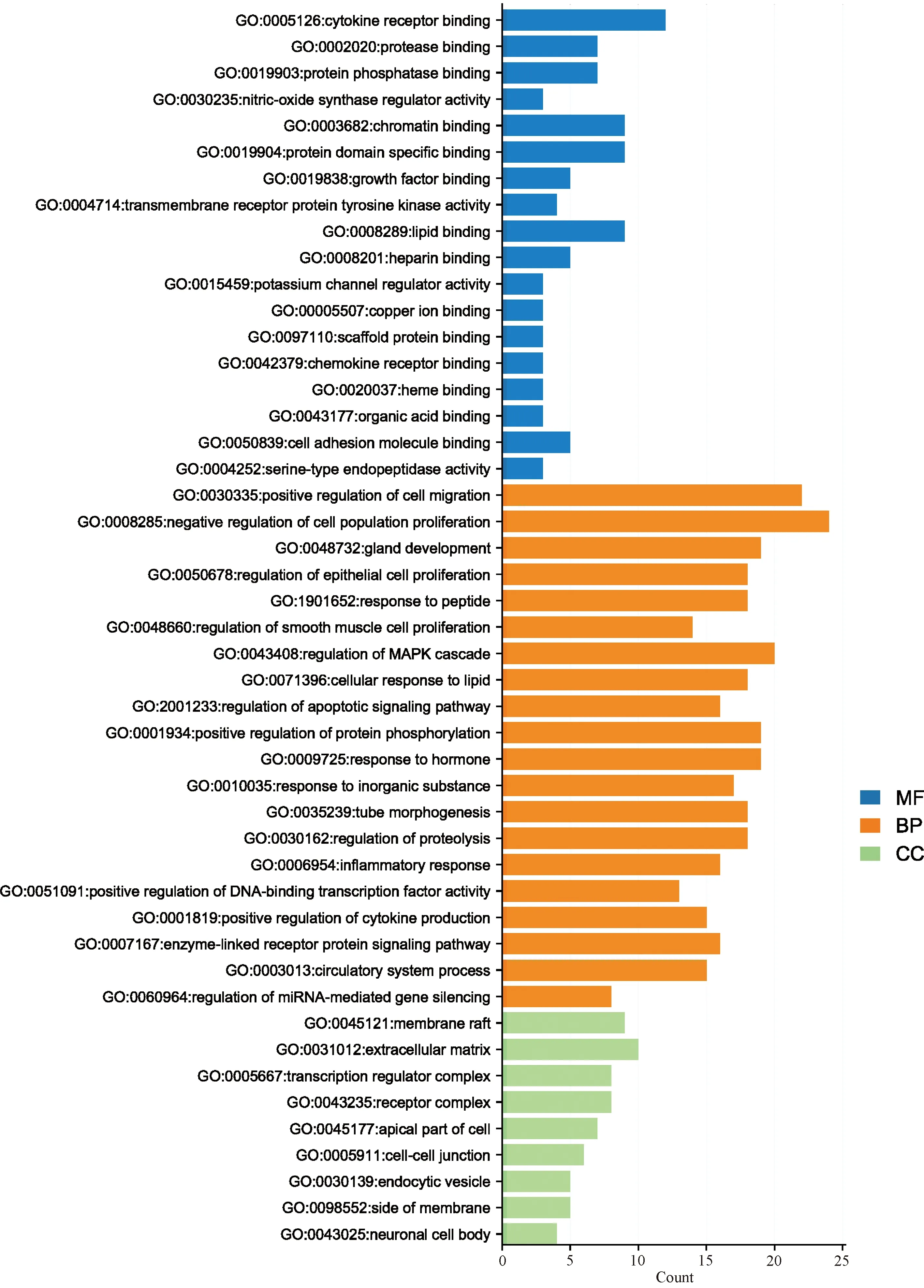
图5 补元汤作用靶点的GO分析图Fig 5 GO analysis chart of targets of Buyuan decoction
2.6 分子对接验证
将补元汤中的前3位有效成分与PPI中得到的前4位核心蛋白靶点进行分子对接,受体蛋白IL-6、VEGFA、MMP9及TNF对应的PDB-ID分别为1ALU、1MKK、6ESM及5UUI,其“Affinity ”(J/mol)值即代表两者结合的结合能力,结合能力越低,配体与受体结合越稳固。分子对接结果见表4。山柰酚、槲皮素2种主要活性成分分子对接模式图均有氢键作用,说明关键分子与靶点蛋白作用结构较为稳定,结合活性较高,见图6。
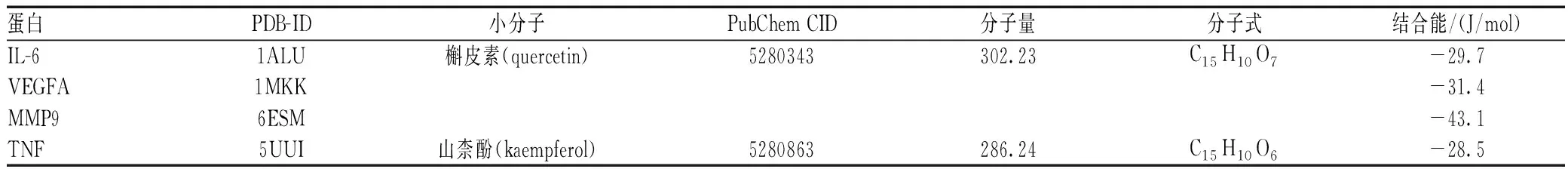
表4 分子对接结合能Tab 4 Molecular docking-binding energy

A.槲皮素-MMP9;B.槲皮素-VEGFA;C.槲皮素-IL-6;D.山柰酚-TNFA. quercetin-MMP9; B. quercetin-VEGFA; C. quercetin-IL-6; D. kaempferol-TNF图6 分子对接模式图Fig 6 Diagram of molecular docking pattern
3 讨论
气流受限、气道损伤和重塑、肺实质破坏导致肺气肿等是COPD的主要病理变化[16]。小气道是COPD中气流受限的主要部位,而小气道周边肺泡附着点丧失是影响气流受限的主要决定因素[17]。此外,肺泡附着点的丧失与气道壁中的中性粒细胞炎症及气道外来的胶原降解有关,也是COPD肺功能降低的主要因素[18]。现有研究结果表明,微生物和吸入颗粒侵犯小气道时,将激活先天免疫信号传导,进而导致持续的中性粒细胞浸润到小气道壁[19]。中性粒细胞通过分泌丝氨酸蛋白酶破坏肺泡附着点[20]。总而言之,有害颗粒的连续沉积会诱发慢性炎症免疫细胞浸润、组织修复和气道重塑过程的循环,上述过程使得小气道管腔横截面积显著降低,这些是导致气道气流受限的病理基础[21]。
PPI网络图显示,补元汤治疗COPD的主要靶点为IL-6、TNF、VEGFA、MMP9、Akt1、IL-1β和TP53等。IL-6由巨噬细胞和T细胞产生,是一种可溶性介质,具有多效性作用,主要体现在炎症、免疫反应和造血等方面,并长期参与炎症刺激导致气道阻塞、气道及血管重塑[22];TNF-α是TNF中调节炎症的关键因子,也是嗜中性粒细胞化学吸引剂,可诱导炎症细胞积累、刺激炎症介质的产生,引起氧化应激,血管生成和小气道重塑[23];MMP-9是MMP家族的重要成员,可重塑小气道及降解肺泡壁基底膜,并激活和释放VEGFA,诱导肺部血管新生与血管重塑[24];Akt1为苏氨酸蛋白激酶,通过诱导巨噬细胞和成纤维细胞分化,使炎症反应加重及气道呈纤维化改变,从而导致小气道的固定性梗阻[25];IL-1β为促炎细胞因子,在调节免疫反应和炎症过程中起着核心作用,包括介导参与继发性炎症的大量基因的表达,协调局部炎症的各方面,并在感染部位吸引和激活适应性免疫系统的细胞。
在KEGG通路富集分析中,AGE-RAGE信号传导在COPD中是个信号级联反应,通过激活多种细胞内途径,促进炎症细胞因子的产生。AGE-RAGE信号传导着不同的效应,在内皮细胞中,AGE-RAGE信号传导调节细胞凋亡、氧化应激、自噬、炎症反应和内皮间充质细胞的转变等过程;在平滑肌细胞中,促进活性氧的产生、增殖和钙化[26]。HIF-1信号通路是细胞和机体在低氧适应性反应中至关重要的调控因子,由1个α亚基(氧不稳定)和1个β亚基(氧稳定)异源二聚构成,HIF-1β表达不受氧气影响,而HIF-1α是细胞对缺氧、氧化剂和炎症反应的重要转录调节剂[27]。在肺组织缺氧情况下,刺激HIF-1α高度表达,并且激活相关能量代谢、糖类酵解和血管生成维持氧平衡。HIF-1α可作用于VEGF,提高血氧含量[28]。HIF-1α与VEGF关系密切,低氧条件下,HIF-1α可作用于靶基因VEGF的转录调控,上调下游的VEGF表达,提升血管通透性,出现血管渗出物和组织水肿等情况,易引发炎症,加重肺的病变[29-30]。此外,HIF-1α还可上调VEGF表达使内皮细胞增殖和转移,起着能让缺氧细胞存活的作用[31]。上述通路可以通过调控炎症因子释放和抑制炎症反应等途径,在炎症反应、血管生成等方面起着重要作用,达到治疗COPD的效果。
山柰酚、槲皮素和谷甾醇等已被证明具有抗氧化、抗炎作用[32-34]。山柰酚是广泛存在于多种植物中的多醇羟基黄酮类化合物[35];其可降低促炎细胞因子胸腺基质淋巴细胞生成素、TNF和IL的产生,以及mRNA表达,发挥重要的抗炎作用[36]。槲皮素是类黄酮化合物,可以改善精神状态,降低感染风险[37];其通过减少氧化应激,肺部炎症、弹性蛋白酶、MMP9和MMP12的表达,改善肺部的弹性,减轻气道炎症[38];其还具有广谱抗菌特性,对细菌和真菌有良好的抑制作用,其抗菌机制主要包括破坏细菌的细胞壁和改变细胞通透性,影响蛋白质的合成和表达,降低酶活性,抑制核酸合成[38]。谷甾醇可通过增加抗菌肽表达、减少细菌结合位点结合等方式起到杀伤病原微生物的作用[39];还可通过抑制P38丝裂原活化蛋白酶、细胞外调节蛋白激酶和核因子κB通路的活化来发挥抗炎作用。豆甾醇是一种具有药理学性质的植物甾醇,可通过抑制促炎介质TNF-α、IL-6和IL-1β的表达,起到抗炎作用[40]。上述3类有效成分都具有抗炎、抗氧化的作用,可减轻小气道炎症,有益于预防或减缓COPD中小气道疾病的进展,可有效改善小气道功能,有望成为治疗COPD小气道功能障碍的新型药物。
综上所述,本研究通过网络药理学方法及分子对接技术,得出补元汤能够多成分、多靶点、多通路治疗COPD,其活性成分山柰酚、槲皮素和谷甾醇等作用于IL-6、TNF、VEGFA、MMP9、Akt1、IL-1β和TP53等靶点,通过AGE-RAGE信号通路和HIF-1信号通路,抑制细胞因子释放,减轻小气道过度免疫反应并消除炎症;防止小气道周围肺泡附着点被破坏,并促进血管生成,进而改善小气道功能,达到治疗COPD的效果,从而有效改善COPD患者的肺功能、活动耐量。
